基于MR灌注成像筛查的重度颅内动脉狭窄病人药物治疗的疗效观察
2018-11-14,,,,,
,,,,,
颅内动脉粥样硬化(ICAS)占亚洲人群缺血性卒中病因的33%~50%[1],在SAMMPRIS试验后国内外对于ICAS的药物治疗与血管内介入治疗选择争议较大。除动脉狭窄程度外,侧支循环代偿、血管灌注等因素亦至关重要。我院采用MR灌注成像技术检查指导颅内动脉重度狭窄(70%~99%)病人的治疗策略选择,现报道如下。
1 资料与方法
1.1 观察对象 选取我院2012年9月—2015年2月进行MR灌注成像技术检查的颅内动脉重度狭窄(WASID)病人(研究组),筛选出灌注好的病人(研究组)。纳入标准:①年龄40岁~85岁;②经CT血管造影(CTA)或磁共振血管造影(MRA)检查发现颈内动脉颅内段、大脑中动脉M1段粥样硬化性狭窄,且狭窄率达70%~99%;③MR灌注检查提示狭窄血管流域血流灌注好;④签署知情同意书。排除标准:①脑出血,包括脑实质出血、蛛网膜下腔出血;②已明确超过颅内大动脉66.7%以上范围的大面积脑梗死病人;③大动脉炎导致的颅内动脉狭窄;④存在抗栓治疗禁忌证,如活动性出血、消化道出血及出血性疾病等;⑤对比剂过敏者。共入组35例,男20例,女15例,年龄46岁~83岁(67.34岁±15.77岁)。选取同期经CTA、MRA或数字减影血管造影(DSA)证实的颅内动脉重度狭窄病人,未行MR灌注成像扫描的病人为对照组,共41例病人,其中男23例,女18例,年龄52岁~79岁(62.99岁±19.28)岁。两组病人均予强化药物治疗。
1.2 检查方法 详细询问病史,对病人的年龄、性别、高血压病、糖尿病、冠心病、吸烟等危险因素进行对比分析并评估相关因素。详细进行神经系统检查及心电图、超声心动图、胸片等常规检查。测定血生化、同型半胱氨酸及C反应蛋白,评估危险因素。CTA、MRA或DSA检查评估血管狭窄程度、性质等情况。
研究组病人均行MR灌注成像检查,然后结合病人临床症状及已有影像检查结果,确定狭窄血管责任灌注区,手工绘制患侧异常灌注区域及同侧小脑半球(region of interest,ROI),分测量患侧大脑中动脉(MCA)分布区以及同侧小脑对照区的脑血流量图(cerebral blood flow,CBF)、脑血容量图(cerebral blood volume,CBV)、平均通过时间图(mean transit time,MTT)、峰值时间(time to peak,TTP),进行定量分析。
1.3 评估标准
1.3.1 血管狭窄程度的评估 颅内动脉血管狭窄率的测量采用华法林-阿司匹林治疗症状性颅内动脉狭窄临床研究(the Warfarin and Aspirin for symptomatic intracranial disease,WASID)标准测量[2]:狭窄率=(狭窄部近心端正常血管直径-狭窄部血管直径)/狭窄部近心端正常血管直径×100%。颅内动脉狭窄程度的计算根据北美症状性颈动脉内膜切除试验(NASCET)标准[3]:狭窄率<50%定义为轻度狭窄,狭窄率50%~70%定义为中度狭窄,狭窄率70%~99%定义为重度狭窄。
1.3.2 灌注评估标准 参照CTP脑灌注情况分级。①灌注延迟:MTT延长,CBV增加或正常;②灌注不足:MTT延长,CBV和CBF明显减少;③过度灌注:CBV和CBF增加;④正常灌注:CBV、CBF及MTT均正常[4]。根据狭窄血管责任灌注区域中的异常灌注区域大小,以及灌注区域中的参数变化来判定灌注好与差。MRP灌注好的判定标准:①狭窄血管责任灌注区域中脑组织灌注完全正常;②存在灌注延迟或灌注不足,且异常灌注区域面积占该血管责任灌注区33.0%以内者。MRP灌注差的判定标准:存在灌注延迟或灌注不足,且异常灌注区域面积占该血管责任灌注区33.3%以上者。
1.4 治疗方法 ①抗血小板聚集治疗:阿司匹林肠溶片0.1 g/ d+氯吡格雷薄衣片75 mg/ d,双联抗血小板聚集治疗持续3个月后改为单药抗血小板聚集长期维持治疗。阿司匹林肠溶片0.1 g/d或氯吡格雷薄衣片,75 mg/d;②他汀治疗:强化他汀治疗1周(阿托伐他汀钙薄衣片40 mg,每晚1次)后改为常规剂量长期维持治疗(阿托伐他汀钙薄衣片20 mg,每晚1次);③谨慎降压:收缩压控制在(120~150)mmHg;④控制血糖;⑤保护胃黏膜治疗;⑥饮食控制及适当运动。
1.5 随访登记 建立随访登记表,由专人负责随访及监督复查、服药,随访时间2年。其中2年内至少每个月门诊随访1次,了解是否发生责任动脉供血区的短暂性脑缺血发作或脑梗死,对于发生缺血性脑卒中事件的病人及时行头颅CT或MRI检查,明确颅内病灶与目标动脉的关系,只有颅内病灶与目标动脉之间有明确的关系才作为阳性结果进行分析。并记录两组病人死亡率、症状性颅内出血、消化道出血等并发症的发生率。
1.6 统计学处理 采用SPSS 20.0软件进行数据分析,两组均数比较采用独立样本t检验,两组率或构成比的比较采用卡方检验,当不满足卡方检验的条件时,采用校正χ2检验或Fisher精确检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床资料比较 研究组共35例,颈内动脉颅内段狭窄8例,大脑中动脉M1段27例,血管狭窄率在70%~99%(85.22%±10.76%)。对照组共41例,其中颈内动脉颅内段狭窄3例,大脑中动脉M1段22例,基底动脉狭窄10例,大脑后动脉P1段狭窄6例,血管狭窄率在70%~99%(81.36%±17.02%)。两组病人年龄、高血压病、糖尿病、血管狭窄率比较差异无统计学意义(P>0.05),具有可比性。详见表1。
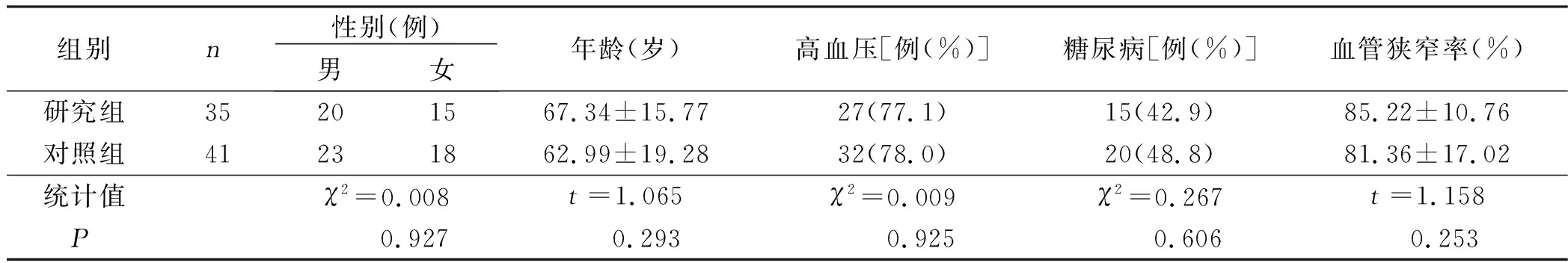
表1 两组病人临床资料比较
2.2 两组病人两年内卒中发生率比较 所有病人均随访两年,研究组出现责任血管缺血性脑卒中事件共4例,短暂性脑缺血发作3例,急性腔隙性脑梗死1 例。对照组出现责任血管缺血性脑卒中事件共13例,其中短暂性脑缺血发作5例,脑梗死8例。两组对比,研究组卒中发生率11.4%,明显低于对照组的31.7%,差异具有统计学意义(χ2=4.471,P<0.05)。
2.3 两组安全性比较 随访期间,研究组中未出现症状性颅内出血,1例死亡,系肺部感染后心力衰竭死亡。对照组中3例病人因脑梗死后出血转化,6例死亡,其中3例病人因脑梗死后脑疝死亡,3例病人因脑梗死后继发肺部感染死亡。两组病人均未出现上消化道出血等并发症。两组死亡率及症状性颅内出血、上消化道出血等并发症发生率比较差异无统计学意义(P>0.05)。
3 讨 论
华法林-阿司匹林治疗症状性颅内动脉狭窄研究表明,单纯药物治疗在降低颅内动脉粥样硬化性狭窄病人卒中再发、脑出血、死亡等风险方面不能取得满意疗效[5]。随着导管内技术及血管内治疗的发展,经皮血管成形和支架置入术(percutaneous angioplasty and stenting,PTAS)被广泛应用于动脉粥样硬化治疗,但始于2008年的支架和强化药物治疗预防颅内动脉狭窄病人脑卒中复发(SAMMPRIS)研究,旨在探讨采用Wingspan系统的PTAS联合积极药物治疗在预防缺血性卒中方面是否优于单独的积极药物治疗,却因PTAS组围术期卒中和死亡风险高,试验被提前中止,最终得出了积极药物治疗在高危的症状性ICAS病人的治疗中优于PTAS的结论[6]。在我国,颅内动脉粥样硬化性狭窄是缺血性脑卒中的重要病因,开展症状性颅内动脉狭窄的支架成形术与强化药物治疗的随机对照研究,将有助于建立针对症状性颅内动脉狭窄治疗的最佳方案[7]。2015年首都医科大学附属天坛医院缪中荣教授教导的中国17家医院共同参与完成的一项采用支架成形术治疗症状性颅内动脉粥样硬化性狭窄的登记研究表明,在中国血管内支架成形术对重度症状性颅内动脉粥样硬化性狭窄病人的短期安全性和有效性是可以接受的[8]。分析数据差异,除了实验本身设计、手术操作、结果解析等方面的改进外,病人的筛选起着重要的作用。仅凭动脉狭窄的程度来筛选适宜血管内支架成形术的病人明显不够严谨,血流动力学、侧支循环、脑血管自身调节功能等因素对预后起着强预示作用。
当血管重度狭窄甚至闭塞继发灌注压降低时通过侧支循环生成及脑血管自身调节机制,可以重新分布血流来代偿性增加缺血区域的灌注。磁共振灌注成像(PWI)近年来被广泛应用于脑梗死及脑动脉狭窄病人灌注评估,能准确地判断是否存在脑血流异常灌注区及其范围大小,并量化地评估其异常灌注的程度,通过各个参数重建的脑功能彩图能直观提供与临床症状和责任血管相应的脑血流灌注异常区域,为临床治疗策略的选择提供重要参考依据[9]。MRI灌注成像可以快速、准确、几乎无创地评价脑微血管内的血流动力学变化,并很容易与常规MR同时进行,是目前较理想的同时反映脑梗死形态和功能的检查方法。其相对于CT灌注检查,MRI灌注成像无须快速大量团注碘对比剂,且MR检查具有无辐射等优点,尤其适用于碘过敏病人、碘对比剂禁忌证及术后反复随访病人,应用前景将更为广阔。
本研究通过MR灌注成像对重度颅内动脉狭窄病人进行筛查,对灌注下降不明显等卒中低危人群进行积极的药物治疗,而非介入治疗,研究表明,研究组病人卒中发生率较低,与同期收治未行灌注评估的病人进行对比,研究组卒中发生率明显低于对照组。而两组死亡率与症状性颅内出血、上消化道出血等并发症的发生率对比无统计学意义,可能与样本量不足有关,有待增加样本量后对比,进一步探讨药物治疗对重度颅内动脉狭窄合并良好灌注者远期预后的影响。鉴于症状性颅内动脉狭窄系常见病,认为对颅内动脉粥样硬化性狭窄病人充分的评估至关重要,结合血管狭窄率与MR灌注成像检查,为病人量身定制合适的个体化治疗方案。
