肠道菌群失调加重小鼠局灶性脑缺血再灌注后炎性反应
2018-11-14李元培纪明慧董瑞宾石艳超
李元培, 韩 晋, 纪明慧, 董瑞宾, 石艳超
人类肠道至少含有1000种菌群,共计超过100万亿个细菌[1]。饮食习惯、生活方式、卫生习惯、遗传因素、抗菌药的使用等都会影响肠道菌群的种类和丰富度[2,3],同时其在体内数量和比例呈现动态改变。炎性反应是脑缺血再灌注损伤 (cerebral ischemia reperfusion injury,CIR)中复杂的级联反应之一,涉及多种炎性介质、炎性细胞及炎症反应通路,阻断CIR中炎性反应可显著减轻脑损伤。有研究表明[4],肠道菌群失调与心脑血管疾病的发生密切相关,其通过炎性反应促进动脉粥样硬化的形成。
本实验通过构造脑缺血再灌注动物模型,观察肠道菌群失调对小鼠脑缺血的影响、神经功能缺损和脑水肿的程度,血脑屏障功能-即ZO-1表达的情况,以及IL-6、TNF-α和NF-κB炎性标志物的变化,旨在探讨肠道菌群失调对CIR中炎性反应的影响,以期为临床治疗脑梗死提供依据。
1 材料与方法
1.1 实验动物分组及处理 SPF级健康6 w龄性C57BL/6J小鼠,雄性,体重(20±2)g饲养于SPF环境设施。饮用水经高压灭菌消毒,饲料经钴60照射处理。随机分为假手术组、缺血再灌注组(对照组)和菌群失调组。造模前4 d始,假手术组和对照组胃内注入同体积的生理盐水0.2 ml,菌群失调组胃内注入100 mg/ml的头孢曲松溶液0.2 ml,每天两次,时间间隔8 h,连续灌胃4 d。
1.2 小鼠CIR模型制作 参照文献[2]报道的Zea Longa法制备改良线栓法大脑中动脉栓塞模型。术前禁食12 h,不禁饮。腹腔注射10%水合氯醛300 mg/kg麻醉,仰卧位固定于37 ℃恒温电热板上。取颈部正中切口,游离右侧颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉近心端,以无创血管夹夹闭颈总动脉远心端及颈外动脉,于颈总动脉分叉下方剪开一切口,放置预先头端钝化处理的尼龙线(北京西浓科技有限公司),缓慢推进8~10 mm,感觉有阻力时停止,固定于颈总动脉。栓塞1 h后,拔出线栓恢复血流。单笼饲养,自由饮食。再灌注后2 h采用神经功能评分验证造模是否成功,即造模小鼠出现右侧Horner征和左侧以上肢为重的偏瘫,作为动物模型成功的判定标准,剔除不符合标准或死亡的动物,并随机补充。假手术组除不插入线栓外其余相同。
1.3 小鼠神经功能评定 于再灌注后72 h时,进行神经功能评分,参照Zea Longa评分标准:0分,无神经损伤症状;1分,轻微神经功能缺损,不能完全伸展对侧前爪;2分,重度局灶性神经功能缺损,向对侧转圈;3分,重度局灶性神经功能缺损,向对侧倾倒;4分,不能自发行走,意识丧失。
1.4 肠道菌群培养及计数 脑缺血再灌注后72 h,无菌条件下取升结肠内容物,称重后立即将其稀释成10~7浓度,然后分别接种于肠球菌、乳酸杆菌和双歧杆菌的相应培养基中,肠球菌培养基置于35 ℃孵育箱内培养24 h,乳酸杆菌和双歧杆菌培养基置于35 ℃厌氧培养箱中培养48 h,并对相应菌群进行检测。结果以每克升结肠内容物湿重中菌落形成单位的对数值表示(lg CFU/g)。
1.5 脑梗死体积的测定 取再灌注后72 h的小鼠,断头取脑置于-20 ℃冰箱内30 min,自视交叉水平行5个脑冠状切片,片厚约2 mm,将其置于2%的TTC溶液中,37 ℃避光孵育30 min,染色后置于10%甲醛溶液中于4 ℃避光固定24 h,肉眼观察并拍照。应用Image J 软件计算脑梗死体积,公式为:脑梗死体积(%)=[总的梗死体积-(右侧半球体积-左侧半球体积)]/左侧半球体积×100%。
1.6 脑组织含水量的测定 再灌注后72 h,经神经功能评分后,立即将小鼠断头处死。取缺血侧脑组织迅速称其湿重,然后置于100 ℃高温烤箱内,烘干48 h后称其干重。按照Elliott公式,计算出脑含水量,公式为:脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.7 Western blot法检测缺血侧脑组织NF-κB p65和ZO-1的表达 取再灌注后72 h的小鼠,腹腔注射10%水合氯醛300 mg/kg麻醉后,冰PBS心脏灌流,断头取脑。取缺血侧大脑半球,提取脑组织蛋白。采用BCA蛋白定量试剂盒(赛默飞世尔科技)检测蛋白浓度。每孔加入等量蛋白,10%SDS-PAGE凝胶进行电泳,然后转移至甲醇浸泡过的PVDF膜上,1.5%胎牛血清室温封闭1 h后,分别加入NF-κB p65一抗(1∶1000,CST)、ZO-1一抗(1∶500,CST)和β-actin一抗(1∶2000,Santa Cruz),室温孵育12 h后,置入4 ℃冰箱过夜。加入二抗(1∶5000,Transgen Biotech),室温孵育2 h。每个条带加入显影液发光,采用Image J软件测定灰度值,以目的蛋白条带灰度值与内参β-actin条带灰度值的比值反应目的蛋白的表达水平。
1.8 实时定量PCR 取每只小鼠缺血侧大脑半球 获得总 RNA后取10 μl按照反转录酶Ⅱ试剂盒行逆转录操作。扩增条件为:95 ℃预变性30 s,进入循环,95 ℃变性5 s,60 ℃退火30 s,共循环40次,随后95 ℃延伸15 s,60 ℃延伸1 min,95 ℃再延伸15 s,最后降至4 ℃。分别得到IL-6、TNF-α和内参β-actin的Ct值后,采用相对定量的方法计算,△Ct=目的基因Ct值-内参基因Ct值。以2-△Ct为指标,分别计算出IL-6、TNF-α和内参β-actin mRNA的相对表达水平。实验重复3次,求得平均值作为分析结果。
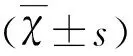
2 结 果
2.1 肠道菌群计数 缺血再灌注后72 h,取小鼠升结肠内粪便进行培养、计数。假手术组和对照组肠道内菌群无差异(P>0.5)。菌群失调组小鼠肠球菌增多,乳酸杆菌及双歧杆菌减少,与假手术组及对照组相比存在差异(P<0.05)(见表1)。
2.2 神经功能评分 小鼠取材前进行神经功能评分。假手术组因未阻塞大脑中动脉,未出现神经功能缺损症状,评分均为0分。与假手术组比较,对照组和菌群失调组的神经功能评分较高(P<0.05);与对照组比较,菌群失调组神经功能评分较高(P<0.05)(见表2)。
2.3 脑梗死体积和含水量的测定 假手术组小鼠脑组织未见脑梗死区域,对照组可见明显脑梗死灶(P<0.01),与对照组相比,菌群失调组脑梗死灶体积明显增大(P<0.05)(见图1);3组间脑含水量有明显差异(P<0.05),菌群失调组脑含水量较对照组高(P<0.05)(见表3)。
2.4 NF-κB p65和ZO-1蛋白的表达量 与假手术组比较,对照组和菌群失调组的NF-κB p65表达明显上调(P<0.05);与对照组比较,菌群失调组的NF-κB p65的表达增加(P<0.05)。与假手术组比较,对照组和菌群失调组的ZO-1表达明显减少(P<0.05);与对照组比较,菌群失调组ZO-1的表达减低(P<0.05)(见图2、表4)。
2.5 IL-6和TNF-α表达量 与假手术组比较,对照组和菌群失调组的IL-6和TNF-α mRNA相对表达量明显升高(P<0.05);与对照组比较,菌群失调组的IL-6和TNF-α mRNA相对表达量明显升高P<0.05)(见表5)。
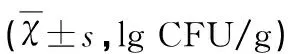
表1 灌胃5 d小鼠肠道菌群的分布
与假手术组相比较*P>0.05;与菌群失调组相比较#P<0.05
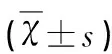
表2 脑再灌注后72 h各组小鼠神经功能评分
与假手术相比较*P<0.05;与对照组相比较#P<0.05
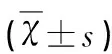
表3 脑再灌注后72 h各组小鼠脑梗死体积及脑含水量比较
与假手术组相比较*P<0.05;与对照组相比较#P<0.05
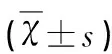
表4 脑再灌注后72 h各组小鼠脑组织NF-κB p65和ZO-1的表达量
与假手术组相比较*P<0.05;与对照组相比较#P<0.05
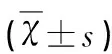
表5 脑再灌注后72 h各组小鼠脑组织IL-6 mRNA和TNF-α mRNA 相对表达量
与假手术组相比较*P<0.05;与对照组相比较#P<0.05
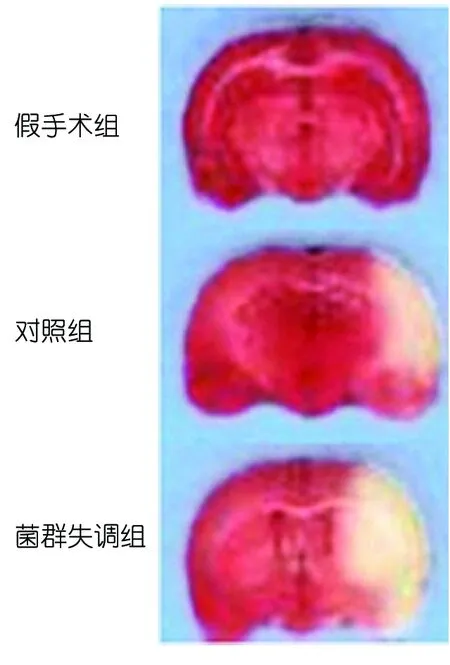
图1 脑再灌注后72 h各组小鼠脑梗死体积
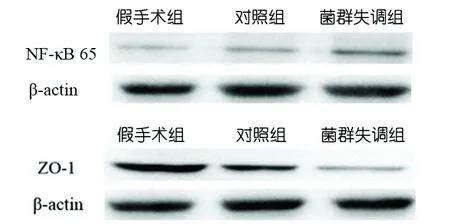
图2 再灌注后72 h,各组小鼠梗死侧脑组织NF-κB p65 和ZO- 1印迹条带
3 讨 论
肠道菌群参与生命早期肠道免疫的形成,机体的慢性感染可促进动脉粥样硬化发生、发展。肠道菌群可影响宿主的新陈代谢、免疫反应和炎症反应[5]。通过分析微生物的功能组学发现,症状性动脉粥样硬化患者肠道菌群富含编码肽聚糖合成的基因,肽聚糖是细菌细胞壁的主要成分,可能通过激活机体免疫系统和中性粒细胞引起动脉粥样硬化[4]。动脉粥样硬化是脑卒中最常见的病理过程,血管炎症是动脉粥样硬化的重要环节。病理状态下,微生物激活机体固有免疫系统,促进炎性反应,加重血管炎症[6]。有研究发现,通过肠道菌群移植可增加血栓风险[7]。
也有研究表明证实,肠道菌群的代谢产物可通过激活免疫系统,加重血管壁炎症,促进动脉硬化。少量肠道细菌可进入血液循环,引起全身慢性低度炎症,这种慢性炎症在动脉粥样硬化中普遍存在[8]。肠道菌群失调参与代谢性和炎症性疾病的发生和进展,因此保持肠道菌群稳态尤为重要。然而,其在脑梗死中的作用尚未见报道。
CIR损伤的机制主要包括兴奋性氨基酸毒性、细胞内钙超载、一氧化碳失调控、炎性反应等。炎性反应在CIR损伤中起着关键作用,加重了脑损害[9],其病理基础以IL-6和TNF-α等为代表的多种炎性介质失控、释放而形成“瀑布效应”,引起继发性神经细胞变性、坏死、凋亡等[10]。IL-6是触发炎性反应的重要介质之一,脑缺血后其表达增多,对神经元有毒性作用,目前认为其是急性缺血期脑损伤程度的一个标志[11]。TNF-α是中枢神经系统参与炎性反应和免疫应答的重要介质,其可激活小胶质细胞、破坏BBB、促进炎性细胞的迁移,最终对神经元造成损伤[12]。
基于以上研究,我们推测,肠道菌群失调通过影响免疫炎症反应加重了脑梗死的病情。
CIR模型是研究脑梗死较好的动物模型,脑梗死的体积直接反映了脑损伤的严重程度,神经功能评分间接反映了病情的严重程度。本实验,成功制造了肠道菌群失调动物模型,发现菌群失调组的神经功能评分及脑含水量高于对照组,提示肠道菌群失调在一定程度上加重了CIR小鼠的神经功能缺损及脑水肿程度。我们的实验还发现CIR后,促炎因子IL-6和TNF-α于梗死侧半球异常过度表达,推测肠道菌群失调加重了其异常表达。在多种细胞中,缺血、缺氧诱发了NF-κB的活化[13],活化的NF-κB诱导了细胞凋亡,加重了病情。菌群失调组中,NF-κB p65的表达明显增加,神经功能缺损评分升高,我们推测肠道菌群失调在一定程度上促进了NF-κB的活化。
ZO-1与BBB通透性的调节密切相关,其表达变化可作为衡量BBB损伤程度的标志,脑损伤后其表达明显下降,提示血BBB通透性增加[14]。为了解肠道菌群在CIR后对BBB的影响,我们观察了代表BBB功能的ZO-1的表达水平。实验中发现,与对照组相比较,菌群失调组中ZO-1的表达水平降低及脑水肿程度加重,由此,我们推测肠道菌群失调破坏了BBB的完整性。
综上所述,我们的研究发现,肠道菌群失调损害了BBB的完整性,在一定程度上加重了脑水肿程度和增加了脑梗死体积,促进了致炎性细胞因子的产生,增加了BBB的通透性,其机制可能是通过促进NF-κB的激活,对脑组织损伤起到了一定的促进作用。另外,患者脑梗死后,部分由于进食障碍、便秘、质子泵抑制剂的应用、抗生素的应用等因素造成肠道菌群失调,可能会加重脑梗死病情。提示我们在临床工作中,重视肠道菌群失调在脑梗死患者发病中的作用,为临床脑梗死治疗提供新的方向,纠正肠道菌群失调是治疗CIR后炎性反应的新靶点。
