加工番茄的花药培养技术
2018-11-12李淑红赖黎丽李淑琴方珂朱华国
李淑红,赖黎丽,李淑琴,方珂,朱华国*
(石河子大学农学院/绿洲生态农业新疆生产建设兵团重点实验室,新疆 石河子 832003)
加工番茄是普通番茄中的一种栽培类型,属于茄科番茄属,是我国乃至全世界重要的蔬菜作物。加工番茄的主要用途是送入加工厂加工处理,产品主要是番茄酱,另有番茄沙司、番茄汁、番茄丁等产品[1]。随着世界经济的快速发展,人们对食品的消费越来越倾向于加工制品,全世界对番茄制品的需求量以每年3%的速度增长,培育优良的加工番茄新品种,不仅可以提高产量,还可以提高原料的品质、耐贮运输。因此,国内外都十分重视加工番茄新品种的选育。
花药培养是植物育种中应用最广泛,最有成效的方法之一。通过对番茄花药培养可加速育种进程,提高选育效率[2]。有关番茄花药培养的研究,从20世纪70年代开始,番茄花药离体培养研究取得了一定进展,Sharp等[3]首次报道了番茄小孢子的胚胎发生,Gresshoff等[4]通过番茄花药培养诱导产生愈伤组织并分化出单倍体小植株,取得了番茄花药培养的首次成功,之后,国内外相继开展了一系列的相关研究,也获得了单倍体植株[5-6]。但番茄花药培养受基因型和植物激素影响较大,存在分化率低、再生完整植株难、基因型限制等问题。
本文以2个加工番茄品种的花药进行试验培养,通过设计不同植物激素组合对加工番茄进行花药培养,以期为加工番茄花药培养技术研究奠定一定的基础。
1 材料与方法
1.1 试验材料
供试的加工番茄材料有2种,分别为CK3和CK8,由新疆屯河投资股份有限公司提供。
1.2 试验方法
在番茄现蕾后,于盛花期上午 9:00-11:00,从健壮植株上摘取大小不同的花蕾,用电子游标卡尺测量花蕾的纵横径,然后将花蕾放入卡诺固定液固定后,剥出花药放在滴有醋酸洋红液的载玻片上,用镊子夹碎后去掉残渣,盖上盖玻片,进行染色,吸去周围多余的染色液,用体视显微镜观察小孢子所处的发育时期。
取单核期的花蕾置于4℃冰箱预处理,接种前用0.1%的升汞溶液消毒10 min,无菌水冲洗3或4次,剥出花药接种在以MSB培养基为基本培养基,附加 20 g/L 蔗糖,2.5 g/L Phytagel,pH 5.8 进行接种培养。
将2个基因型加工番茄的花药接种在诱导培养基上培养,诱导培养基如下:(0.1、0.5 mg/L)2,4-D+(0.1、0.5、1.0、2.0 mg/L)KT、(0.5、1.0、2.0、5.0 mg/L)6-BA、(0.1、0.5、1.0、2.0 mg/L)ZT、(0.05、0.1、0.2、0.5 mg/L)TDZ 和(0.5、1.0 mg/L)NAA+(0.1、0.5、1.0、2.0 mg/L)KT、(0.5、1.0、2.0、5.0mg/L)6-BA、(0.1、0.5、1.0、2.0mg/L)ZT、(0.05、0.1、0.2、0.5 mg/L)TDZ,考察 2 种材料愈伤组织的诱导率;2,4-D与不同细胞分裂素组合对CK8花药愈伤组织诱导率的影响;NAA与不同细胞分裂素组合对CK8花药愈伤组织诱导率的影响。将CK8的花药 4℃低温预处理 2、5 d,接种在 0.1 mg/L 2,4-D+2.0 mg/L 6-BA的培养基中,考察对CK8花药愈伤组织诱导率的影响。每皿接种30个左右花药,用Parafilm膜封口,所有处理均在接种后置于28℃暗培养30 d,然后转至散光下培养,培养温度为28℃;从培养开始30 d后统计出愈率,并将愈伤组织继代于0.5 mg/L NAA+0.5 mg/L KT的培养基中培养;30 d后再将愈伤组织转至分化培养基中培养,2种分化培养基激素处理为0.2 mg/L NAA+0.5 mg/L KT(1)和 0.2 mg/L IBA+0.5 mg/L KT(2)。
2 结果与分析
2.1 小孢子发育时期的测定
番茄小孢子的发育时期与其花蕾大小有密切关系,随着花蕾纵径和横径的增大,小孢由花粉母细胞时期向四分体、单核期发育(图1)。
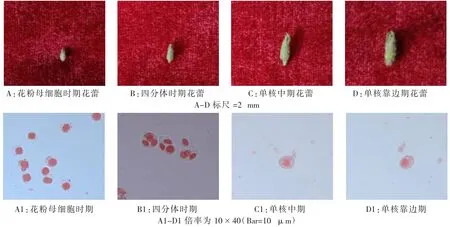
图1 CK8花蕾大小和小孢子的发育时期Fig.1 CK8 flower bud size and microspore developmental period
由表1可见:CK8品种小孢子处于花粉母细胞时期,花蕾的纵径在2.39-3.08 mm,横径在1.37-2.02 mm;小孢子处于四分体时期,花蕾的纵径在3.72-4.15 mm,横径在1.60-2.21 mm;发育到单核中期时,花蕾的纵径在4.49-5.26 mm,横径在2.13-2.34 mm;单核靠边期,纵径在5.25-6.19 mm,横径在2.09-3.20 mm。品种CK3小孢子处于花粉母细胞时期,花蕾纵径在2.44-2.96 mm,横径在1.48-1.63 mm;四分体时期时,花蕾纵径在3.32-4.08 mm,横径在1.92-2.19 mm;发育到单核中期时,花蕾纵径在3.99-5.29 mm,横径在2.04-2.33 mm;单核靠边期时,纵径在5.34-6.05 mm,横径在2.25-3.07 mm。
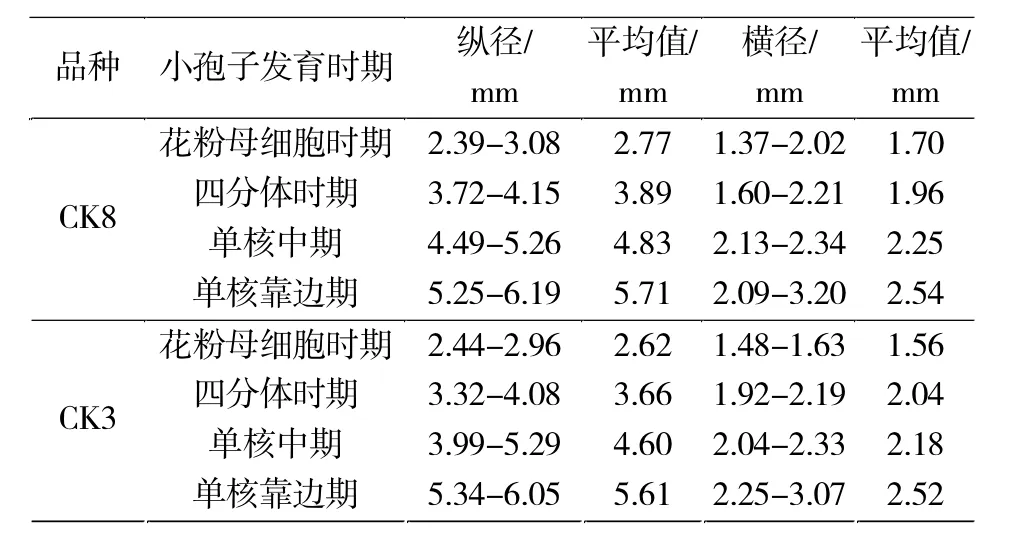
表1 番茄小孢子发育时期花蕾纵横径变化Tab.1 Relationship between tomato microspore genesis period buds and transverse diameters change
2.2 基因型对加工番茄花药愈伤组织诱导的影响
将2个不同基因型加工番茄的花药接种在愈伤组织诱导培养基上,30 d后统计出愈率,结果(表2)表明:2个加工番茄品种花药愈伤组织的诱导率均在10%以上,但是出愈率存在一定的差异,其中品种CK8的诱导率为18.63%,品种CK3的诱导率为14.19%。

表2 基因型对愈伤组织诱导的影响Tab.2 Effect of different genotype on callus induction
2.3 2,4-D与不同细胞分裂素组合对加工番茄花药愈伤组织诱导的影响
由表 3可知:0.1 mg/L、0.5 mg/L 2,4-D 分别与不同浓度的 KT、6-BA、ZT、TDZ组合对番茄花药愈伤组织的诱导率不同。随着KT、6-BA、ZT浓度的增大,番茄花药愈伤组织的诱导率均呈先上升后下降的趋势,而随着TDZ浓度的增大,番茄花药愈伤组织的诱导率呈下降趋势。
0.1 mg/L 2,4-D与不同浓度KT组合,当KT浓度为1.0 mg/L时,番茄花药愈伤组织的诱导率最大为 31.53%;0.1 mg/L 2,4-D与不同浓度 6-BA组合,在6-BA浓度为2.0 mg/L时,番茄花药愈伤组织的诱导率最大为56.36%;0.1 mg/L 2,4-D与不同浓度ZT组合,ZT浓度为0.5 mg/L时,番茄花药愈伤组织的诱导率最高为 38.64%;0.1 mg/L 2,4-D与不同浓度TDZ组合,当TDZ浓度为0.05 mg/L时,番茄花药愈伤组织的诱导率最高为56.32%,且0.1 mg/L TDZ的诱导率可达到48.94%。在0.1 mg/L 2,4-D与不同激素组合处理条件下,0.1 mg/L 2,4-D+2.0 mg/L 6-BA、0.1 mg/L 2,4-D+0.05 mg/L TDZ的诱导率均达到56%以上,明显高于其他组合。0.5 mg/L 2,4-D与不同浓度KT组合,KT浓度为1.0 mg/L时,愈伤组织诱导率最高为42.02%;0.5 mg/L 2,4-D与不同浓度6-BA组合,当6-BA浓度为1.0 mg/L时,花药愈伤组织的诱导率最高为35.35%;0.5 mg/L 2,4-D与不同浓度 ZT组合,在ZT浓度为0.5 mg/L时,愈伤组织诱导率最高为13.54%;0.5 mg/L 2,4-D与不同浓度 TDZ组合,在TDZ浓度为0.05 mg/L时,愈伤组织诱导率最高为56.52%,并且TDZ浓度为0.1 mg/L时,愈伤组织的诱导率可达52.27%。在0.5 mg/L 2,4-D与不同激素组合处理条件下,0.5mg/L2,4-D+0.05mg/L TDZ的诱导率最高为56.52%,其次是0.5 mg/L 2,4-D+0.1 mg/L TDZ的诱导率为52.27%,明显高于其他组合。
综上所述,0.5 mg/L 2,4-D+0.05 mg/L TDZ 是最适宜番茄花药愈伤组织诱导的激素组合,0.1 mg/L 2,4-D+2.0 mg/L 6-BA 与 0.1 mg/L 2,4-D+0.05 mg/L TDZ也是适宜番茄花药愈伤组织诱导的激素组合。
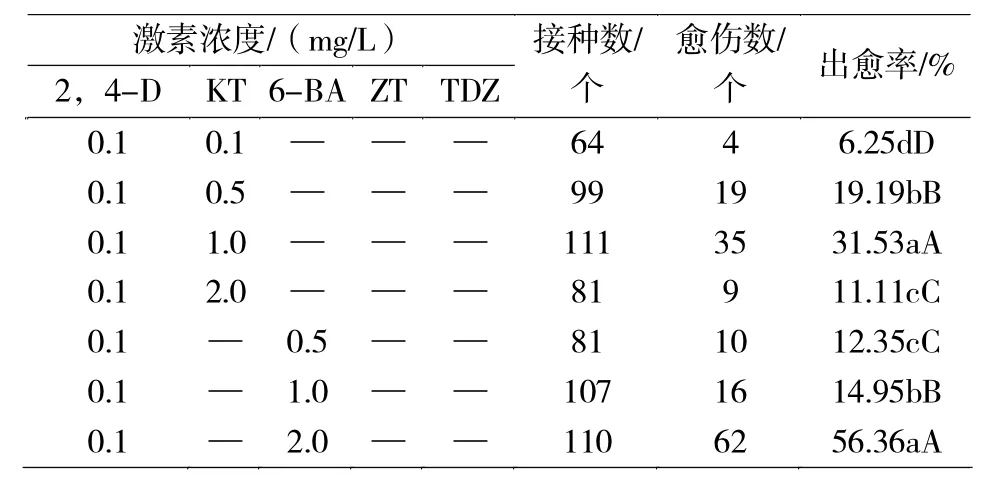
表3 2,4-D与不同细胞分裂素组合对番茄花药愈伤组织诱导的影响Tab.3 Effects of 2,4-D and different cytokinin combinations on the induction of tomato anther callus
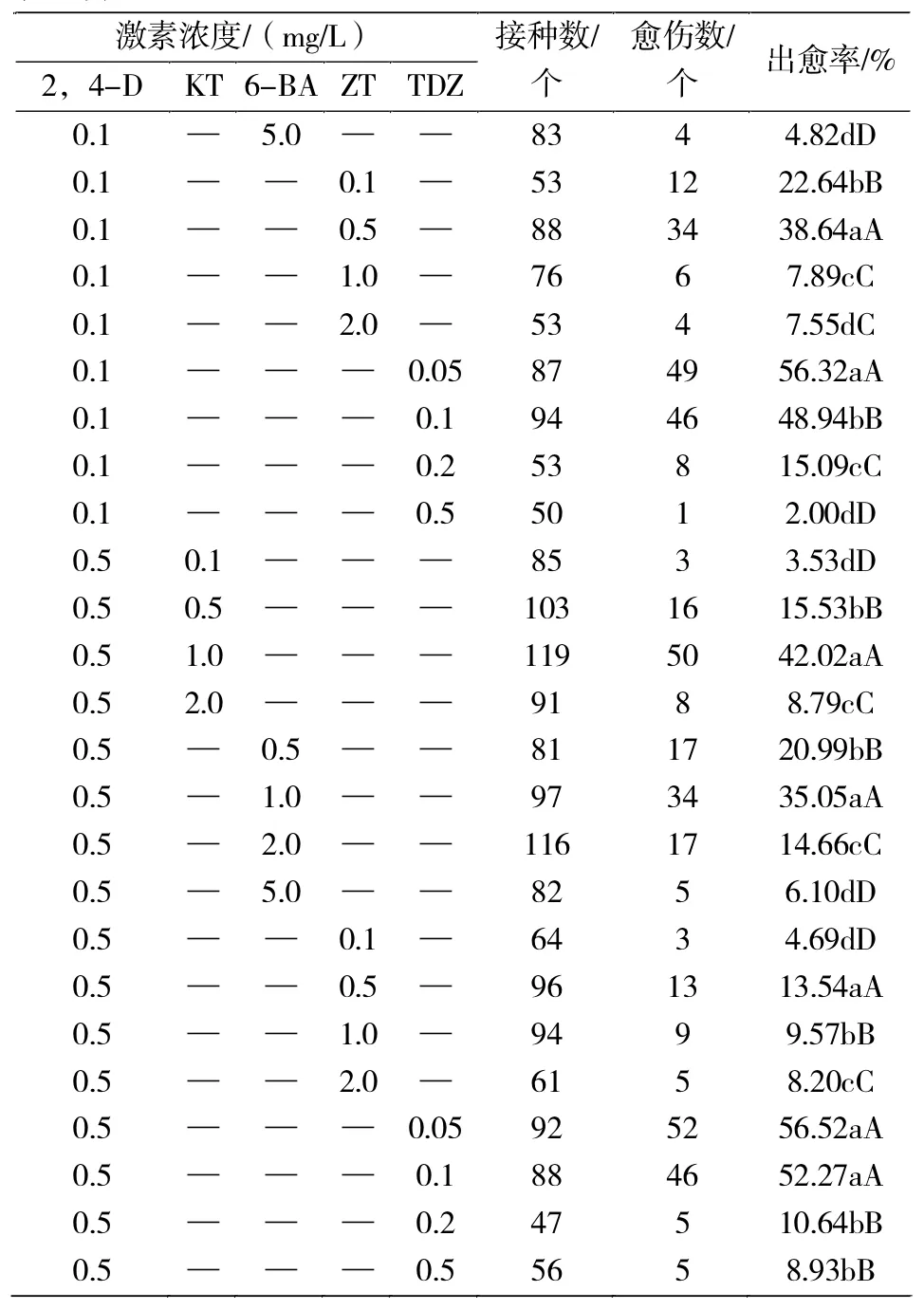
表3 续
2.4 NAA与不同细胞分裂素对加工番茄花药愈伤组织诱导的影响
由表4可知:0.5、1.0 mg/L的NAA分别与不同浓度的 KT、6-BA、ZT、TDZ组合对番茄花药愈伤组织的诱导率不同。随着KT、6-BA、ZT浓度的增大,番茄花药愈伤组织的诱导率均呈先上升后下降的趋势,而随着TDZ浓度的增大,番茄花药愈伤组织的诱导率呈下降趋势。
0.5 mg/L NAA与不同浓度KT组合,KT浓度为0.5 mg/L时,番茄花药愈伤组织诱导率最高为34.00%;0.5 mg/L NAA与不同浓度6-BA组合,当6-BA浓度1.0 mg/L时,番茄花药愈伤组织的诱导率最高为33.33%;0.5 mg/L NAA与不同浓度ZT组合,在ZT浓度为1.0 mg/L时,番茄花药愈伤组织的诱导率最大为20.65%;0.5 mg/L NAA与不同浓度TDZ组合,TDZ浓度为0.05 mg/L时,番茄花药愈伤组织的诱导率最高为14.04%。在0.5 mg/L NAA与不同激素组合处理条件下,0.5 mg/L NAA+0.5 mg/L KT对番茄花药愈伤组织的诱导率最高为34.00%,其次是0.5 mg/L NAA+1.0 mg/L 6-BA对番茄花药的诱导率为33.33%,诱导率明显高于其他组合。
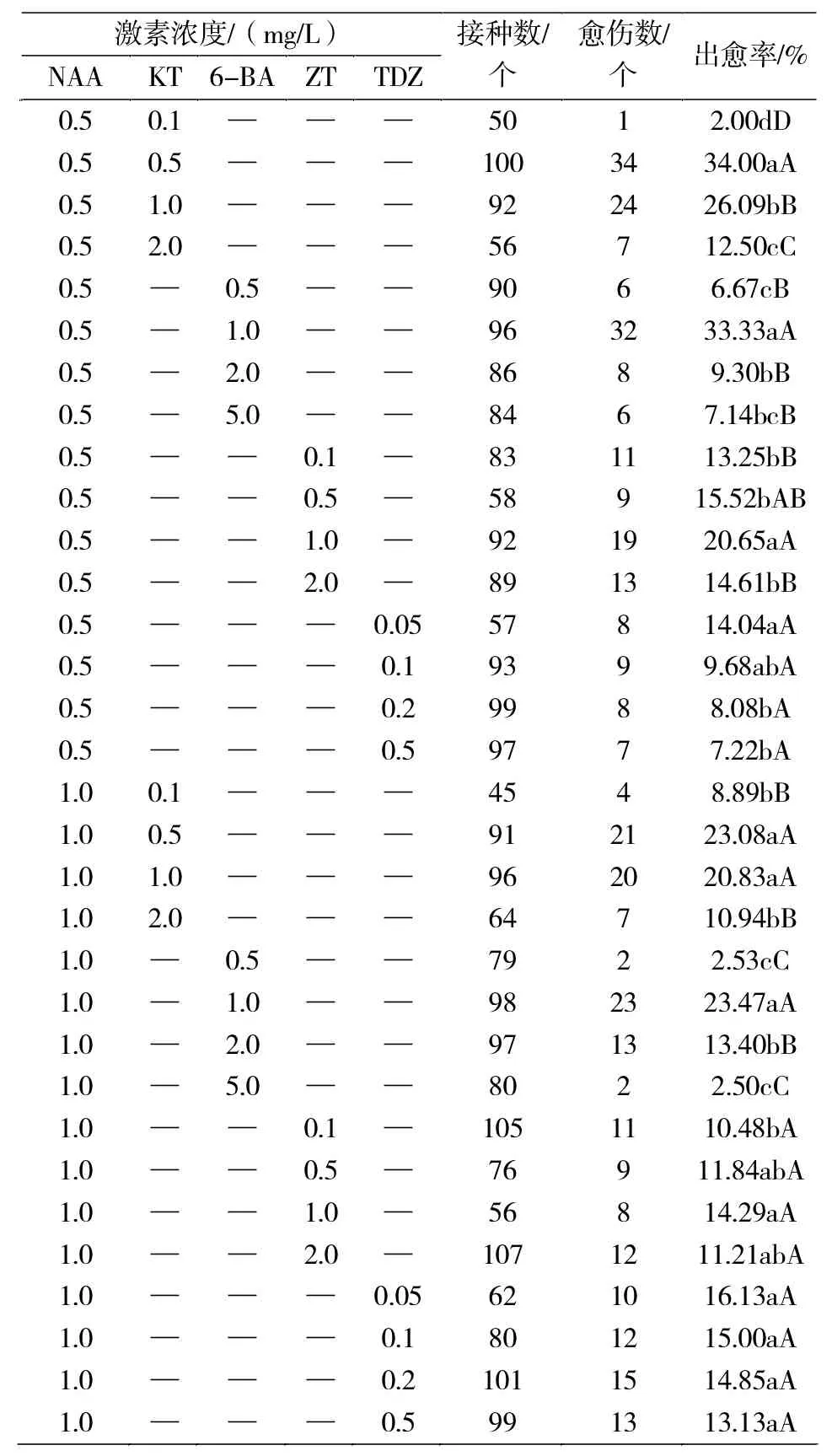
表4 NAA与不同细胞分裂素组合对番茄花药愈伤组织诱导的影响Tab.4 Effect of NAA and different cytokinin combinations on the induction of tomato anther callus
1.0 mg/L NAA与不同浓度KT组合,当KT浓度为0.5 mg/L时,番茄花药愈伤组织的诱导率最高为23.08%;1.0 mg/L NAA与不同浓度6-BA组合,6-BA浓度为1.0 mg/L时,番茄花药愈伤组织的诱导率最高为23.47%;1.0 mg/L NAA与不同浓度ZT组合,ZT浓度为1.0 mg/L时,番茄花药愈伤组织的诱导率最大为14.29%;1.0 mg/L NAA与不同浓度TDZ组合,当TDZ浓度为0.05 mg/L时,番茄花药愈伤组织的诱导率最高为16.13%。在1.0 mg/L NAA与不同激素组合处理条件下,1.0 mg/L NAA+1.0 mg/L 6-BA对番茄花药愈伤组织的诱导率最高为23.47%,其次是1.0 mg/L NAA+0.5 mg/L KT对番茄花药愈伤组织的诱导率为23.08%,对愈伤组织的诱导率明显高于其他组合。
综上所述,0.5 mg/L NAA+0.5 mg/L KT是最适宜诱导番茄花药愈伤组织的激素组合,0.5 mg/L NAA+1.0 mg/L 6-BA也是适宜番茄花药愈伤组织诱导的激素组合。
2.5 低温预处理对加工番茄花药愈伤组织诱导的影响
低温预处理对加工番茄花药愈伤组织诱导的影响结果见表5。
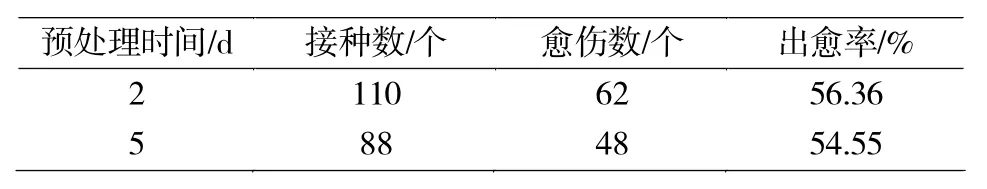
表5 低温预处理对愈伤组织诱导的影响Tab.5 Effect of cold pretreatment on the callus induction
由表5可知:加工番茄的花药经4℃低温预处理2 d、5 d后的愈伤组织诱导率没有明显的差异,说明4℃低温预处理花蕾的适宜时间为2-5 d。
2.6 番茄花药愈伤组织分化诱导
将花药接种于诱导培养基置于28℃恒温箱中黑暗培养,30 d后统计愈伤组织(图2A),并将愈伤组织继代至MSB+0.5 mg/L NAA+0.5 mg/L KT的培养基上培养,愈伤组织的生长出现了3种类型。一是愈伤组织呈黄绿色,质地松软(图2B);二是愈伤组织呈白色,质地致密坚硬(图2C);三是愈伤组织呈白色,质地松软(图2D)。再将愈伤组织继代至分化培养基,其中品种CK3的花药经诱导培养基MSB+0.5 mg/L NAA+0.05 mg/L TDZ和继代培养基MSB+0.5 mg/L NAA+0.5 mg/L KT培养后,在分化培养基1中有胚性愈伤组织形成(图2E),而接种在分化培养基2中的愈伤组织均无胚性愈伤组织形成(图2F)。MSB+0.2 mg/L NAA+0.5 mg/LKT是适宜诱导番茄花药愈伤组织分化的培养基。
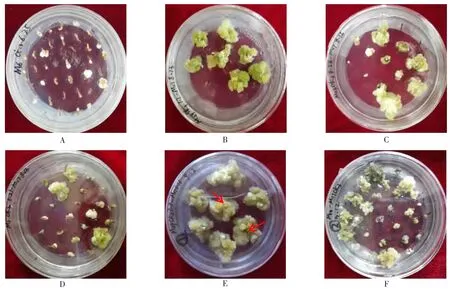
图2 番茄花药愈伤组织的生长状态Fig.2 Tomato anther callus growth status
3 讨论
3.1 小孢子发育时期的测定
选择最适宜发育时期的小孢子对花药培养至关重要,番茄小孢子发育时期处于单核靠边期或单核中晚期时,花药愈伤组织的诱导率最高[7-8]。
(1)本文试验观察到小孢子发育经历小孢子母细胞时期、四分体时期、单核中期、单核靠边期。小孢子各个发育时期明显,并且小孢子各个发育时期与花蕾的大小密切相关,可根据花蕾的大小来判断番茄小孢子的发育时期。
(2)本文试验通过对2个加工番茄品种CK8、CK3进行比较观察,得出番茄花蕾纵径为5.25-6.19 mm,横径为2.09-3.20 mm,绝大多数的小孢子发育时期处于单核靠边期。
(3)依据上述试验的结果进行花药培养,可以根据花蕾的大小来判断小孢子的发育时期。
3.2 基因型对番茄花药愈伤组织诱导的影响
基因型是影响花药培养成功与否的关键因素之一,不同基因型的植株花药愈伤组织诱导率不同[9-10]。本试验研究表明,2个基因型的加工番茄均通过花药离体培养获得了愈伤组织,并且2个基因型材料的花药愈伤组织诱导率不同,说明基因型对花药愈伤组织诱导率影响有差异,对花药愈伤组织的发生有决定作用,这与前人的研究结果[11-13]一致。
3.3 不同激素组合及浓度对加工番茄花药愈伤组织诱导的影响
(1)有关研究表明培养基中的激素配比及其浓度是影响番茄花药培养的重要因素[14-16]。
本文试验结果表明,不同激素组合对加工番茄花药愈伤组织的诱导率有显著的差异。2,4-D和NAA分别与不同浓度的KT、6-BA、ZT、TDZ组合,其中以2,4-D与0.05 mg/L TDZ组合对番茄花药愈伤组织的诱导率最高,说明2,4-D和TDZ激素组合对番茄花药愈伤组织诱导有显著的调控作用,在选择适宜的激素配组时,可优先考虑2,4-D与TDZ配组,这与前人的研究结果[17-18]不一致。
(2)花药愈伤组织分化率低是阻碍番茄花药培养获得单倍体植株的重要因素之一,在诱导番茄花药愈伤组织分化的过程中,植物激素起着重要作用。
本文试验设计的2种分化培养基,只有在MSB+0.2 mg/L NAA+0.5 mg/L KT的培养基上形成胚性愈伤组织,这为番茄花药愈伤组织的分化提供一定的依据。
3.4 低温预处理对加工番茄花药愈伤组织诱导的影响
对番茄的花药培养来说,低温冷处理可以提高番茄花药愈伤组织的诱导率,其原因是低温预处理可在一定程度上延缓番茄花药小孢子退化,提高雄核发育,并增加参与雄核发育小孢子的比率[19]。张永华[20]在番茄花药培养中,将花药在4℃低温下预处理1、2、4、7 d,最高愈伤组织的诱导率比对照增加66.01%,是对照的 5.65倍,相对出愈率较低的处理也比对照的出愈率高。
本文试验中对花药采用4℃低温预处理2、5 d,结果表明各处理愈伤组织的形成没有明显的差异,说明4℃低温处理花蕾的最适时期为2-5 d,这与前人的研究结果[21-22]一致。
4 结论
(1)2种加工番茄 CK8和 CK3的花蕾纵径为5.25-6.19 mm,横径为 2.09-3.20 mm,绝大多数的小孢子发育时期处于单核靠边期。
(2)0.5 mg/L 2,4-D 与 0.05 mg/L TDZ配组使用的诱导率最高,为56.52%。
(3)品种CK3的花药经诱导培养基MSB+0.5 mg/L NAA+0.05 mg/L TDZ和继代MSB+0.5 mg/L NAA+0.5 mg/L KT培养后,在分化培养基MSB+0.2 mg/L NAA+0.5 mg/L KT上,诱导出了胚性愈伤组织。
(4)4℃低温预处理花蕾的适宜时间是2-5 d。
