辛伐他汀对糖尿病大鼠肾脏的保护作用及其可能机制*
2018-11-12李凡璐吴亚俐陈还珍崔香丽
宛 欣, 王 茜, 李凡璐, 吴亚俐, 刘 鑫, 陈还珍, 杨 静, 崔香丽△
(1. 山西医科大学基础医学院生理系, 2. 山西医科大学第一医院心血管内科, 3. 山西医科大学第一医院内分泌科, 太原 030001)
糖尿病 (diabetes mellitus, DM) 是由于胰岛素分泌不足和/或作用缺陷引起的以高血糖为主的代谢性疾病,也是导致终末期肾病 (end stage renal disease, ESRD) 的常见原因。研究发现,内质网应激(endoplasmic reticulum stress, ERS)在糖尿病肾脏损伤的病理生理过程中起着重要作用。高浓度葡萄糖、炎症、缺氧、氧化应激可以诱导内质网应激和肾脏细胞凋亡,随后导致肾脏损伤[1]。炎症反应与内质网应激联系密切,共同促进糖尿病肾脏损伤的进程。
辛伐他汀(simvastatin)为3-羟甲基戊二酸单酰辅酶A (3-hydroxy-3-methyl glutarylcoenzyme A, HMG-CoA)还原酶的抑制剂,在临床上用于降低总胆固醇(total cholesterol, TC)的合成和低密度脂蛋白(low density lipoprotein, LDL)的水平,此外还具有抗炎、抗氧化和保护血管内皮的作用[2-3],现已作为治疗动脉粥样硬化的常规药物。在治疗心血管疾病的过程中发现,辛伐他汀对糖尿病低血糖引起的心肌损伤有一定的保护作用,这种作用与抑制氧化应激和炎症反应有关[4]。本课题前期的实验已经证明,辛伐他汀对糖尿病引起的心脏功能损伤的保护作用与NF-κB信号通路有关[5]。本研究拟通过建立糖尿病大鼠模型,观察辛伐他汀对糖尿病大鼠的肾脏损伤有无保护作用,并检测内质网相关蛋白葡萄糖调节蛋白78 (glucose regulated protein 78, GRP78)、磷酸化肌醇需求激酶1α (phosphorylated inositol-requiring enzyme 1α, p-IRE1α),炎症核心蛋白核因子-Kappa B p65 (nuclear factor-kappa B p65, NF-κB p65),以及炎症因子单核细胞趋化蛋白-1 (monocyte chemoattractant protein-1, MCP-1)的表达水平,以探讨辛伐他汀保护糖尿病肾脏的可能分子机制。
1 材料与方法
1.1 动物与试剂
SPF级雄性Sprague-Dawley (SD) 大鼠,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2012-0004。链脲佐菌素(streptozotocin, STZ, Sigma),辛伐他汀(杭州默沙东制药公司),无醇苏木素染液(Jiancheng Biotech),伊红染液(Jiancheng Biotech),GRP78兔多克隆抗体(Abcam),p-IRE1α兔多克隆抗体(Abcam),NF-κB p65兔单克隆抗体 (Cell Signaling),MCP-1兔多克隆抗体 (Abcam),β-actin鼠单克隆抗体 (Proteintech),HRP标记羊抗兔IgG (Transgen-Biotech),羊抗小鼠IgG(Cell Signaling),免疫组化试剂盒SABC即用型(武汉博士德),天青石蓝B(Solarbio),天狼星红染液(Solarbio),TUNEL细胞凋亡检测试剂盒(凯基生物)。
1.2 动物模型制备
24只SD大鼠随机分为正常对照(NC,n=8)组和糖尿病造模(n=16)组。糖尿病造模组大鼠采用55 mg/kg STZ(溶于0.1 mol/L柠檬酸缓冲液,pH4.5)单次腹腔注射,建立糖尿病大鼠模型;NC组大鼠腹腔注射相同剂量的柠檬酸缓冲液。72 h后从大鼠尾静脉采血测血糖,连续三天,随机血糖≥16.7 mmol/L(300 mg/dl)即表示糖尿病造模成功。糖尿病造模组大鼠随机分为糖尿病(DM)组和糖尿病+辛伐他汀(DM+Sim)组。DM+Sim组给予辛伐他汀生理盐水混悬液40 mg/kg灌胃,1次/日,连续4周;其余两组给予等体积生理盐水灌胃,1次/日,连续4周。4周后杀死大鼠,快速取出双侧肾脏,使用(4~6)℃生理盐水冲洗,部分肾组织置于10%福尔马林液中固定,其余肾组织立即置-80℃超低温冰箱中保存待用。
1.3 HE染色
肾组织石蜡包埋后切5 μm片,依次将切片置于苏木素和伊红染液中染色,氨水返蓝,脱水透明,中性树胶封片。光镜下观察各组大鼠肾脏组织形态学改变。
1.4 天狼星红染色
肾组织石蜡包埋后切5 μm片,依次将切片置入天青石蓝染液和苦味酸天狼星红染液中染色,盐酸酒精分化。脱水透明,中性树胶封片。每张片子随机取5个视野拍照,依据image Pro plus软件分析统计红色胶原区域面积的比值。
1.5 Western blot检测GRP78、p-IRE1α和NF-κB p65的表达
取肾皮质组织约50 mg,用RIPA裂解缓冲液裂解蛋白,BCA法测定蛋白质总浓度。取含总蛋白50 μg的肾皮质组织匀浆液10 μl,SDS-PAGE后半干转移至PVDF膜上;5%脱脂奶粉(0.25 g脱脂奶粉+ 5 ml TBST)封闭1.5 h,洗膜后分别加入羊抗兔GRP78多克隆抗体(1∶1 000)、羊抗兔p-IRE1α多克隆抗体(1∶1 000),羊抗兔NF-κB p65单克隆抗体(1∶1 000)、羊抗小鼠β-actin单克隆抗体(1∶1 000),4℃过夜后加入HRP标记羊抗兔IgG(1∶2 000)或羊抗小鼠IgG(1∶ 2 000),37℃孵育1.5 h;ECL显色,Bio-Rad Image Lab凝胶成像系统显影,并对Western blot条带进行定量分析,确定杂交条带的吸光度值。
1.6 免疫组织化学
肾脏组织石蜡包埋后切5 μm片,常规脱蜡至水,枸橼酸钠热修复抗原,3%H2O2约50 μl消除内源性过氧化物酶。5%BSA封闭。一抗为羊抗兔NF-κB p65单克隆抗体(1∶800)和羊抗兔MCP-1多克隆抗体(1∶100),二抗为生物素标记的羊抗兔IgG,以PBS替代一抗作为阴性对照,DAB显微镜下控制显色,苏木素复染。按着色范围和着色强度计数结果的乘积作为评分结果[6]。
1.7 原位末端转移酶 (TUNEL)法检测肾脏细胞凋亡
肾脏组织石蜡切5 μm片,常规脱蜡至水,ProteinaseK工作液37℃消化,3%H2O2约50 μl消除内源性过氧化物酶,TDT酶反应液避光孵育,Streptavidin-HRP工作液避光反应,DAB显色,苏木素复染。凋亡细胞核呈棕褐色颗粒,每张切片随机选取5个高倍视野(×400),计算该视野中阳性细胞所占的百分比。光镜下观察并计数凋亡细胞,肾脏细胞凋亡指数 (apoptosis index, AI) =视野中肾脏阳性细胞数/视野中肾脏细胞总数。
1.8 统计学处理
2 结果
2.1 大鼠肾脏组织病理学变化
HE染色切片置100倍光学显微镜下观察,与NC组比较,DM组可见大量的肾小球硬化,部分肾小球变形、萎缩,结构不清,肾小管间质可见明显的炎细胞浸润以及纤维化;置400倍光学显微镜下观察,可见DM组肾小球明显硬化、固缩,血管腔和肾小球囊腔明显狭窄,甚至闭塞,系膜细胞和系膜基质明显增多,说明DM组大鼠肾脏组织明显损伤,糖尿病肾病造模成功;而DM+Sim组肾组织结构较DM组明显改善,NC组大鼠肾脏无明显病理学改变(图1,见彩图页Ⅰ)。
2.2 天狼星红染色观察肾脏组织间质纤维化
在普通显微镜下,NC组肾小球以及肾小管红色的胶原纤维呈均匀分布,着色浅;DM组大鼠肾小球以及肾小管胶原纤维红染明显广泛,着色深,缠绕混乱,呈不均匀分布(P<0.01);与DM组比较,DM+Sim组较红染明显减轻(P<0.01),说明糖尿病大鼠肾脏发生了明显的炎症纤维化,辛伐他汀能减轻糖尿病肾脏的间质纤维化(图2,见彩图页Ⅰ)。
2.3 Western blot检测GRP78、 p-IRE1α以及NF-κB p65蛋白质的表达
与NC组相比,DM组大鼠肾脏的GRP78、p-IRE1α以及NF-κB p65蛋白质表达均显著升高 (P<0.05)。而给予辛伐他汀后,大鼠GRP78、p-IRE1α以及NF-κB p65蛋白质表达均比DM组降低(P<0.05,图3)。提示辛伐他汀对糖尿病肾脏的保护作用可能与降低GRP78、p-IRE1α和NF-κB p65的表达有关。

Fig.3Expression of GRP78, p-IRE1α and NF-κB p65 in rat kidneys

**P<0.01vsNC group;#P<0.05vsDM group
2.4 免疫组织化学法检测肾脏中NF-κB p65、MCP-1蛋白质的表达
NC组大鼠肾小球以及肾小管间质有极少量NF-κB p65表达;DM组大鼠肾小球内皮细胞、系膜细胞以及肾小管上皮细胞核明显呈棕黄色,即NF-κB p65呈强阳性表达(P<0.01);糖尿病大鼠给予辛伐他汀后,较DM组细胞核棕黄色染色明显减少(P<0.05)。MCP-1表达于细胞质中,NC组肾小球系膜区和肾小管间质MCP-1表达极少,而DM组大鼠肾小球系膜区和肾小管间质着色广泛、浓集,内皮细胞、系膜细胞,尤以肾小管上皮细胞MCP-1表达呈强阳性(P<0.01);糖尿病大鼠给予辛伐他汀后,MCP-1表达明显下降,其着色部位与糖尿病组大鼠大致相同,但着色程度低于DM组(P<0.01,图4)。

Fig.4NF-κB p65 and MCP-1 expression in rat kidney detected by immunohistochemistry

**P<0.01vsNC group;#P<0.05,##P<0.01vsDM group
2.5 TUNEL法定位检测肾组织细胞凋亡
肾脏细胞凋亡的原位检测结果显示,正常细胞核呈蓝紫色;凋亡的细胞核呈棕褐色颗粒样,部分凋亡的细胞核固缩变形,体积偏小。NC组仅见少量凋亡的细胞核,而DM组肾小球内及肾小管见有大量颗粒样的的凋亡细胞核,明显高于对照组(P<0.01);给予辛伐他汀后,大鼠肾脏凋亡细胞核较DM组明显减少(P<0.01,图5)。
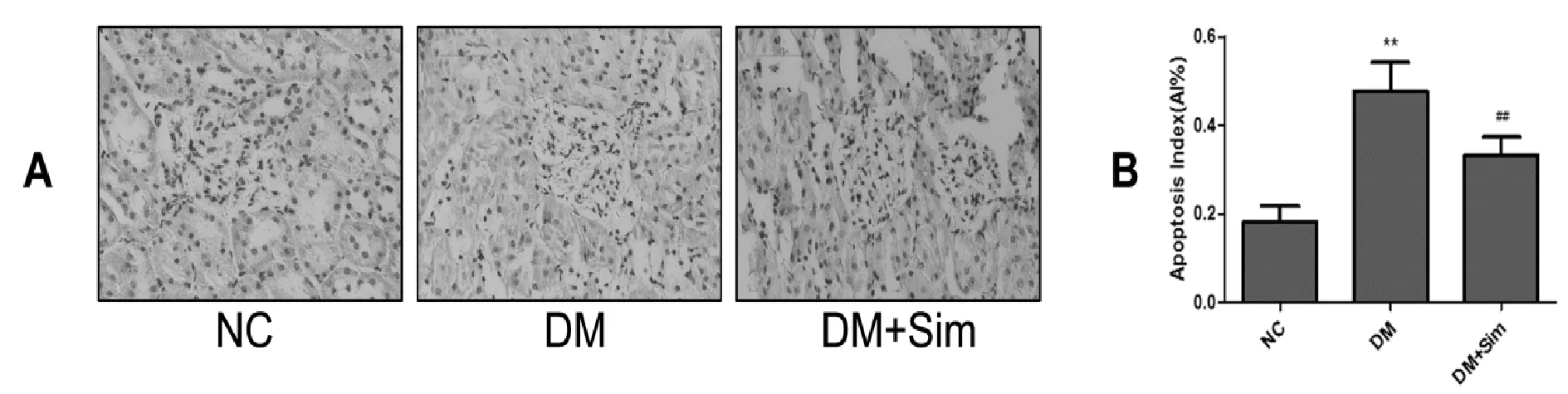
Fig.5TUNELresults of apoptosis in glomerular and renal tubular cell in rats

**P<0.01vsNC group;##P<0.01vsDM group
3 讨论
糖尿病所致肾脏损伤是糖尿病微血管病变的主要并发症之一。本实验采用链脲佐菌素制造糖尿病大鼠模型观察糖尿病造成的肾损伤,HE染色结果发现糖尿病大鼠肾小球明显萎缩、变形,系膜细胞明显增多;同时天狼星红染色也观察到糖尿病大鼠肾小球及肾小管胶原纤维明显红染,缠绕混乱呈结节状。高血糖可促进肾小球高灌注和高滤过,刺激钠葡萄糖转运蛋白-2(SGLT-2)的表达,钠和葡萄糖的重吸收增加激活了肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem, RAAS)以及促进上皮-间质转化(epithelial-mesenchymal transition, EMT),过多的成纤维细胞渗入间质,导致间质纤维化[7]。此外高糖环境还可损伤肾脏固有细胞,细胞损伤后诱导单核/巨噬细胞和淋巴细胞的进行性间质内流,同时激活成纤维细胞分泌胶原纤维,积累在损伤部位,导致炎症纤维化的产生[8]。本研究结果显示,糖尿病大鼠给予辛伐他汀治疗后,病理学形态改善明显,同时胶原纤维明显减少,证实辛伐他汀能够保护糖尿病大鼠肾脏、减轻纤维化。
炎症核心因子NF-κB p65和MCP-1在糖尿病大鼠肾脏组织中呈高表达,给予辛伐他汀后这些炎症因子表达均降低。已有动物实验表明,大鼠肾小球MCP-1等表达增加会导致炎症的产生[9]和肾小球硬化[10]。Saitoh等[11]发现,糖尿病肾病患者尿液中MCP-1水平升高,且与肾脏损伤的严重程度呈正相关。而在糖尿病肾小管上皮细胞中,NF-κB的活性与MCP-1的表达高度相关,NF-κB的活化可以诱导单核巨噬细胞聚集,并通过激活MCP-1促进肾小管间质纤维化[12]。本结果也说明,炎症反应参与了糖尿病大鼠肾脏损伤的发生发展,辛伐他汀能通过抑制糖尿病大鼠肾脏炎症反应改善肾脏功能。
炎性因子以及高糖环境可以诱导ERS,使蛋白质折叠受阻,启动未折叠蛋白反应(unfolded protein response, UPR)[1]。原本与GRP78蛋白质结合并处于失活状态的IRE1α与GRP78解离,并磷酸化生成p-IRE1α而被激活。过强或过长时间的ERS最终导致细胞发生炎症反应及凋亡[13]。在内质网应激的未折叠蛋白反应(UPR)中,p-IRE1α进一步激活IKK成为p-IKK,促进IκB磷酸化后与NF-κB解离,游离的NF-κB亚基p65迅速进入细胞核,与特异性κB序列结合,诱导炎症相关基因的转录,促进炎症反应的发生[14]。NF-κB的核移位可促进MCP-1以及细胞外基质(extracellular matrix, ECM)的表达,导致肾小球和肾小管间质炎细胞浸润[15]。ERS中的UPR可以启动炎症反应,而炎性因子又可诱导内质网应激,产生一系列的炎症反应,如此循环加剧组织损伤。本研究显示,糖尿病大鼠肾脏组织GRP78和p-IRE1α表达均升高;辛伐他汀可抑制肾GRP78和p-IRE1α表达,表明糖尿病大鼠肾脏组织也发生了内质网应激。辛伐他汀可以有效抑制内质网应激,并通过抑制IRE1α磷酸化降低了炎症核心蛋白NF-κB的核移位,有效抑制了肾脏组织MCP-1表达,减轻了肾脏组织炎症和纤维化,从而改善了肾脏功能。
本研究还观察到,糖尿病大鼠肾小球和肾小管中存在大量凋亡的细胞核。而给予辛伐他汀治疗后,凋亡的细胞核明显减少,与Ishii等[16]在糖尿病大鼠肾组织中发现大量凋亡的近端小管细胞的结果相似。在高糖环境下,过长的内质网应激可导致GRP78--procaspase-12--procaspase-7复合物裂解,释放有活性的caspase-12,介导肾脏固有细胞凋亡[17];此外,炎症反应还可通过线粒体电子传递链产生超氧化物,阻碍电子传递复合物Ⅲ,扰乱促凋亡和抗凋亡蛋白质的稳定,激活线粒体依赖凋亡途径[18]。辛伐他汀可通过抑制细胞凋亡来保护肾脏,但具体通过哪条凋亡途径发挥作用,有待进一步研究。
综上所述,糖尿病可造成大鼠肾脏损伤,发生肾小球萎缩和肾纤维化,导致炎性因子p-IRE1α和NF-κB表达升高、内质网应激和肾细胞凋亡,内质网应激和炎症反应又加剧糖尿病肾脏的损伤。辛伐他汀通过有效抑制炎症反应和内质网应激,减少肾脏细胞凋亡来缓解糖尿病所致的肾脏损伤,既可以降低由糖代谢异常引起的脂质代谢紊乱,又可有效预防和治疗糖尿病肾损伤,延缓病程。本实验为糖尿病肾脏疾病的治疗以及他汀类新药的开发利用提供了理论基础和实验依据。
