外源性H2S恢复缺氧后适应对衰老H9C2细胞的保护作用及机制*
2018-11-12孙伟铭张源洲席雨鑫王跃虹徐长庆李鸿珠
孙伟铭, 张源洲, 温 馨, 席雨鑫, 袁 迪, 王跃虹, 魏 璨, 徐长庆, 李鸿珠
(哈尔滨医科大学基础医学院病理生理学教研室, 黑龙江 哈尔滨 150086)
近来研究证实,硫化氢 (hydrogen sulfide, H2S) 已被认为是继一氧化氮 (nitric oxide, NO) 和一氧化碳 (carbon monoxide, CO) 后新发现的第三个气体信号分子[1]。H2S代谢和功能异常与多种心血管疾病有关,主要包括缺血/再灌注 (ischemia/reperfusion, I/R) 损伤、动脉粥样硬化、高血压、心力衰竭、心肌梗死等[1-4]。I/R可引起心肌细胞损伤,进而增加氧化应激和诱导细胞凋亡,缺血后适应 (ischemic post-conditioning, PC) 能够减轻I/R损伤,但在衰老心肌细胞PC却丧失了这种保护作用[4-5]。恢复PC对衰老心肌细胞保护作用的研究已成为当今研究的热点。
本课题组前期研究发现,外源性H2S能恢复PC对老龄大鼠心肌细胞的保护作用[6],但其机制不详。本研究以衰老的心肌细胞H9C2为研究对象,在缺氧/复氧 (hypoxia/reoxygenation, H/R) 和PC细胞模型上给予NaHS (外源性H2S的供体),观察外源性H2S恢复PC对衰老心肌细胞H9C2的保护作用及其可能机制。
1 材料与方法
1.1 主要试剂
硫氢化钠 (NaHS, Sigma),大鼠晚期糖基化终末产物 (AGEs) ELISA检测试剂盒、caspase-3活性检测试剂盒、活性氧ROS检测试剂盒、CCK-8细胞活力检测试剂盒、Hoechest 33342凋亡检测试剂盒 (碧云天公司),其他试剂均为分析纯。
1.2 主要仪器
高速低温离心机 (Beckman),酶标仪 (DG3022A),倒置相差显微镜和荧光显微镜(Olympus),培养箱MCO-17AICO2 (Sanyo),Real-time PCR仪 (Thermo fisher),S-1300-U净化工作台等。
1.3 H9C2细胞衰老模型的建立
1.3.1 H9C2细胞的培养 大鼠心肌细胞株H9C2购自武汉博士德生物工程有限公司。细胞培养于含10%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的DMEM高糖培养基中,置于37℃ 5% CO2培养箱中常规培养,2~3 d换液一次,待细胞长到85%~90%时传代。
1.3.2 H9C2细胞衰老模型的建立 弃去原有的培养液,加入含不同浓度 (0、5、10、30、50、80、100 μmol/L) H2O2的培养液孵育2 h后,换正常培养液再孵育3 d。通过检测AGEs含量和caspase-3活性,确定细胞衰老程度。本研究选择30 μmol/L的H2O2作为诱导细胞衰老的浓度,并选择第4代H9C2细胞诱导其衰老。
1.3.3 衰老心肌细胞H9C2的H/R和PC模型的建立 H/R模型:衰老的H9C2细胞在缺氧培养液中孵育3 h (缺氧培养液为无血清、无糖培养基,pH=6.8;置于缺氧罐中,通入95% N2,5% CO2) ,复氧6 h处理;PC模型:方法同H/R组,区别在于缺氧结束复氧前连续进行3次间隔5 min的复氧/再缺氧处理,随后复氧6 h。
1.3.4 分组 衰老心肌细胞H9C2随机分为5组,每组8个样本 (n=8):(1)对照组 (control);衰老心肌细胞H9C2在正常培养液中孵育9 h;(2)H/R组:衰老心肌细胞H9C2在缺氧培养液中孵育3 h然后正常培养6 h;(3)H/R +NaHS组:方法同组(2),仅在复氧6 h过程中加入100 μmol/L NaHS;(4)PC组:方法同组(2),缺氧结束复氧前连续进行3次间隔5 min的复氧/再缺氧处理,随后复氧6 h;(5)PC + NaHS组:方法同(4),仅在PC和缺氧6 h过程中加入100 μmol/L NaHS。根据查阅文献和预实验中不同浓度 NaHS对细胞活力的影响,选择本研究中NaHS的工作浓度。
1.4 大鼠晚期糖基化终末产物(AGEs)含量的检测
采用ELISA试剂盒检测AGEs含量,检测方法按照说明书进行:取细胞上清液,1 000 g、4℃离心10 min,去除颗粒和聚合物,在96孔板中,各孔分别加入稀释后的标准品50 μl、待测样品50 μl。立即加入50 μl生物素标记的抗体。盖上96孔板,轻轻振荡混匀,37℃温育1 h。甩去孔内液体,各孔加满洗涤液,振荡30 s,甩去洗涤液,在吸水纸上拍干。重复此操作3 次。每孔加入80 μl亲和链酶素-HRP,轻轻振荡混匀,37℃温育30 min。甩去孔内液体,各孔加满洗涤液,振荡30 s,甩去洗涤液,在吸水纸上拍干。重复此操作3次。各孔加入底物A、B各50 μl,轻轻振荡混匀,37℃温育15 min,避免光照。取出酶标板,各孔迅速加入50 μl终止液后立即在450 nm波长处测定各孔的吸光度(A)值。绘制AGEs标准曲线,计算AGEs值。
1.5 Caspase-3活性测定
采用ELISA试剂盒检测caspase-3活性,检测方法按照说明书进行:每个样品至少1×106个细胞并溶解在50 μl裂解缓冲液中,重悬沉淀,冰浴15 min,16 000×g、4℃离心10 min,取上清液转移至预冷的离心管中,设置反应体系时先加入40 μl检测缓冲液,再加入50 μl上清液,适当混匀,随后再加入2 mmol/L Ac-DEVD-pNA 10 μl混匀,37℃孵育1~2 h,观察颜色变化比较明显时即可测定A405nm。
1.6 细胞活力测定
使用CCK-8试剂盒测定细胞活力。每孔接种3×103个细胞于96孔板中。在处理24 h后,各孔立即添加10 μl CCK-8,37℃孵育2 h。使用微孔板分光光度计,在570 nm处读板,以确定它们的吸光度。
1.7 细胞凋亡率检测
采用Hoechst 33342染色液检测细胞凋亡率。细胞按照5×104cells/ml接种于培养皿中,经过相应处理后,弃去旧培养液并用PBS洗涤细胞,然后在含5 μg/ml Hoechst 33242的培养液中正常培养10 min,弃去染色液并用PBS洗涤2~3次,每次3~5 min,然后直接在400×荧光显微镜下观察并拍照。
1.8 细胞内ROS水平的检测
DCFH-DA是一种本身无荧光,可以自由穿透细胞膜的物质。当其进入细胞后,可被细胞内的酶水解生成DCFH,DCFH不能自由穿过细胞膜,从而将探针装载到细胞内。细胞内的ROS可以将无荧光的DCFH氧化成发绿色荧光的DCF,绿色荧光的强弱可以反映细胞内的ROS水平。将细胞按照5×104cells/ml接种于6孔板中。各孔处理后,用PBS洗涤2次,在含10 μmol/L DCFH-DA的无血清培养基中37℃避光孵育30 min。置荧光显微镜下随机摄片,每孔各取5个视野,绿色荧光强度用Image J软件进行分析。
1.9 Real-time PCR 法检测基因表达
引物序列如下。Bcl-2:5′-GGCATCTTCTCCTTCCAG-3′ (forward)和5′-CATCCCAGCCTCCGTTAT-3′ (reverse),caspase-3:5′-CAGACAGTGGAACTGACGATGA-3′ (forward)和5′-AACAGAAACATGCCCCTACCCC-3′ (reverse),caspase-9:5′-CCCGTGAAGCAAGGATTT-3′ (forward)和5′-ACTGTGGGTCTGGGAAGC-3′ (reverse),GAPDH:5′-CTCAACTACATGGTCTACATG-3′ (forward)和5′-TGGCATGGACTGTGGTCATGAG-3′ (reverse)。主要步骤为:细胞接种于6孔板,磷酸缓冲盐溶液(PBS)洗涤2次,加入Trizol试剂完全裂解细胞,收集裂解后的细胞液,取1 μl裂解液,氯仿抽提,异丙醇沉淀,回收总RNA,贮存于-80℃待用。紫外分光光度计A260nm/A280nm鉴定RNA纯度和浓度。取约1 μg总RNA进行反转录。反转录条件为:42℃温育30 min,85℃温育5 s,4℃反应30 min。Bcl-2、caspase-3、caspase-9和内参GAPDH的引物用灭菌水溶解并配制成100 μmol/L的上下游引物混合液,使用浓度为10 μmol/L。Real-time PCR反应条件:预变性95℃ 30 min,变性95℃ 30 s,退火60℃ 30 s,延伸72℃ 1 min,共扩增循环40次,终末延伸72℃ 6 min,4℃终止。循环扩增结束后,记录各组Ct值,根据2-△△CT法计算各组相对mRNA含量。
1.10 统计学分析
2 结果
2.1 H2O2诱导的H9C2细胞衰老
心肌细胞H9C2用不同浓度 (0~100 μmol/L) H2O2处理2 h后再培养3 d,测定衰老和凋亡率。发现30~100 μmol/L H2O2可增加AGEs (细胞衰老的标志物) 含量,50~100 μmol/L H2O2能够增加caspase-3活性,30 μmol/L H2O2仅增加AGEs含量而未影响caspase-3活性 (表1)。因此,在后续的实验中采用30 μmol/L H2O2诱导H9C2细胞衰老。


H2O2 (μmol/L)AGEs contentCaspase-3 activity077±110.034±0.003589±13 --10105±11 --30 348±34**0.036±0.00450 521±44**0.071±0.008**80 681±68**0.080±0.006**100 819±32**0.093±0.005**
AGEs: Advanced glycosylation end products; H202: Hydrogen peroxide
**P<0.01vs0 μmol/L H2O2group
2.2 外源性H2S对细胞活力和细胞凋亡率的影响
与Control组相比,H/R组细胞活力明显降低,细胞凋亡率明显升高;与H/R组相比,PC组上述指标的变化不明显,而H/R+NaHS组和PC+NaHS组细胞活力明显升高,细胞凋亡率显著降低,并且PC+NaHS的作用强于H/R+NaHS(表2)。

GroupCell viability(%)Apoptotic cells(%)Control100±126±1H/R28±3**74±6**H/R+NaHS48±8##50±6##PC27±973±8PC+NaHS68±11△△▲▲34±5△△▲▲
H/R: Hypoxia/reoxygenation; PC: Ischemic post-conditioning
**P<0.01vscontrol group;##P<0.01vsH/R group;△△P<0.01vsPC group;▲▲P<0.01vsH/R+NaHS group
2.3 外源性H2S对活性氧(ROS)产生的影响
I/R或H/R均可增加氧化应激,进而使ROS生成增加。细胞内的ROS可以将无荧光的DCFH氧化生成发绿色荧光的DCF,绿色荧光的强弱可以反映细胞内ROS的水平。与Control比较,H/R组ROS水平显著增加;与H/R组比较,H/R+NaHS组ROS水平明显降低,PC对ROS水平影响不显著;与PC组比较,PC+NaHS组ROS水平明显降低;与H/R+NaHS组比较,PC+NaHS组ROS水平进一步降低(图1)。
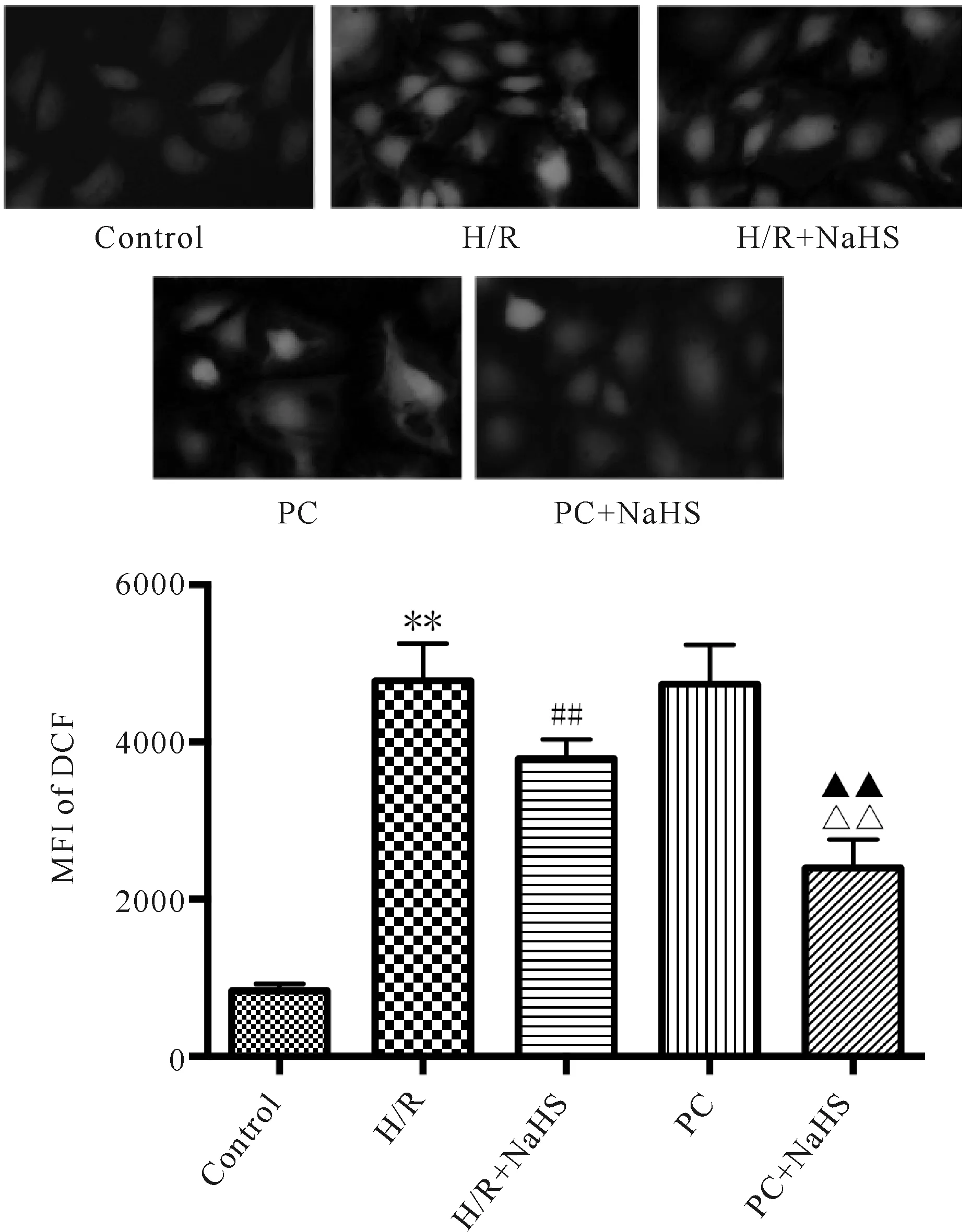
Fig.1The change of ROS levels in the aged H9C2 cells (n=4)
H/R: Hypoxia/reoxygenation; PC: Ischemic post-conditioning
**P<0.01vscontrol group;##P<0.01vsH/R group;△△P<0.01vsPC group;▲▲P<0.01vsH/R+NaHS group
2.4 Real-time PCR检测Caspase-3、Capase-9和Bcl-2基因的mRNA表达
与Control组相比,H/R组caspase-3、caspase-9和Bcl-2 mRNA表达增加 (P<0.01);与H/R组和PC组比较,H/R+NaHS组和PC+NaHS组caspase-3和caspase-9 mRNA表达均明显下降,Bcl-2 mRNA表达均明显升高,且PC+NaHS的作用强于H/R+NaHS (P<0.01),H/R和PC对上述指标的影响相似 (图2)。
3 讨论
H2O2通过上调氧化应激诱导H9C2细胞衰老,但是细胞氧化应激过强会造成细胞凋亡和坏死[7]。AGEs含量增加是衰老的一个最重要标志[8],caspase-3活性增加是细胞凋亡重要的标志之一[9]。研究发现,30~100 μmol/L H2O2呈浓度依赖性增加AGEs含量,50~100 μmol/L H2O2同样呈浓度依赖性增加caspase-3活性,30 μmol/L H2O2仅增加AGEs含量而未影响caspase-3活性。这表明,30 μmol/L H2O2仅诱导H9C2细胞衰老而未诱导其凋亡。因此,在后续实验中,采用30 μmol/LH2O2诱导H9C2细胞衰老。

Fig.2The mRNA levels of Caspase-3 (A), Caspase-9 (B) and Bcl-2 (C) in the aged H9C2 cells (n=4)
H/R: Hypoxia/reoxygenation; PC: Ischemic post-conditioning
**P<0.01vscontrol group;##P<0.01vsH/R group;△△P<0.01vsPC group;▲▲P<0.01vsH/R+NaHS group
在心血管疾病的发生过程中,心肌I/R损伤、心力衰竭有着紧密的联系[7]。I/R可引起心肌细胞损伤及凋亡,其机制较为复杂。目前研究表明,氧化应激、钙超载、内质网应激、氧自由基损伤、能量代谢障碍等均参与I/R损伤的发生、发展过程[6,10-11]。PC对I/R损伤具有保护作用。但是,近年来研究发现,在老龄心肌细胞,PC丧失了这种保护作用,其相关机制为老龄化在心肌细胞的亚细胞和分子水平发挥影响,主要包括其影响DNA水平的变化、基因/蛋白表达的变化和翻译后的修饰、氧化应激和细胞凋亡等[2,10-11]。实验数据显示,与H/R组比较,PC对细胞活力、氧化应激和细胞凋亡的影响不显著,这表明本研究结果与以往报道相一致[2,10-11]。
I/R损伤造成ROS自身清除系统功能紊乱,从而导致活性氧自由基及其相关代谢产物在体内过量积聚造成细胞损伤[12]。ROS含量增加可造成染色质固缩、分离并沿核膜分布,细胞质亦发生固缩,细胞凋亡数量升高;线粒体中脱氢酶减少,细胞活性降低。本研究结果显示:H/R和PC均增加ROS水平,H/R+NaHS 和PC + NaHS均降低ROS水平,且PC+NaHS作用强于H/R+NaHS,这说明,外源性H2S恢复PC对衰老心肌细胞H9C2的保护作用与抑制氧化应激有关。
I/R损伤可诱导细胞凋亡,造成细胞凋亡的经典途径包括线粒体参与的内在凋亡途径、死亡受体介导的外在凋亡途径以及内质网应激途径介导的凋亡途径,其中线粒体途径是起决定性作用的凋亡途径[12]。细胞损伤后,细胞色素C通过线粒体通透转换孔或者Bcl-2家族成员形成线粒体跨膜通道释放细胞质中,释放的细胞色素C能够活化caspase-9,进而激活caspase-3诱导细胞凋亡[12-13]。抗凋亡蛋白Bcl-2对线粒体通透转换孔开放和关闭起着调节作用,可防止线粒体分裂和细胞色素C的大量释放,抑制细胞凋亡[12]。实验结果显示,H/R组和PC组细胞凋亡率明显增加,促凋亡因子 (caspase-3和caspase-9) 和抑凋亡因子Bcl-2 mRNA表达均上调;加入NaHS后,细胞凋亡率显著降低,促凋亡因子表达减少,抑凋亡因子表达增加,且在PC的基础上加入NaHS的作用优于在H/R基础上加入NaHS的作用,该结果表明,外源性H2S通过抑制线粒体凋亡途径恢复PC对衰老心肌细胞H9C2的保护作用。H/R组抑凋亡因子Bcl-2 mRNA表达增加,这可能是由于为了抵抗促凋亡因子增加引起的反馈作用的结果。
综上所述,外源性H2S恢复PC对衰老心肌细胞H9C2的保护作用,其机制与抑制氧化应激和细胞凋亡有关。结合前期实验结果,H2S有望为老龄缺血性心脏病的防治提供新靶点。
