二次冠状动脉旁路移植术的临床应用
2018-11-08左鑫伟李萍陈媛程宇彤
左鑫伟,李萍,陈媛,程宇彤
冠状动脉粥样硬化性心脏病(冠心病)发病率逐年增加[1],接受冠状动脉旁路移植术(CABG)的患者日益增多,CABG手术技术也逐渐成熟。然而随着患者生存期的延长、术后冠心病危险持续存在和药物治疗不规范等因素导致CABG术后患者需再次血运重建的比例也逐渐增高,再次冠状动脉旁路移植术(Re-CABG)数量也日益增多。本文将就目前Re-CABG技术在国内外应用现状、适应症、并发症及预后和手术策略等问题作一综述。
1 Re-CABG国内外应用现状
国外CABG术开展较早,所以Re-CABG患者数量较多。在欧洲和北美地区,甚至有行3次、4次CABG术的报道[2]。据统计,上世纪90年代初,接受CABG术的患者有60万左右,术后10年接受Re-CABG的患者的比率为10%左右,即北美地区接受Re-CABG的患者约6万人。Re-CABG手术期死亡率在5%~16.7%[3],要比同时期CABG手术的死亡率高2~5倍[4]。
我国自成功实施首例CABG术以来,至今发展40余年,然而由于种种原因,接受二次手术的病人较少,临床均为小样本的研究报道(表1)。国内安贞医院[12]报道545例CABG术后再发心绞痛的患者, 仅有5.9%的患者接受Re-CABG术(32例)。而阜外医院[13]报道接受Re-CABG术的患者的比例更低,只有0.2%左右。近年来随着内科介入技术的不断成熟,国外Re-CABG数量呈下降趋势[14]。而国内由于患者数量大,Re-CABG仍有增加趋势。
2 Re-CABG患者临床特点
Re-CABG患者与首次CABG患者临床特点有所不同。前者多具有年龄大,合并多支血管病变、外周血管病发病率高和低的左室射血分数(LVEF)等特点[4],而且这些因素直接影响手术效果。如年龄是术后30 d死亡率和长期存活率最重要的预测因子(“年轻”:1.7%,“中间”:2.3%,“老”:4.3%,P<0.0001)[4]。Patel等[15]认为术前低左室射血分数是手术死亡率的增加的独立危险因素。这些患者术前应用IABP辅助优于目前临床上的任何药物,可明显降低其死亡率,延长患者生存期,促进恢复。也有研究显示糖尿病、高脂血症、高血压、吸烟史等危险因素在Re-CABG患者患病率更高[16]。Simon Maltais等[17]回顾性分析748例Re-CABG者,年龄中位数为69岁(36~88岁),其中男性86%,术前存在糖尿病191例(26%),高血压562例(75%),外周血管病459例(28%),脑血管病史121例(16%),有心肌梗死病史占61%。这也和国内的小样本数据分析结果类似[7,11]。另外,Spilotopoulos等[18]回顾性研究近20年冠脉旁路移植术的变化趋势发现第一次CABG和第二次CABG期间,许多患者接受了至少一次经皮冠状动脉介入(PCI)治疗。
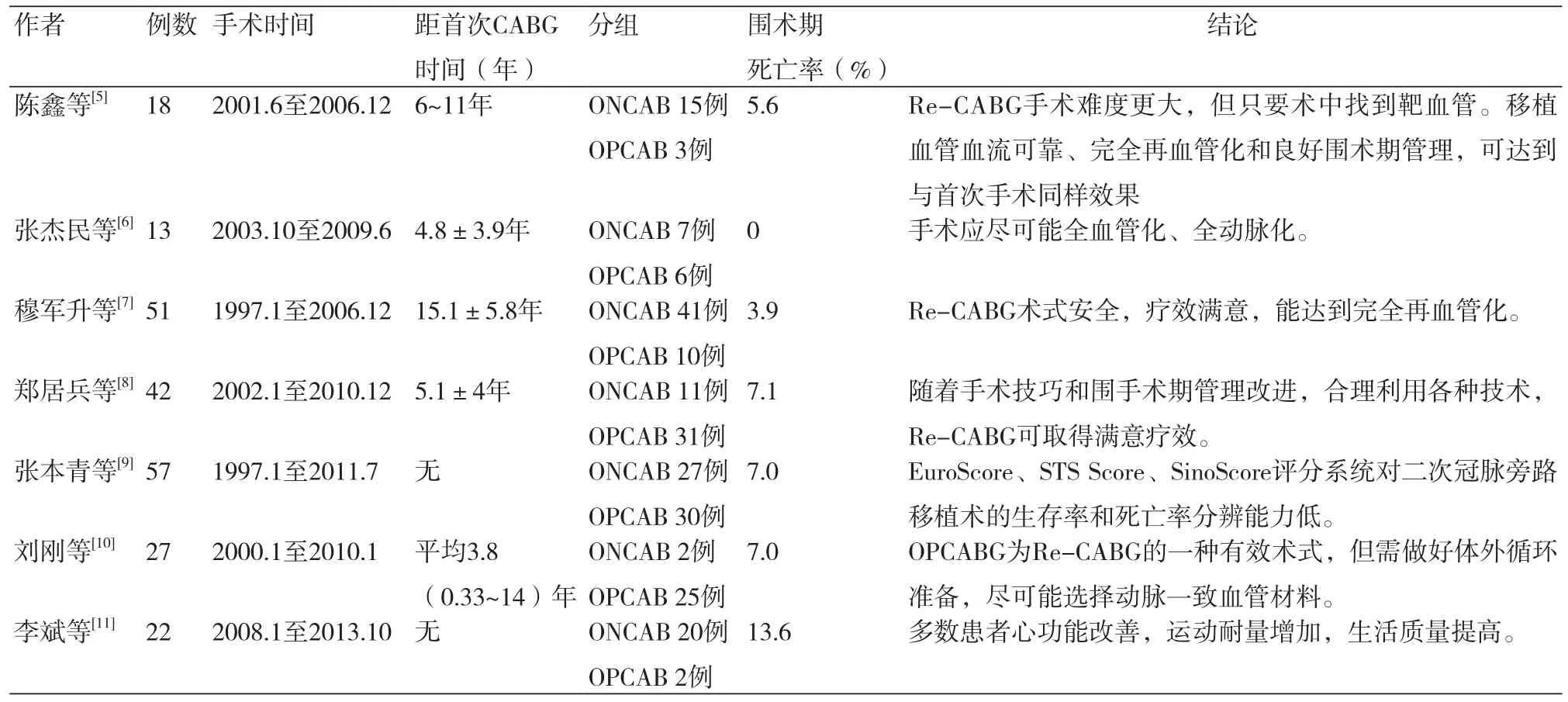
表1 近10年国内发表的有关二次CABG术的报道
3 Re-CABG 适应证
随着内科PCI技术的不断进步与发展,Re-CABG手术适应症也在不断变化。目前比较公认的Re-CABG适应症为①再发心绞痛经冠状动脉造影提示不适合内科介入治疗;②再发心绞痛距初次CABG术5年以上,不论是否具有PCI适应症;③多支静脉桥血管严重狭窄或前降支静脉桥血管狭窄大于50%;④多支冠状动脉严重狭窄或闭塞,尤其合并前降支近端狭窄或左主干严重狭窄;⑤急性心肌梗死后低心排、心脏破裂、心脏压塞、乳头肌断裂引起二尖瓣重度关闭不全;⑥PCI术失败、出现严重并发症或预后不佳。
4 Re-CABG手术策略
影响手术效果除了与患者临床因素相关,还有一些技术策略也影响预后,这包括:如何选择手术入路及处理并发症;如何处理原冠状动脉和原移植血管;如何选择心肌保护方式;如何选择术式等。
4.1 手术入路和并发症处理首次CABG术后心包往往闭合不佳,从而导致主动脉、右室和移植物与胸骨发生粘连。如果Re-CABG时仍选择正中切口,则可能术中直接损伤上述结构[19]。解决办法有:①术前运用影像检查仔细评估纵膈器官与胸骨的距离;②开胸时使用电锯;③先经外周置管行体外循环(不一定深低温停循环)[19,20];④重新考虑切口路径。如在前降支、右冠脉近端狭窄和三支病变的患者,Re-CABG时可以仍首选正中切口。而对于左回旋支或左钝圆支狭窄的情况,可选择左胸侧切口[4]。对右冠远端行CABG还可以选择腹部入路。Re-CABG时选择前壁小切口入路较再次经胸骨入路可以减少术中损伤。
选择手术入路的第二个挑战是在分解心包和胸骨粘连物时,导致已严重动脉粥样硬化的静脉桥血管内的脂质斑块破裂,进而出现血管内血栓或栓塞。这在处理右冠状动脉静脉桥血管与右房粘连时最容易发生。预防措施是在分离静脉桥血管之前先停循环并钳夹主动脉根部,这要求分解粘连的范围只要能满足插管上机(体外循环)即可。倘若连此条件都无法满足,只能先经外周血管行体外循环[19]。
4.2 如何处理已严重动脉粥样硬化的静脉桥血管?简单一句话:要么替代,要么共存[21],即新的移植血管完全替代原通畅的移植静脉血管,或者矿置原通畅的移植静脉血管。两种处理各有利弊。前者有发生低灌注和心梗的风险。而旷置原通畅的移植静脉血管则有可能引发竞争血流[20]。但保护通畅的左乳内动脉(LIMA)桥血管对Re-CABG手术效果影响重大,最有效的办法是在首次CABG时做胸膜、心包保护“鞘”或人工血管鞘包裹LIMA,以避免再次手术时LIMA被损伤。
如果患者并发严重的主动脉斑块或狭窄,桥血管近端吻合口的选择是难点。应对办法是深低温停跳同时行主动脉根部置换;也可以将桥血管近端选择与腋动脉吻合,但一般不首选与易并发动脉硬化的髂股动脉吻合[22]。
4.3 术中心肌保护方式Re-CABG术中灌注心肌保护液有前向和逆向两种方式。前向灌注有效果差及血管远端栓塞风险,而逆向灌注在某些情况下又不能完全覆盖心肌(如桥血管吻合于后降支,此时经桥血管灌注,右室心肌则往往无停跳液灌注),所以两种方式联合可能更合适[23]。
深低温停循环时需要主动脉根部夹闭以防停跳液溢出及升温,但原通畅的桥血管往往无法做到被夹闭,此时则需要全身的降温处理措施。
4.4 Re-CABG术式主要有体外循环下CABG(ONCABG)和非体外循环下CABG(OPCABG)两种。OPCABG优点在于:小的分离面积、更少的出血量、可避免体外循环(CPB)相关的炎症反应,减少凝血功能障碍及组织损伤改善围手术期效果[24],避免肺适应性降低而缩短呼吸机辅助通气时间和ICU入住时间[25]。但OPCABG缺点是完全血运重建率低。Tugtekin等[26]比较了Re-OPCABG与Re-ONCABG的完全血运重建率,结果为48.6 vs. 86.9%;Czerny及其同事[27]报道的Re-OPCABG术的完全血运重建率更低(27% vs.92%)。但有回顾性研究提示Re-OPCABG组的移植物的数量少于Re-ONCAB组(2.5±1.2 vs. 3.0±1.1)[28]。
Basel等[29]研究显示Re-OPCABG患者术后总的事件发生率低,尤其是术后短期预后好,包括房颤发生率减低,ICU住院时间减少,总住院天数减少等。Engin等[30]研究显示Re-OPCABG较Re-ONCABG的3年生存率更高(81±12% vs. 63±9%),而术后生活质量对比两组间没有任何显著差异,但更晚期预后比较(6年)两者在存活率和主要心脏事件(经皮腔内冠状动脉成形术、心肌梗死、死亡和手术)方面没有差别[31]。
目前多项研究显示首次OPCABG是高龄、心功能不全、肾功能不全、既往有脑卒中和严重动脉硬化患者的首选术式。对于再次冠脉旁路移植术,国内小样本非随机对照研究[32]显示在上述合并症较多的患者中,Re-OPCABG与Re-OPCABG术式在主动脉球囊反搏、连续肾脏替代治疗、住院卒中、住院死亡率等主要终点事件无显著差异,而前者手术时间、ICU时间、输血发生率均小于后者,提示OPCABG术在Re-CABG患者可能具有更好的效果。韩国及日本的[33,34]研究与国内研究的结果相似,即这两种术式在亚洲人群中围手术期并发症、住院死亡率、长期生存率等方面无显著性差异。在仅需移植1~2支桥血管的患者,Re-OPCABG和Re-ONCABG疗效相当[35]。所以对具有此类特征的高危Re-CABG患者,OPCABG也可能是优选术式。
Re-CABG乳内动脉桥血管的通畅率优于桡动脉,桡动脉优于大隐静脉[36],有研究提示原位IMA移植术后10年通畅率达90%以上,而大隐静脉由于退行性变或粥样硬化,远期血管通畅率明显降低[37]。总体上,目前认为Re-CABG术应尽量完全再血管化和完全动脉化[38]。
目前Re-CABG术后患者二级预防药物包括双联抗血小板、他汀、β-阻滞剂、血管紧张素转换酶抑制剂等,规范的药物治疗改善患者预后[39],同样,饮食和运动管理能够延缓桥血管冠脉粥样硬化的进展。遗憾的是Garrett等[40]报道指出多数患者在术后1年后依从性仍明显下降,这可能是导致手术获益减少的原因。
5 小结
Re-CABG手术量逐年增多;围手术期和远期死亡率高于首次CABG;患者临床特征及手术策略影响Re-CABG预后;OPCABG术式应用增加,在仅需移植1~2支桥血管的患者可达到与ONCABG近似的临床效果和远期预后。
今后Re-CABG应向微创化、提高桥血管远期通畅率方向发展。随着Re-CABG手术不断增多,应加快开展大规模临床多中心、随机和对照研究,对Re-CABG手术策略做深入的观察。而我国开展CABG手术时间短,Re-CABG手术例数量少,发展将任重道远。
