肺动脉内膜剥脱术患者再灌注肺水肿的防治进展
2018-11-08宋武刘盛
宋武,刘盛
慢性血栓栓塞性肺动脉高压(CTEPH)在肺高血压指南中被归为第四大类肺高压[1]。国际上公认,肺动脉内膜剥脱术(PEA)是唯一能够治愈CTEPH的方法[2]。目前,国内外开展PEA的心血管病中心不断增多,并有国外中心报道了PEA后的远期结果[3]。据一项国际调查显示,在经验丰富的心血管病中心,PEA后的院内死亡率约为4.7%[4]。仅个别经验丰富的中心,近几年术后死亡率低于2.0%,但仍高于其他传统心脏手术。世界上手术例数最多、经验最丰富的美国加州大学圣地亚哥分校医学中心目前已完成超过3200例PEA,最近几年手术死亡率为1.5%[5]。再灌注肺水肿(RPE)作为PEA后特有且最常见的并发症之一,即便在世界上经验最丰富的医学中心也无法避免。尤其是严重RPE,因其治疗方法有限、效果不佳且高治疗费用、高院内致死率,一直是外科医生、麻醉医生及ICU医生们心中的噩梦,也是开展PEA的肺血管中心必须加强认识并重点关注的并发症。本文结合国内外最新研究进展,就PEA后RPE的发生率、临床表现、危险因素、预防及治疗等方面进行综述。
1 RPE的发生率
PEA后使得原来堵塞的肺血管恢复血流灌注,当压力超过血管内皮的承受度,会使其通透性增加,进而发生RPE。由于判断的标准不同,国外早年报道,PEA后RPE的发生率为10%~40%[6]。随着经验的积累、团队整体技术的提升,围术期RPE发生率已有所下降。例如, UCSD医学中心报道的围术期RPE发生率已降至5%以下[5];本中心最近报道的一组病例中,围术期RPE发生率仅为3.57%[7]。尽管围术期RPE的发生率在下降,但是RPE及残余肺动脉高压仍是PEA后最常见的并发症[2]。
2 RPE的临床表现
PEA后恢复血流灌注的肺部区域,在X光线下不通透,胸片上表现为局部间质及肺泡浸润影,即提示RPE。UCSD医学中心将RPE定义为动脉氧分压/吸入氧气浓度的比值降低且小于300 mmHg(1 mmHg=0.133kPa),同时伴有胸片浑浊影。RPE通常发生在术中或术后早期(60%),少数患者(25%)会有延迟并发生在术后48 h内,极少数(5%)发生在手术48 h后[2]。RPE发生后即使予以高浓度氧气吸入,患者表现出氧分压降低,二氧化碳潴留,吸气压峰值增加。大多数RPE患者反应轻微,只有10%的RPE患者症状明显[8]。最严重的在术中撤除体外循环机即刻,就表现出严重低氧,血流动力学不稳定,经气道吸出大量粉红色泡沫痰[9]。
3 RPE的危害
轻症RPE只在胸片上有表现,严重患者机械通气时间及ICU时间均延长,更严重的患者还需应用体外膜肺氧合(ECMO)支持,以上这些支持治疗手段的应用及相应治疗时间的延长显然增加了患者的住院费用,也影响了术后的肺功能,增加患者围术期死亡风险[8,10-13]。据一项欧洲多中心登记注册的研究,欧洲和加拿大的27个中心在2007年2月~2009年1月期间,404例CTEPH的患者接受PEA,22例围术期死亡,其中7例死于再灌注肺水肿[4]。
4 发生RPE的危险因素
4.1 病情因素术前严重肺高压(纽约心功能分级高、平均肺动脉压力高、肺血管阻力大)以及术后残余肺高压的程度,与术后发生RPE密切相关[14,15]。术后需要应用ECMO辅助的重症RPE患者中,术前多有重度肺动脉高压和极大的肺血管阻力[10-13]。而RPE持续时间与患者的年龄、性别、栓塞症状持续时间、肺动脉压力、心排量、肺血管阻力以及血气分析结果等无关[6]。
4.2 临床治疗因素Gerard强调围术期应该:①尽量消除患者低氧、高碳酸血症、酸中毒、紧张等增加肺血管阻力的因素;②术后当晚使用丙泊酚充分镇静、镇痛,延长机械通气时间,以防迟发性RPE;③加强利尿以降低右心容量负荷,并且避免心输出量增加,以减少肺毛细血管向肺实质渗出,从而减轻再灌注肺损伤[8]。可见低氧、高碳酸血症、紧张情绪、疼痛刺激、右心高容量负荷、不恰当的血管活性药物、呼吸机辅助时间不足及呼吸机模式不当等,都可能增加围术期发生RPE的风险。
4.3 病理分型依据术中血栓解剖部位及肺血管壁的病理改变,UCSD将CTEPH分为四种类型[5]。(表1)UCSD 3型是最常见的外周型CTEPH,手术挑战性大,且常合并存在外周小动脉病变,术后多存在残余肺高压。另外,支气管肺血管侧枝动脉的存在,增加了PEA术后再通肺血管的灌注血流及压力,可能增加围术期RPE的发生率[9]。围术期发生RPE的患者中,3型病变占比大。那么,外周型病变可能也是发生RPE的危险因素。
5 RPE的预防策略
预防RPE需要多团队合作。术前心血管内科、影像医生正确诊断CTEPH及合并疾病,精确测量肺动脉压力、肺血管阻力,识别外周病变,外科医生病例的选择,介入医生提前栓塞支气管肺血管侧枝动脉;术中外科医生精准彻底的内膜剥脱并避免副损伤,麻醉、体外循环医生的协作配合;术后ICU医生加强监护等,优化以上这些环节都能避免或降低围术期RPE的发生。
5.1 手术病例选择目前,还没有针对PEA后发生RPE的术前预测或评估标准。外科医生和管理团队的经验是决定CTEPH患者预后最重要的因素。UCSD医学中心列出的以下几点病例选择依据可供参考:①患者症状的严重性;②肺动脉高压和右心功能不全的严重性(症状严重性与堵塞程度相匹配的患者,无论肺动脉高压和右心功能不全的严重程度如何,都应进行手术);③经高质量影像学评估慢性血栓栓塞疾病堵塞的范围和程度;④肺动脉高压的严重程度和堵塞程度的相关性(术前存在严重肺动脉高压及右心衰竭的患者,周围病变越广泛,PEA手术挑战性越大。段以远及亚段水平的层面术中很难剥脱,对于这类患者部分中心因经验有限会归为手术禁忌症。因此,判断不能接受手术治疗的CTEPH患者,至少要经过两个经验丰富的外科医生评估);⑤患者合并的疾病(大多数合并的心脏疾病都不是PEA的禁忌症;但是严重肺气肿和间质性肺疾病是手术禁忌症);⑥手术存在的技术挑战;⑦根据患者的个人预期和风险接受度,评估手术风险/获益比(年轻患者对生活质量要求高,轻微症状的患者也可考虑手术)[2]。

表1 CTEPH临床病理分型
因此,对于经验不多的中心,在起步阶段挑选手术病例时应极为严格。建议,优先处理那些术前低肺血管阻力,血栓栓塞部位集中在肺动脉主干至段水平,且栓塞程度与临床症状相匹配,无明显周围性病变的病例。这样可以降低围术期严重并发症发生率,也能让一部分适合手术的严重CTEPH患者到有经验的中心得到最好的治疗。
5.2 术前介入栓塞支气管肺血管侧枝动脉术前经导管栓塞支气管肺动脉的侧枝动脉(PTOBPCA)减少了PEA术后再通肺血管的灌注血流及压力,可能避免或减轻RPE的发生。北京安贞医院甘辉立教授的报道也支持了这一观点[9],相比对照组(87例),PTOBPCA治疗组(68例)在PEA后RPE发生率降低并且症状减轻,ICU时间减少,机械通气时间减少,ECMO的使用率降低,术后早期血流动力学改善更明显。
5.3 麻醉管理尽量消除患者因低氧、高碳酸血症、酸中毒、紧张及疼痛等增加肺血管阻力的因素。选用对心脏及血流动力学影响小的麻醉剂,如依托咪酯。而丙泊酚等因具有心肌抑制作用,选用时要格外慎重[8]。另外,镇静剂过量会导致低氧、高碳酸血症,也能增加肺血管阻力。
围术期加强利尿以降低右心容量负荷,并且避免心输出量增加,以减少肺毛细血管向肺实质渗出,从而减轻再灌注肺损伤。避免尝试使用硝酸甘油、硝普钠等降低肺血管阻力,因为它们在治疗CTEPH上作用有限,而且会影响右冠状动脉的灌注压,反而快速导致低血压及心力衰竭[8]。
5.4 外科医生手术原则UCSD不断总结经验,针对手术过程总结了以下四条基本原则:①正中开胸,必须双侧剥脱;②为了术野的清晰,应用间断停循环技术,并降温至20℃左右,每次停循环不超过20 min;③识别正确的剥离层面;④必须充分剥脱内膜。
5.5 体外循环管理成熟的体外循环管理过程是PEA后患者顺利恢复必不可少的一部分。一项针对国际多中心(15个)PEA中体外循环管理的调查报告[16],从材料的选择,预充液的配比,抗凝管理,降复温管理,脑灌注选择,内环境管理等很多方面描述了当前体外循环管理技术的现状及趋势变化。从此调查报告可见,目前PEA体外循环的管理重心是深低温停循环技术中的脑保护,并未提到专门针对围术期RPE的预防措施。本中心的PEA体外循环管理经验是,在预充液中加入20 g白蛋白,提高转流过程中胶渗压至15 mmHg,在复温过程中,再加入10~20 g白蛋白,并给予甘露醇脱水,超滤滤除体内多余水分进一步提高胶渗压至18 mmHg,既避免因预充液中胶体渗透压较低导致肺水肿,也避免了低流量或停循环期间胶渗压过高对肾功能的损伤。
5.6 术后监护管理
5.6.1 及早发现RPEICU医生提早发现潜在RPE的患者并做出治疗,将肺损伤降至最低。法国医学中心最近报道[15],经患者股动脉植入脉冲式心排仪(PiCCO)跨肺压热稀释法导管,术后2 d内测量血管外肺水量(EVLW)。通过EVLW评估RPE的发生,能早于胸片发现亚临床RPE。当EVLW测算结果大于8 ml/kg时将发生RPE,其敏感性为84.6%,特异性为80.0%。测量EVLW指标,及早发现亚临床RPE并提前干预,可能避免再灌注肺损伤加重。
5.6.2 关于激素的应用围术期甲基强的松龙的应用并不会降低PEA后RPE的发生率。甲基强的松龙抑制了促炎因子IL-6和IL-8的增加,并且促进抗炎因子IL-10的增加。但是,甲基强的松龙并没有降低术后再灌注肺损伤的的程度,因为对机械通气时间,ICU时间及住院时间并无改善[14]。
5.6.3 机械辅助通气手术当晚应该充分镇静、镇痛,延长机械通气时间,以防迟发性RPE[8]。呼吸机设置为压力控制模式,呼气末正压通气(PEEP),反比例通气,以促进通气/灌注匹配并将肺损伤降至最低。这些措施有利于术后肺泡复张及血气充分交换,同时在肺实质形成正压,可减少肺血渗出。压力控制模式通气可增加肺泡气体交换效率,减少呼吸肌做功,且在一定程度上减少回心血量,起到减轻心脏前负荷的作用[7,8]。Peter等提出应用非侵略性机械通气模式(小于8 ml/kg的低潮气量,吸呼比为3:1,吸气末峰压小于18 cm H2O),可降低PEA后RPE发生率及死亡率[17]。但是,后来UCSD医学中心通过随机对照研究,发现低潮气量通气并不能降低围术期RPE的发生率,也不能改善临床预后[18]。
6 RPE的治疗
围术期出现RPE后的常规治疗包括,严格限制液体入量,加强利尿以减轻肺水肿;避免高心输出量;最大程度降低耗氧量,以利于肺功能的恢复。当情况严重时,还包括以下治疗方法:
6.1 治疗残余肺动脉高压由于围术期RPE和残余肺高压常同时存在,因此治疗上也应同时处理。针对手术无法处理的周围血管病变,当术后存在残余肺动脉高压,可以使用肺血管扩张剂,如米力农、吸入性前列环素、一氧化氮(NO)[8]。还有,当前唯一通过美国食品药品监督管理局认证的肺血管靶向药物—利奥西呱,可用于治疗不能手术的CTEPH患者或PEA后残余肺动脉高压患者。
6.2 机械辅助通气当常规给氧无法满足机体需求时,需应用机械辅助通气,呼吸机压力控制模式,呼气末正压通气,反比例通气,以促进通气/灌注匹配并将肺损伤降至最低[8]。俯卧位机械通气方式[20],也可能有助于氧合的增加。
6.3 ECMO的应用当严重RPE经传统治疗无效,且引起危及生命的呼吸衰竭时,需要应用ECMO过渡到康复或肺移植。目前,共有4篇非个案文献报道过,应用ECMO治疗重症PEA围术期并发症的结果和短期死亡的影响因素[10-13]。
6.3.1 ECMO的应用情况及结果(表2)
6.3.2 ECMO的模式选择针对不同病情选用不同的ECMO辅助模式。V-V ECMO适用于治疗再灌注肺损伤而右心功能正常患者,尤其是PEA术后回到ICU的患者。通过提供充足的气体交换,并避免正压通气加重肺损伤,挽救患者生命。V-A ECMO更适用于术后即刻残存肺动脉高压且右心功能逐渐下降的患者,通过降低右心容量,利于心室功能恢复,还通过提高心输出量和氧气含量以最优化氧气运输[10-13]。
7 总结
RPE作为PEA围术期最常见的并发症之一,是增加围术期死亡率的重要因素。随着内科、外科、麻醉、体外循环、重症监护等团队技术的提升,其发生率已有所下降。但是,经验丰富的中心也未能避免RPE的发生。RPE的机制还不明确,在防治围术期RPE方面,国内外做了很多研究。但是目前,在PEA术前还没有关于RPE的预测指标,术中及术后还是以传统的支持治疗为主。尽管ECMO辅助挽救了部分重症RPE患者的生命,但成功率还是不高;因经济、技术等方面的限制,也未能普遍推广应用。选择合理时机应用ECMO,熟悉不同应用模式及适应证,并减少副损伤。对于PEA围术期RPE,尽管我们面临的挑战很多,但相信随着研究的深入,团队经验的增加,必定能够攻克RPE,使得CTEPH患者在PEA后顺利恢复。
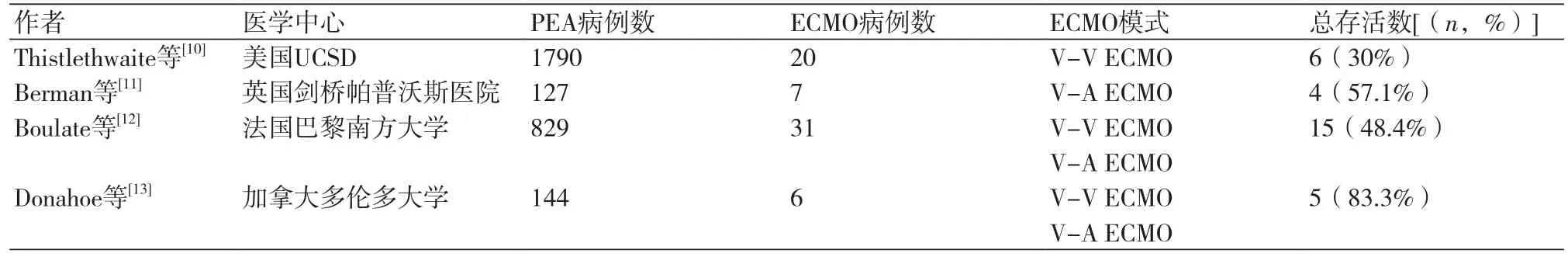
表2 国际报道ECMO在PEA术后的应用情况及结果
