HMGB1对缺氧复氧心肌细胞氧化损伤的影响研究
2018-11-08邓秋菊李慧颖向琳
邓秋菊,李慧颖,向琳
心肌缺血再灌注损伤是指心肌组织缺血后,恢复组织血液流通加重了缺血性损伤,其与心肌梗死、冠状动脉粥样硬化性心脏病(冠心病)等疾病发生有关,心肌缺血再灌注损伤伴随有心肌细胞氧化损伤、细胞过度凋亡等病理学变化[1,2]。高迁移率蛋白1(HMGB1)是一种染色体结合蛋白,其在染色体结构维持、基因的转录等过程中具有重要作用。当组织受到损伤后,HMGB1可作为一种警报素从坏死细胞、应激细胞、活化的免疫细胞等中被释放出来,参与心肌损伤[3,4]。研究显示,HMGB1参与糖尿病心肌病、心肌缺血再灌注、心肌肥大等疾病的发生,心肌细胞可以释放HMGB1,参与心肌组织疾病的发生[5-7]。本研究通过构建缺氧复氧心肌细胞模型,研究缺氧复氧对心肌细胞释放HMGB1的影响,通过小RNA干扰技术下调心肌细胞中HMGB1的合成,研究HMGB1在缺氧复氧心肌细胞氧化损伤中的作用。
1 材料与方法
1.1 材料H9C2细胞购自于美国ATCC;HMGB1siRNA和siRNA control购自英国Abbexa;Lipofectamine 2000购自美国invitrogen;HMGB1、GAPDH引物由南京金斯瑞合成;qRT-PCR和cDNA合成试剂均购自美国Thermo;丙二醛(MDA)含量测定试剂盒购自美国Sigma;乳酸脱氢酶(LDH)含量测定试剂盒购自沈阳万类生物;超氧化物歧化酶(SOD)含量测定试剂盒购自日本DOJINDO;HMGB1含量测定试剂盒购自上海西唐生物;剪切的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)抗体、Bcl-2相关X蛋白(Bax)抗体、剪切的含半胱氨酸的天冬氨酸蛋白水解酶9(Cleaved Caspase-9)抗体购自美国CTS。
1.2 缺氧复氧心肌细胞模型构建H9C2细胞培养于含有10%胎牛血清的DMEM中。缺氧复氧模型构建:H9C2细胞密度约为60%时,用移液枪把培养液吸除以后,再添加不含血清的DMEM,把细胞放在95%N2、5% CO2培养箱内孵育12 h。取出培养板,把原来的培养液倒掉,换成10%胎牛血清的DMEM,把细胞放置于95%空气、5% CO2培养箱复氧约4 h,即为缺氧复氧心肌细胞模型。
1.3 细胞转染和分组H9C2细胞接种到6孔细胞培养板中,细胞密度约为70%时,进行细胞转染。取HMGB1 siRNA和siRNA control各5 μl分别与5μl的Lipofectamine 2000混合后,再与250 μl的Opti-MEM混合稀释。在室温中结合5 min后,添加到6孔板中,培养6 h后,把细胞培养液换成是含有10%胎牛血清的DMEM继续培养。H9C2细胞分为正常组、模型组、阴性组、干扰组。转染HMGB1 siRNA和siRNA control后的心肌细胞经过缺氧复氧处理以后分别记为干扰组和阴性组,以不做转染的心肌细胞经缺氧复氧处理后记为模型组,以正常培养不做任何处理的心肌细胞记为正常组。
1.4 qRT-PCR检测心肌细胞中HMGB1 mRNA水平正常组、模型组、阴性组、干扰组细胞按照上述方法处理以后,提取细胞中的总RNA,测定提取的RNA OD260 nm/OD280 nm介于1.8~2.0之间。取各组RNA,进行逆转录。取cDNA,进行qRT-PCR,分两步扩增,95℃,10 min;95℃,15 s;60℃,60 s×40个循环。以GAPDH把对照进行归一,用2-△△Ct法计算基因转录水平。引物:GAPDH 上游 5,-TCCACCACCCTGTTGGTG TTA-3’,下游 5,-ACCACAGTCCATGCCATCA C-3’。
HMGB1上游5,-CGGAGTCAACGGATTTGGT CGTAT-3’,下游5,-AGCCTTCTCCATGGTGGT GAAGAC-3’。本实验重复3次。
1.5 ELISA测定细胞分泌HMGB1水平正常组、模型组、阴性组、干扰组细胞按照上述方法处理以后,收集细胞培养液上清,用ELISA法测定各组培养液上清中HMGB1含量,步骤参照试剂盒说明书。本实验重复3次。
1.6 细胞中MDA、SOD水平和培养液中LDH水平测定正常组、模型组、阴性组、干扰组细胞按照上述方法处理以后,收集培养液上清和各组细胞,用硫代巴比妥酸比色法检测细胞中MDA含量,用黄嘌呤氧化法检测细胞中SOD含量,用二硝基苯肼显色法检测上清中LDH,步骤分别参照试剂盒说明书。本实验重复3次。
1.7 流式细胞术测定细胞凋亡正常组、模型组、阴性组、干扰组细胞在按照上述方法处理以后,加入胰蛋白酶消化以后,1000 g离心10 min,把上清吸除以后,添加500 μl的Binding buffer,再添加10 μl的PI和5 μl的Annexin V-FITC,用流式细胞仪检测凋亡,重复3次。
1.8 Western blot测定Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平正常组、模型组、阴性组、干扰组细胞在按照上述方法处理后,PBS洗涤各组心肌细胞并加入预冷的裂解缓冲液,在冰上裂解30 min后离心取上清,以BCA法检测蛋白浓度进行蛋白定量后,进行10% SDSPAGE电泳,上样量体积含20 μg蛋白。电泳结束后,将目的胶转移到硝酸纤维素膜上。5%脱脂奶粉封闭转好的PVDF膜2 h,洗膜,室温孵育稀释好的Cleaved Caspase-3、Bax、Cleaved Caspase-9及内参GAPDH抗体(均为1:800稀释)2 h,洗膜,加入二抗,室温孵育1.5 h。ECL显色液避光显色,扫描图像,以GAPDH的灰度值为内参,分析各蛋白水平,重复3次。
1.9 统计分析实验数据分析用SPSS 21.0软件,计量资料以(±s)表示,多组差异比较均用单因素方差分析,组间比较均用LSD-t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 缺氧复氧后心肌细胞合成HMGB1水平模型组细胞培养液上清中HMGB1含量和细胞中HMGB1 mRNA水平明显高于正常组,差异具有统计学意义(P<0.05)。阴性组细胞培养液上清中HMGB1含量和细胞中HMGB1 mRNA水平与模型组相比没有明显变化(P>0.05)。干扰组细胞培养液上清中HMGB1含量和细胞中HMGB1 mRNA水平明显低于模型组,差异具有统计学意义(P<0.05)(表1)。
2.2 敲低HMGB1对缺氧复氧心肌细胞氧化损伤影响模型组细胞培养液上清中LDH水平和细胞中MDA水平明显高于正常组,SOD水平明显低于正常组,差异具有统计学意义(P<0.05)。阴性组细胞培养液上清中LDH水平和细胞中MDA水平、SOD水平与模型组相比没有明显变化(P>0.05)。干扰组细胞培养液上清中LDH水平和细胞中MDA水平明显低于模型组,SOD水平明显高于模型组,差异具有统计学意义(P<0.05)(表2)。
2.3 敲低HMGB1对缺氧复氧心肌细胞凋亡影响模型组细胞凋亡率明显高于正常组,差异具有统计学意义(P<0.05)。阴性组细胞凋亡率与模型组相比没有明显变化(P>0.05)。干扰组细胞凋亡率明显低于模型组,差异具有统计学意义(P<0.05)(图1、表3)。
表1 各组细胞HMGB1合成水平(±s)

表1 各组细胞HMGB1合成水平(±s)
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05;与模型组相比,cP<0.05
组别 上清液中HMGB1含量(ng/106个细胞) 细胞内HMGB1 mRNA正常组 1.90±0.17 1.00模型组 3.32±0.32a 2.97±0.24a阴性组 3.41±0.36b 2.99±0.28b干扰组 2.37±0.29c 1.86±0.14c
表2 各组细胞培养液中LDH水平及细胞中MDA、SOD水平(±s)
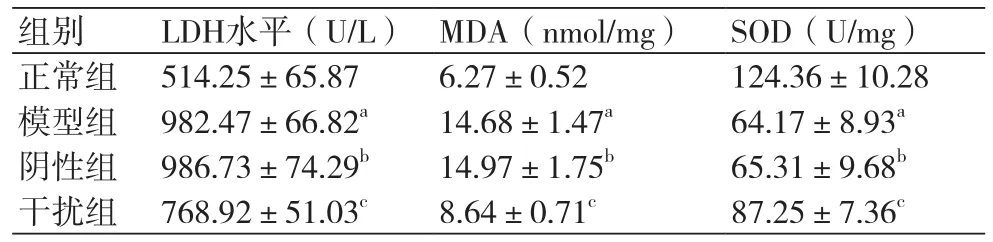
表2 各组细胞培养液中LDH水平及细胞中MDA、SOD水平(±s)
注:LDH:乳酸脱氢酶;MDA:丙二醛;SOD:超氧化物歧化酶;与正常组相比,aP<0.05;与模型组相比,bP>0.05;与模型组相比,cP<0.05
组别 LDH水平(U/L) MDA(nmol/mg) SOD(U/mg)正常组 514.25±65.87 6.27±0.52 124.36±10.28模型组 982.47±66.82a 14.68±1.47a 64.17±8.93a阴性组 986.73±74.29b 14.97±1.75b 65.31±9.68b干扰组 768.92±51.03c 8.64±0.71c 87.25±7.36c
2.4 敲低HMGB1对缺氧复氧心肌细胞中Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平影响模型组细胞中Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平明显高于正常组,差异具有统计学意义(P<0.05)。阴性组细胞Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平与模型组相比没有明显变化(P>0.05)。干扰组细胞Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平明显低于模型组,差异具有统计学意义(P<0.05)(图2、表4)。
3 讨论
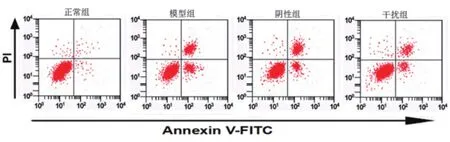
图1 流式细胞术测定下调HMGB1对缺氧复氧心肌细胞凋亡影响
表3 各组心肌细胞凋亡率(±s)
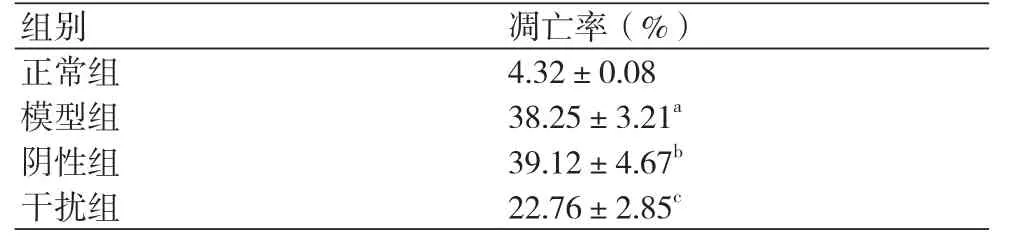
表3 各组心肌细胞凋亡率(±s)
注:与正常组相比,aP<0.05;与模型组相比,bP>0.05;与模型组相比,cP<0.05
组别 凋亡率(%)正常组 4.32±0.08模型组 38.25±3.21a阴性组 39.12±4.67b干扰组 22.76±2.85c
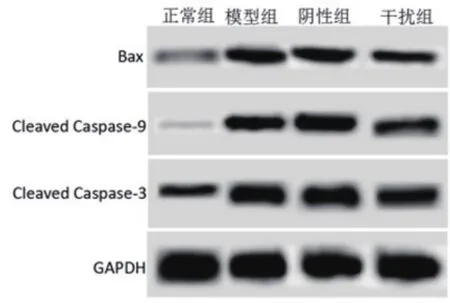
图2 Western blot测定下调HMGB1对细胞中Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白影响
表4 各组细胞中Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平(±s)
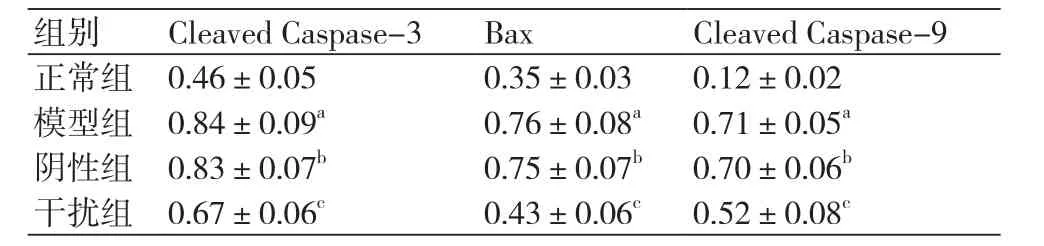
表4 各组细胞中Cleaved Caspase-3、Bax、Cleaved Caspase-9蛋白水平(±s)
注:与正常组相比,aP<0.05;与模型组相比,bP>0.05;与模型组相比,cP<0.05
组别 Cleaved Caspase-3 Bax Cleaved Caspase-9正常组 0.46±0.05 0.35±0.03 0.12±0.02模型组 0.84±0.09a 0.76±0.08a 0.71±0.05a阴性组 0.83±0.07b 0.75±0.07b 0.70±0.06b干扰组 0.67±0.06c 0.43±0.06c 0.52±0.08c
HMGB1蛋白由215个氨基酸组成,属于非组蛋白染色体结合蛋白,可以通过核小体与DNA结合,诱导相关基因的转录和表达[8,9]。HMGB1在细胞内和细胞外都具有调控细胞生物学功能的作用,其可被损伤的细胞释放至细胞外,调控组织炎症[10],在胃肠道相关炎症、心肌炎等方面具有重要作用。近年来的研究显示,HMGB1参与心肌缺血再灌注损伤,在心肌缺血再灌注损伤模型中表达上调[11]。高糖诱导心肌细胞中HMGB1的合成和分泌,并且参与高糖诱导的心肌细胞凋亡和氧化损伤过程[12]。本实验的研究结果显示,HMGB1在缺氧复氧心肌细胞中转录水平升高,细胞分泌的HMGB1水平也升高,说明缺氧复氧诱导心肌细胞合成和分泌HMGB1,这与上述报道相一致。
心肌缺血再灌注发生时,会产生大量的氧自由基,导致细胞内的脂质发生过氧化,引起细胞膜通透性发生改变,导致原本存在于细胞内的LDH被泄漏到细胞外[13]。MDA是脂质发生过氧化的产物,检测其表达水平的高低可以间接反应细胞内氧化损伤程度[14]。细胞内氧化平衡状态的维持与细胞内的抗氧化和氧化系统的动态平衡有关,SOD是目前发现的氧自由基的头号天敌,可降低细胞内氧自由基水平,减轻氧化损伤[15,16]。本实验结果显示,缺氧复氧后的心肌细胞中MDA合成水平升高,细胞内的SOD水平降低,细胞培养液中的LDH水平升高,说明成功构建了缺氧复氧氧化损伤模型,敲低HMGB1可以降低缺氧复氧心肌细胞合成MDA,提高SOD水平,减少LDH的释放,减少氧化损伤。
Caspase蛋白家族在通常情况下以没有活性的酶原方式存在于细胞内,在受到凋亡信号刺激后可被激活。激活途径有两种,一种是死亡受体途径,一种是线粒体途径,死亡受体途径主要是通过细胞之间的死亡配基之间的结合引起Caspase级联反应的激活,诱导细胞凋亡的发生,线粒体途径是以线粒体为核心激活细胞凋亡,诱导Bax的表达,激活Caspase级联反应,最终促进细胞凋亡发生[17,18]。Caspase-3和Caspase-9分别为Caspase凋亡反应的执行因子和起始因子,在缺氧复氧心肌细胞中过度激活[19,20]。本实验的结果显示,缺氧复氧可以通过Caspase-3、Caspase-9激活和促进Bax表达诱导心肌细胞凋亡,而敲低HMGB1可以通过降低Caspase-3、Caspase-9的活化水平和抑制Bax的表达减少细胞凋亡的发生。
综上,缺氧复氧后的心肌细胞中HMGB1合成和分泌水平升高,而敲低HMGB1可以减弱缺氧复氧诱导的心肌细胞氧化损伤,减少Caspase-3、Caspase-9、Bax介导的细胞凋亡的发生,对于HMGB1在原代心肌细胞和其他心肌细胞株中的作用仍然需要在后续实验中进行验证。本研究结果明确了HMGB1在缺氧复氧心肌细胞氧化损伤和细胞凋亡中的作用,缺氧复氧心肌损伤发病机制较为复杂,以后会继续探讨HMGB1在缺氧复氧心肌损伤炎症反应和钙离子超载中的作用。
