慢性肾脏病患者降脂药物的临床应用
2018-11-07陈祖姣柒春芳王文健
陈祖姣,柒春芳,王文健

王文健,医学博士,美国贝勒医学院博士后。广东省人民医院肾内科主任医师,博士生导师,党支部书记。兼广东省内科学会副主委、广东省肾脏病学会青委会副主委、广东欧美同学会常务理事、亚太医学生物免疫学会肾脏病学分会副主委、ASN、ISN会员。《中华肾脏病杂志》和《中国实用内科杂志》编委;Kidney Int.等种英文杂志审稿人。国家自然科学基金评审专家、国家科技专家库专家。中国医师协会首届 “全国百名住院医师心中的好老师”,“岭南名医”。
主持国家自然科学基金面上项目等6项。在Cell Metabolism、Kidney Int.等发表论文80篇,其中SCI收录30篇,累计IF 135,他引1 500余次;出版《IgA肾病》、《高级肾脏病学》等专著5部。获广东省科技进步奖3项、国家发明专利3项 。
研究方向:糖尿病肾病、脂质肾脏损伤、浆细胞病(AL、LCDD、HCDD、MGUS、MM) 肾损伤的规范化诊断与精准治疗。
2012年的流行病学统计表明,我国慢性肾脏病(Chronic kidney disease,CKD)的患病率为10.8%,患者人数约为1.2亿,其中1%发展为尿毒症,需维持性透析治疗,CKD的防治已成为重要的公共卫生问题[1-2]。心脑血管疾病(Cardio-cerebrovascular disease,CCD)是尿毒症患者死亡的首要原因,约占60%~70%[2],因此,积极规范地防治CKD患者的心脑血管并发症是临床需要重视的问题。
CKD患者的心脑血管危险因素极为复杂,包括高血压、钙磷代谢紊乱、贫血、营养不良、继发性甲状旁腺功能亢进、血脂紊乱等[3-4],而血脂异常在其中的作用特殊且经常被忽视。本文旨在呼吁临床医生重视CKD患者的血脂管理,正确规范地使用降脂药物,预防心脑血管疾病的发生,将重点阐述降脂药物的使用指针和注意事项。
1 CKD及其主要死亡原因
CKD指肾脏结构和功能的异常,持续时间超过3个月,并对健康造成影响[5]。CCD为CKD患者的重要并发症和首要死亡原因,其中心血管疾病(Cardiovascular disease,CVD)约占总死亡率的44%~51%[6]。同时,CKD患者肾小球滤过率水平与CVD风险呈负相关,3期和4期CKD患者的CVD死亡率分别为肾功能正常患者的2倍和3倍[7]。2014年,美国脂质协会建议将CKD 3B/4期患者纳入ASCVD(Arteriosclerotic cardiovascular disease,动脉粥样硬化性心血管疾病)高风险人群[8]。2016年,ESC/EAS血脂异常管理指南也将CKD患者列为心血管高危(3期CKD)或极高危(4~5期CKD或正在透析治疗中)患者[7]。而且CKD与CVD相互影响,互相促进。
2 CKD患者血脂异常特点及其危害
CKD患者血脂异常有其独特特点,不同阶段的血脂谱不尽相同。由于CKD患者普遍存在蛋白尿,肝脏脂质合成显著增加。在CKD早期,由于VLDL和CM的水解作用介导的脂蛋白脂肪酶活性受抑制所致TG升高显著。进展期HDL-C明显降低,且卵磷脂胆固醇酶转运蛋白减少,导致HDL成熟障碍,前β-HDL和富含TG的HDL增多而抗氧化活性降低。CKD患者肾脏清除率降低也导致血浆Lp(a)升高,且升高水平与肾小球滤过率呈反比[9]。CKD晚期,LDL的分解代谢受损和Apo-B修饰程度加深,TC、LDL-C水平升高,其亚类也转向小而致密的LDL颗粒[7,9]。
2.1 直接肾脏损伤 血脂异常可加速肾脏损伤的进程,在慢性肾脏病的发生、发展中均起重要作用。由于慢性炎症和氧化应激状态的存在,CKD患者血脂的毒性作用更为显著。
肾脏病理活检显示,肾小球疾病患者肾小球、系膜细胞及基质均可见脂蛋白沉积,且氧化脂类常见[10]。肾小球局部脂质积聚可以直接视为局灶节段性肾小球硬化的证据。在动物实验中,高脂饮食下的小鼠较正常饮食小鼠体重增加,血肌酐、尿白蛋白排泄增多,肾小球脂质积聚加重,系膜基质增生,足突广泛融合及基底膜增厚[11]。脂质肾脏损伤与脂质堆积诱导的溶酶体功能障碍、自噬受损、炎性和氧化应激反应有关[12]。
2.2 心血管危害 常见的心血管危险因素有血脂异常、高血压、糖尿病、吸烟、肥胖、年老等。也包括一些非传统的危险因素,如高尿酸血症、高同型半胱氨酸血症,甲状旁腺功能亢进、酸中毒和透析治疗本身,而这些因素也与CKD早期患者的血管损伤有关[13]。以上所有因素共同造成CKD患者的内皮功能紊乱、炎症反应、动脉粥样硬化及矿物质骨病等,从而导致心血管疾病的发生[14]。而CKD患者由于慢性炎症和氧化应激状态的存在,脂质对血管的毒性作用更早、更严重,也容易被其他因素如水、电解质代谢失衡和异常严重的钙盐异位钙化所掩盖。
3 CKD患者使用降脂药物指针
2016年DYSIS(Dyslipidaemia international study)报告收集了全球多个国家共57 885例患者他汀治疗的达标情况,中国患者达标率仅31.4%[15]。已有的多个指南明确提出了CKD患者使用降脂药物的指针。
3.1 CKD血脂管理指南[5](2013年KDIGO) 指南建议:① CKD 1~5期所有患者,只要年龄超过50岁,强烈建议使用降脂治疗。②对于年龄小于50岁的患者,只要合并糖尿病、未来10年心血管疾病的危险大于10%,和已知患有CVD的患者,建议使用降脂治疗。③所有肾移植患者,不论年龄、性别均建议使用降脂治疗。④对于已经透析的患者,根据患者的实际情况酌情使用:如一直在用的,继续使用;合并高脂血症的可以使用。
指南强调初测血脂谱是为了确诊高脂血症,并排除一些可治疗的继发性原因,如肾病综合征、糖尿病、肝病、利尿剂及雄激素等药物的使用。同时指出他汀治疗的临床获益与心血管风险下降程度(而不是LDL-C水平)呈正比,建议临床医生选择测量更能反映心血管风险的指标,如HDL-C、Apo-B、非HDL-C;并且从以下三方面决定是否采用药物治疗:心血管风险、心肌梗死后病死率和有证据证明药物治疗是有效的。
3.2 血脂异常管理和心血管疾病预防指南[16](2017年AACE/ACE) 指南推荐将LDL-C、HDL-C、非HDL-C、载脂蛋白、超敏C反应蛋白、脂蛋白相关磷脂酶A2、冠状动脉钙化测量、颈动脉内膜中层厚度等作为筛选实验来评估心血管风险。且不同危险分层的人群使用降脂药物的治疗目标值不同,见表1。
在EDA课堂教学中,笔者采用BOPPPS教学模式,设计了一套完整的课程实践内容。从教师的角度来看,BOPPPS教学模式与教育基本规律是相契合的。导入和学习目标将激发学生的学习兴趣;先测可以帮助教师掌握学习情况;参与式学习可以真正关注学生;后测帮助教师在课后指导和安排复习内容;总结帮助学生明确并掌握重要而困难的内容。课堂评价结果表明,BOPPPS在EDA的应用,能促进教与学的双向互动,学生的主动性有了很大提高。BOPPPS教学模式为中心的教学策略,可以提高学生的自我效能感,更系统地掌握知识,提高学生对EDA的兴趣。

表1 ASCVD危险分层及治疗目标值(mg/dl)
注:DM:糖尿病,ACS:急性冠脉综合征,HeFH:杂合子型家族性高胆固醇血症。危险因素包括:高 LDL-C、多囊卵巢综合征、吸烟、高血压(血压≥140/90 mmHg或正在药物治疗),低HDL-C (<40 mg/dl),冠状动脉疾病家族史(一级亲属发病年龄:男性<55岁,女性<65岁)、CKD3/4期、冠状动脉钙化的证据及年龄(男性≥45岁,女性≥55岁)。若有高HDL-C,则减去1个危险因素。
3.3 中国成人血脂异常防治指南修订版[17](2016年) 对不同危险分层的人群使用降脂药物的治疗目标值大致相同,但指出如果患者LDL-C基线值较高,药物标准治疗3个月后仍未达到目标值,可考虑将LDL-C至少降低50%作为替代目标;部分极高危患者LDL-C已在目标值以内,可从基线值降低30%左右。
3.4 血脂异常管理指南[7](2016年ESC/EAS) 采用系统性冠状动脉风险评估模型(Systemic coronary risk estimation,SCORE)评估总体心血管风险,强调基于总体心血管风险和LDL-C水平决定干预策略:生活方式干预和/或药物干预,见表2。并将LDL-C用作一级脂质分析指标,视情况选择TC、HDL-C、非HDL-C、Apo-B、TG等指标;推荐LDL-C为预防心血管病的一级治疗靶点,非HDL-C、Apo-B为二级靶点。
以上指南的治疗靶目标、适应证及推荐使用药物见表3,但值得注意的是,2013KDIGO指出,在成人CKD患者合并高三酰甘油血症的情况下,使用贝特类并不能预防胰腺炎的发生或降低心血管风险。同时,鉴于烟酸类面色潮红、高血糖等毒性及在晚期CKD患者的使用尚未得到很好的研究,不推荐用于治疗高三酰甘油血症[5]。
4 CKD患者降脂治疗方案
4.1 非药物治疗 血脂异常与生活方式密切相关,无论是否选择药物降脂治疗,都应坚持改善生活方式。常见生活方式改变包括饮食调整、增加运动量、减重、限制饮酒、戒烟、控制高血糖等[5,17]。建议限制胆固醇、饱和脂肪酸和反式脂肪的摄入,胆固醇摄入<300 mg/d,ASCVD等高危患者摄入脂肪不超过总能量的20%~30%,且优先选择富含n-3多不饱和脂肪酸的食物(如深海鱼、鱼油、植物油)[5,17]。建议使用富含膳食纤维和低生糖指数的碳水化合物替代饱和脂肪酸,每日全部碳水化合物摄入占总能量的50%~60%,以薯类和全谷物为主[17]。可适度使用富含植物甾醇、红曲米(其生物活性成分为莫纳可林,可抑制羟甲戊二酰辅酶A还原酶活性)的膳食补充剂和功能食品[7]。建议保持每周5~7 d、每次30 min中等强度身体运动,每天至少消耗200 kCal,可选择快步走、骑固定自行车、水中有氧运动、修剪草坪、体育运动等方式[16-17]。 维持体重在正常水平(BMI 20.0~23.9 kg/m2)[17]。在保证TG水平不升高的前提下,可适度饮酒(男性:20 g/d,女性:10 g/d)。戒烟对降低总体心血管风险,尤其对HDL-C有明确益处,值得重视[7]。虽然以上措施对降低血清TG影响甚微,但其不会造成身体损害,而可能改善整体健康状态[5]。
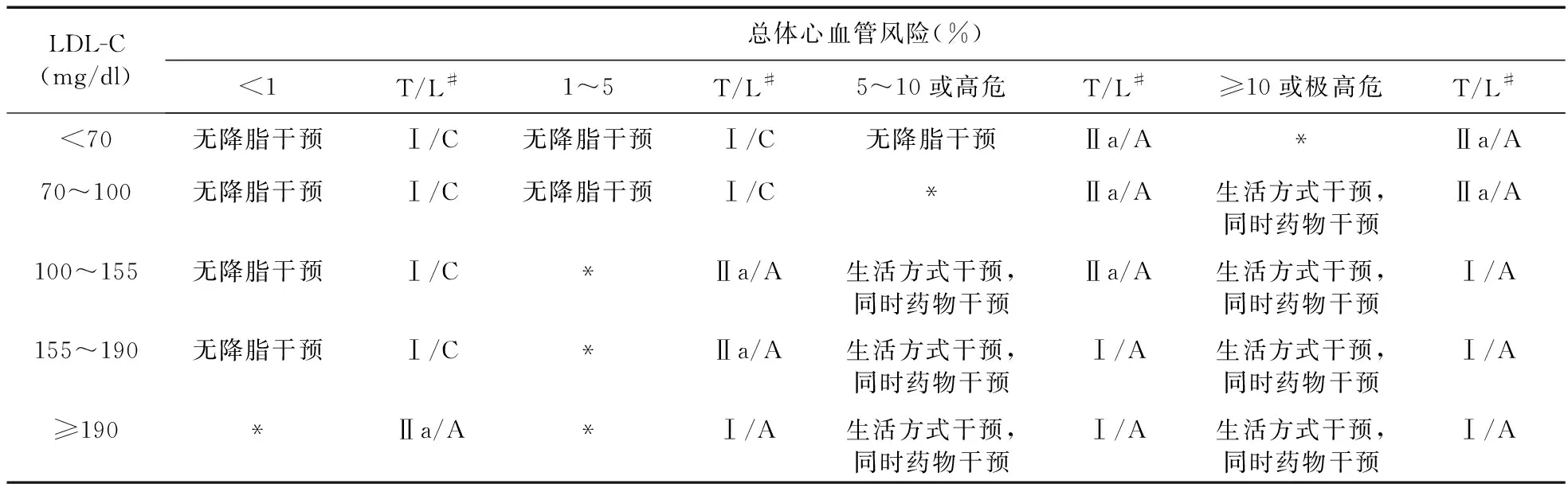
表2 基于总体心血管风险和LDL-C水平的干预策略
注:*生活方式干预,如不能控制,考虑药物干预;#类别/水平
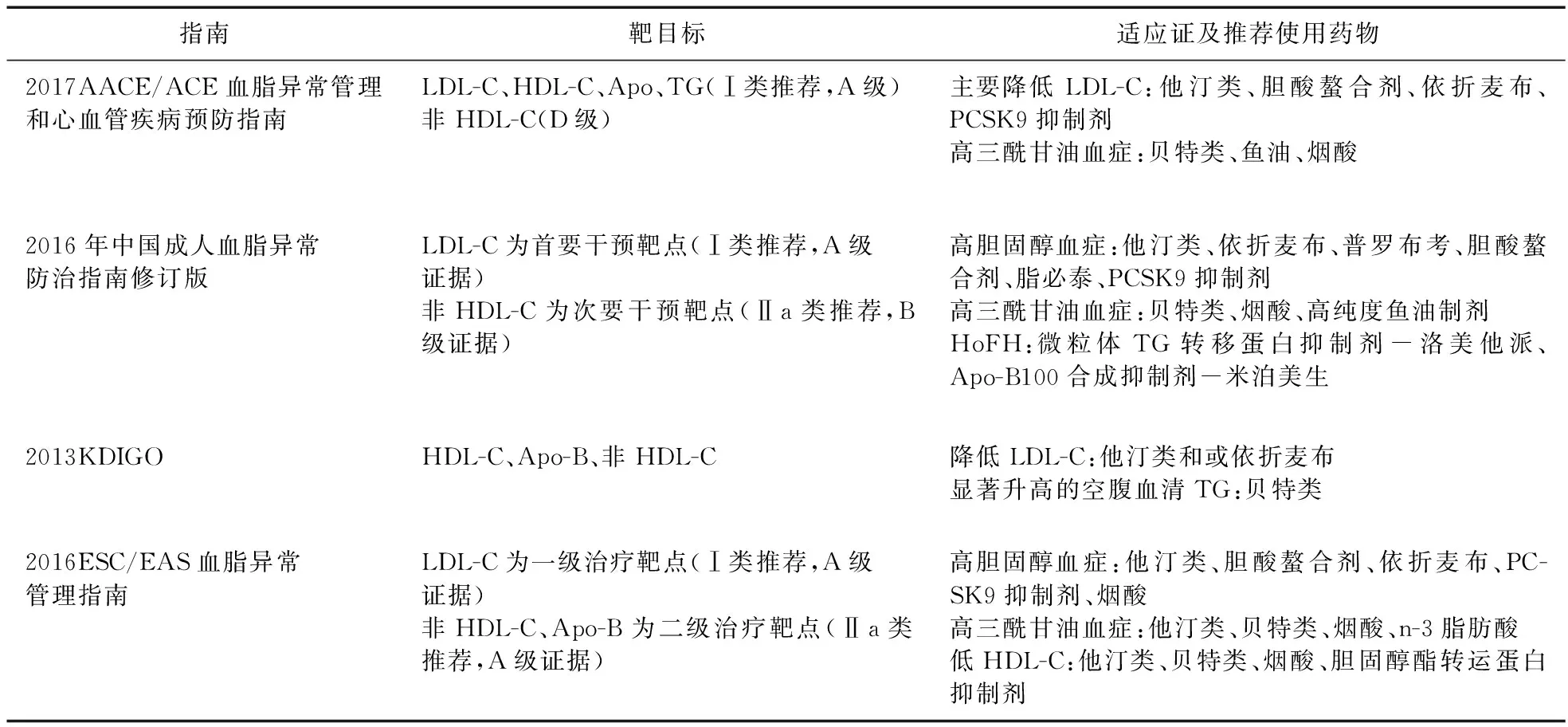
表3 指南治疗靶目标及适应证、推荐使用药物
4.2 药物治疗
4.2.1 药物治疗 以起始中等强度他汀类为基石,可以获得最大程度的获益-风险比,再根据疗效和耐受情况调整剂量,不达标可联合用药[17]。如果患者处于高危或极高危水平,也可降至治疗目标值以下[16]。无论单用还是与其他调脂药合用,均可改善心血管预后[17]。
4.2.2 贝特类 适用于严重的高三酰甘油血症(TG>500 mg/dl),当TG≥200 mg/dl且HDL-C<40 mg/dl时,也可改善心血管疾病的结局。
4.2.3 PCSK9抑制剂 PCSK 9抑制剂用于他汀治疗达最大耐受剂量后仍不能达标时,一般不单药治疗[16]。2017年美国脂质协会专家小组也指出,PCSK9抑制剂单克隆抗体可减小动脉瘤体积、诱导动脉瘤退化,在他汀治疗达到最大耐受剂量基础上合用,可最大程度地改善动脉粥样硬化性心脏病的结局。尤其适用于具有额外的ASCVD危险因素、在他汀治疗达到最大耐受剂量后合用或不合用依折麦布的基础上仍不达标的稳定期ASCVD患者[18]。
4.2.4 普罗布考 具有强大的抗氧化作用,可抑制LDL的氧化并能减少黄色瘤,未来可能是他汀或其他降脂药物预防冠心病患者动脉粥样硬化性事件的有效补充[19]。一般用于高胆固醇血症,特别是纯合子型家族性高胆固醇血症和黄色瘤患者[17]。
4.2.5 其他常用药物 胆酸螯合剂如考来烯胺、考来替泊等主要降低胆固醇,与他汀联合使用可明显提高疗效;烟酸,即维生素B3,属人体必需维生素,主要降低TG,大剂量时,也可降低TC、LDL-C和升高HDL-C。
4.2.6 联合用药 他汀与贝特联合应用时,能更有效地降低LDL-C、TG水平和升高HDL-C水平,但由于代谢途径相似,均有潜在损伤肝功能和发生肌病的可能,安全性问题值得重视。他汀与依折麦布联合应用时作用机制不同,分别影响胆固醇的合成和吸收,使LDL-C在他汀治疗的基础上再下降18%,同时不增加他汀不良反应。他汀与PCSK9抑制剂联合应用时,由于作用机制不同,较任何单一药物治疗能更大程度地降低LDL-C水平,已成为欧美国家治疗严重血脂异常尤其是家族性高胆固醇血症的常用联合方式[17]。他汀与胆酸螯合剂合用可能有助于LDL-C达标,一种他汀加胆酸螯合剂可使LDL-C降低10%~20%。家族性高胆固醇血症或对他汀不耐受的高风险患者可以考虑其他药物的联合应用,如依折麦布与胆酸螯合剂同时使用可进一步降低LDL-C水平[7]。
5 常用降脂药物种类及其不良反应
5.1 他汀类药物 他汀类药物竞争性抑制羟甲戊二酰辅酶A还原酶活性,减少肝内胆固醇的合成,主要是降低LDL-C[7]。最常见的不良反应发生在肌肉骨骼系统,除常见的肌痛外,严重的肌病或横纹肌溶解症少见。除此之外,还有胃肠道系统:腹胀、上腹痛、胃炎、腹泻、便秘、恶心呕吐、吞咽困难等;中枢神经系统:头疼、头晕、眼花、周围神经病、睡眠障碍、口齿不清、记忆缺陷等;营养与代谢系统:食欲增加、体重上升;其他,如咳嗽、皮肤瘙痒、肌酸激酶及肝酶升高、新发糖尿病等[7,20]。但他汀治疗对心血管疾病的益处大于其使用风险,有他汀治疗适应证的糖尿病高危人群仍需坚持治疗[17]。此外,瑞舒伐他汀在亚洲人群中血药浓度上升程度高于其他种族,需格外注意使用剂量[16]。同时,与他汀类药物相关不良反应的发生风险可因下列因素而增大:年龄>80岁、女性、亚洲种族、低BMI、身体虚弱、肌痛/关节痛/肌腱痛发病史、肌酸激酶升高史、肌病家族史、神经肌肉病、严重肾病、急性或失代偿性肝病、高血压、糖尿病、基因多态性等内源性因素,大剂量他汀、酗酒、外科手术、超额运动量等外源性因素[21]。
5.2 贝特类 贝特类与过氧化物酶增殖体激活受体-a(PPAR-a)相互作用,调节基因表达,对降低TG及富含TG的脂蛋白残粒有良好效果,耐受性良好,不良反应轻,常见肌病、肝酶增高和胆石病,胃肠道不适、皮疹少见[7],可升高纤维蛋白原、同型半胱氨酸、血肌酐水平[16]。
5.3 依折麦布 依折麦布在肠道中通过抑制胆固醇吸收(通过与尼曼-匹克C1样蛋白相互作用),降低运送到肝脏的胆固醇数量。最常见的不良反应是肝酶中度升高和肌痛,罕见肌病或横纹肌溶解症[7,16]。
5.4 普罗布考 普罗布考通过掺入LDL颗粒核心,影响代谢,使其易通过非受体途径清除,常见胃肠道反应、头疼、头晕、失眠、皮疹等不良反应,罕见QT间期延长。室性心律失常、QT间期延长、血钾过低者为禁忌证[17]。
5.5 PCSK9抑制剂 PCSK 9抑制制抑制PCSK9与LDLR结合,提高LDLR的表达,从而降低循环中LDL-C水平。经皮下注射给药,不影响口服药物的药代动力学或药效动力学,最常见注射部位的瘙痒和流感样症状,有报道称可影响神经识别功能,结果有待监测[7]。其余不良反应有:Alirocumab可发生鼻咽炎、尿路感染、腹泻、支气管炎和肌痛[16]; Evolocumab可发生鼻咽炎、上呼吸道感染、头疼、关节痛、肢体痛、疲劳[16,22]。常见的降脂药物与不良反应总结见表4。

表4 常见降脂药物及其不良反应
6 CKD患者他汀类降脂药物产生不良反应的机制
6.1 他汀类药物与蛋白尿 瑞舒伐他汀80 mg/d的剂量可造成12%的蛋白尿和偶尔的血尿,但10 mg/d的剂量治疗12周对总尿蛋白、尿白蛋白及免疫球蛋白G的排泄无影响[23]。另一个对9项实验、包含7 952例患者使用他汀后出现蛋白尿情况的Meta分析显示,相较阿托伐他汀,瑞舒伐他汀发生新发蛋白尿的风险明显升高(OR=0.656、95%CI:0.440~0.997),但排除瑞舒伐他汀高剂量使用(40 mg/d)的情况后这种差异消除[24]。可见他汀诱发蛋白尿的风险与他汀类型和剂量均相关。同时这类蛋白尿属肾小管性,由肾小管重吸收减少所致,而不是肾小球功能障碍[7]。具体机制可能是他汀抑制人肾近端小管细胞由受体介导的胞吞作用[25]。而Sidaway等也证明这种抑制作用与异戊烯化减少,从而降低1个或多个GTP-结合蛋白的功能有关,而GTP-结合蛋白正是胞吞过程中所需要的[26]。
6.2 他汀类药物与急性肾损伤(Acute kidney injury,AKI) 2013年,美国一项纳入超过6百万人次的回顾性队列研究中,发现使用他汀药物的患者AKI的累积风险在商业保险和国家医疗保险中分别为0.5%、2.0%,在校正后的Cox比例风险模型中,高效他汀发生AKI的风险比低效他汀高(商业保险∶风险比=1.42,95%CI:1.28~1.58;国家医疗保险:风险比=1.24,95%CI:1.15~1.35)[27]。2014年,意大利一项基于人群的巢式病例对照研究纳入了2007-2010年首次接受他汀治疗的316 449例患者,共458例在治疗6个月内发生AKI,且高效他汀治疗相较低效他汀治疗开始治疗6个月后因AKI入院的风险增加(校正OR=1.54,95%CI:1.25~1.91),可能原因有:①高效他汀治疗发生横纹肌溶解的风险也增高;②他汀诱导的辅酶Q10活性抑制,并阻碍辅酶Q10生成[28]。
6.3 他汀类药物与新发糖尿病 2015年,Cederberg等在一项基于人群的METSIM(Metabolic syndrome in men)队列研究中纳入了8 749例无糖尿病的45~73岁男性患者,其中2 142例进行他汀治疗,随访5.9年后,共625例被诊断为2型糖尿病。在调整年龄、BMI、腰围、体力运动、吸烟、饮酒、糖尿病家族史及β受体阻滞剂和利尿剂使用等混杂因素后,服用他汀使糖尿病发生风险增加了46%,且呈剂量依赖性。同时,年龄大、肥胖、运动量少、低HDL-C及高水平的TG、FPG、2hPG和HbA1c更易发展为糖尿病,提示他汀诱发的糖尿病可能与胰岛素分泌缺陷和胰岛素抵抗有关[29]。临床应重点关注此类患者的他汀使用情况。2016年,一项纳入了106 424例20~63岁无糖尿病病史患者的回顾性队列研究中,也发现服用他汀类药物的患者发生糖尿病的风险大于未服用他汀的患者,且在不同他汀药物类型中存在差异:洛伐他汀、阿托伐他汀、辛伐他汀和氟伐他汀发生糖尿病的风险较高,普伐他汀和瑞舒伐他汀的风险最低。具体机制尚不明确,目前认为,他汀通过影响血糖控制、升高空腹血糖水平和胰岛素抵抗导致糖尿病发生,且不同类型和剂量的他汀致糖尿病倾向程度不同[30]。建议临床医生实行他汀个体化治疗。
6.4 他汀类药物与肿瘤 一直以来,关于他汀类药物是否增加新发肿瘤的发生率存在争议,但近年来,他汀被证实可以改善癌症相关的死亡结局或预后。在一项研究结直肠癌患者用药情况的调查中,发现他汀治疗与全因死亡率或癌症死亡率降低密切相关[31]。Fujiwara等[32]报道,他汀通过抑制Ras异戊烯化和提高Bim、p27表达来诱导人造血肿瘤细胞凋亡。Yang等[33]发现,氟伐他汀通过提高p53表达诱导自噬,从而达到预防肺腺癌骨转移的目的。目前,他汀与新发肿瘤的关系尚不明确,需要进行更多的临床研究和长时间的观察来进一步证实。
7 CKD患者使用降脂药物的注意事项
7.1 CKD患者降脂药物的服药时间 他汀可在任何时间段每天服用1次,晚上服用LDL-C降低幅度稍有增多,发生不良反应时,可采用隔日服用、减少剂量或换用另一种他汀等方法。常用的贝特类药物有:非诺贝特片0.1 g/次,3次/d;微粒化非诺贝特0.2 g/次,1次/d;吉非贝特0.6 g/次,2次/d;苯扎贝特0.2 g/次,3次/d[17]。依折麦布的推荐剂量为10 mg/d,在早晨或傍晚,空腹或餐后服用均可[7]。PCSK9抑制剂单克隆抗体经皮下注射给药,通常隔1周注射1次,剂量达到150 mg[7]。普罗布考常用剂量为0.5 g/次,2次/d。烟酸有普通和缓释2种剂型,以缓释剂型更常用。常用剂量为1~2 g/次,1次/d,建议从小剂量开始,睡前服用,4周后逐渐增加到最大常用剂量[17]。
7.2 CKD患者降脂药物的剂量调整 在CKD人群中,高剂量他汀的确能更好地发挥降脂功效,但是与药物相关的不良事件发生率也大大升高。这可能与CKD患者肾脏排泄功能下降、联合用药及伴随疾病高发有关[5]。部分常见降脂药物的剂量调整[34]见表5。

表5 CKD患者降脂药物的剂量调整(mg/d)
7.3 降脂药物与其他用药间的相互作用 除了普伐他汀、瑞舒伐他汀和匹伐他汀外,大部分他汀类药物主要通过细胞色素P450酶系(CYPs)经肝脏代谢,通过相同酶系统代谢的其他药物可与他汀类发生药物相互作用[7]。通过CYP3A4代谢可能与他汀类药物相互作用导致肌病和横纹肌溶解风险增高的常见药物见表6。例如,联合应用氨氯地平和他汀在同时患高血压和高血脂患者中十分常见。FDA规定,为降低发生肌病的风险,联用氨氯地平时,辛伐他汀的最大剂量不超过20 mg,但阿托伐他汀并无此规定。Khan等[35]报道,1例老年患者联合应用阿托伐他汀和氨氯地平后,肌酸激酶显著增高,有发生横纹肌溶解的风险。这与阿托伐他汀与氨氯地平联用时竞争结合CYP3A4,互相抑制在肝脏的代谢,造成药物累积、血药浓度上升、产生肌毒性有关。提示临床在联合用药时,应严密监测、调整剂量。
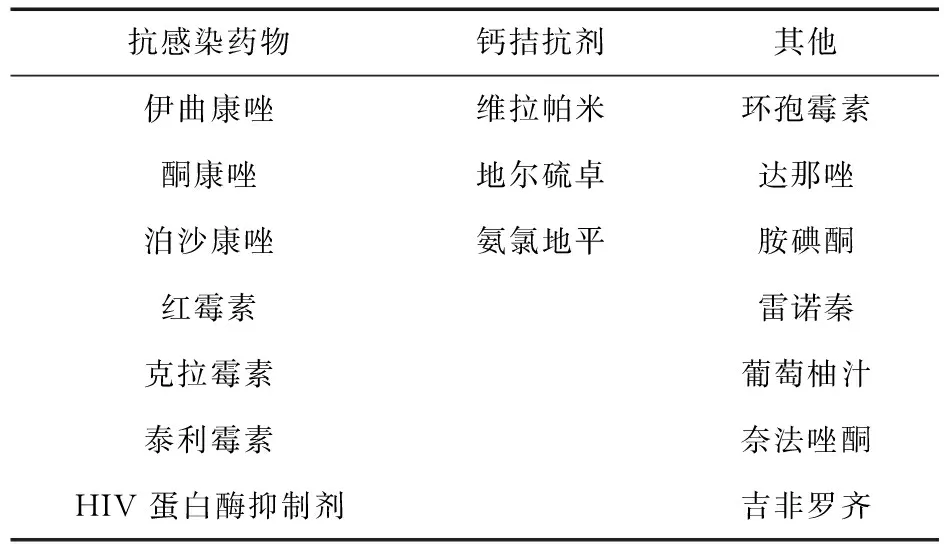
表6 通过CYP3A4代谢与他汀类相互作用的药物
贝特类药物和他汀类联合应用时,发生药物相互作用的风险因类型而异,吉非罗齐通过葡萄糖醛酸化通路抑制他汀类药物的代谢,导致其血浆浓度显著升高,发生肌病的风险升高,而其他贝特类药物如非诺贝特、苯扎贝特联用时,风险大幅下降[7];与口服抗凝药联合应用时应加强其抗凝效果,注意调整剂量[16]。
