高铁酸钾稳定剂对HMF氧化产生FDCA的影响研究
2018-11-07,,
,,
(浙江理工大学材料与纺织学院,杭州 310018)
0 引 言
随着石油资源的逐渐枯竭,传统的石油基聚酯工业面临巨大挑战。目前,鉴于地球上的生物质具有产量大、分布广泛且可再生等特点,以丰富的生物质为基础开展可再生的生物质基聚酯的研究成为重要的解决途径之一。近年来,一种重要的生物质基平台化合物——2,5-呋喃二甲酸(2,5-Furandicarboxylic acid,FDCA),由于其具有与传统石油基聚酯单体——对苯二甲酸相似的结构,被认为是一种非常有前景的生物基聚酯单体,作为对苯二甲酸的替代物用于聚酯的生产[1-4]。
FDCA主要由木质生物质基原料5-羟甲基糠醛(5-Hydroxymethylfurfural,HMF)催化氧化而制得。目前,关于HMF催化氧化产生FDCA的研究多以金[5-7]、铂[8-11]、钯[12-13]、钌[14]和钴[15]等贵金属催化剂在加压条件下催化氧化为主;其中,Casanova等[5]将Au纳米粒子负载于CeO2、TiO2、Fe2O3和活性炭等载体上形成催化剂,在碱性水溶液中,当反应温度为130 ℃,空气压力为1 MPa,NaOH/HMF的摩尔比为4时,FDCA的得率较高,且Au/CeO2催化剂具有更高的催化活性和较好的选择性,FDCA的摩尔得率可达99%。而Gorbanev等[14]分别以Pt/C和Pt/TiO2为催化剂,在23 ℃的反应温度及一定的氧压下反应6 h,可分别得到79%和71%的FDCA,同时以Ru(OH)x/CeO2为催化剂进行HMF的催化氧化研究,结果表明,当反应温度为140 ℃、反应时间为26 h时,HMF可被完全转化,FDCA的得率达到95%。尽管这些贵金属催化剂在HMF氧化产生FDCA的过程中表现出较高的催化活性,但由于反应多在高温、高压及加氧的条件下进行,且反应时间较长,使得FDCA的生产成本大大增加,不利于后期的产业化应用[16]。过渡金属类催化剂也可将HMF氧化而产生FDCA,Partenheimer等[17]以分子氧和金属/溴为催化剂进行了HMF的催化氧化研究,在较优的反应条件下,FDCA的得率可达到60%。而陈天明等[18]、Toshinari等[19]以高锰酸钾为氧化剂,探讨HMF的可控氧化制备FDCA,当反应在碱性、室温条件下进行,在较短的时间(10 min)内即可得到70%以上的FDCA。尽管该反应具有反应时间短、条件温和等优点,但在反应过程中会产生二氧化锰,从而对环境产生一定程度的污染,不符合目前所倡导的绿色化工理念[20]。
本课题组前期以环境友好的高铁酸钾为氧化剂,通过构建高铁酸钾/NaOH的碱性水溶液体系,在25 ℃温度下反应10 min时,FDCA的得率达到48.3%[16]。已有报道显示,缓冲溶液及一些金属离子的存在有利于提高高铁酸钾的稳定性[21-22]。为进一步提高FDCA的得率,本文主要研究NaOH-K2HPO4缓冲溶液及金属化合物等高铁酸钾稳定剂对高铁酸钾氧化HMF产生FDCA的影响,以期能较高得率地得到FDCA,为生物质基聚酯单体的绿色、经济和高效制备打下良好的基础。
1 实验部分
1.1 实验试剂
NaOH(天津市永大化学试剂有限公司,分析纯),K2HPO4(科密欧化学试剂有限公司,分析纯),HCl(浙江三营化学试剂有限公司,分析纯,38%),NaCl(杭州高晶精细化工有限公司,分析纯),KCl(成都市联合化工试剂研究所,分析纯),CaCl2(天津市科密欧化学试剂有限公司,分析纯),Mg(OH)2(阿拉丁试剂有限公司,分析纯),Al(OH)3(阿拉丁试剂有限公司,分析纯),MnO2(阿拉丁试剂有限公司,分析纯),Fe2O3(科密欧化学试剂有限公司,分析纯),Fe(OH)3(天津致远化学试剂有限公司,分析纯),CuO(阿拉丁试剂有限公司,分析纯),HMF(80%)为山东省滕州市紫藤香料有限公司的产品,HMF标准品(北京百灵威科技有限公司,98%),FDCA标准品(北京百灵威科技有限公司,97%),高铁酸钾为实验室自制,制备方法见文献[23]。
1.2 氧化实验及产物得率计算
称取0.16 g的HMF固体,用10 mL的NaOH-K2HPO4缓冲溶液溶解后置于反应容器中,恒温搅拌,并分别加入一定量的助催化剂(NaCl、KCl、CaCl2、Mg(OH)2或Al(OH)3等金属化合物),使助催化剂在反应体系的浓度达到0.5 mmol/L,并缓慢加入3.16 g自制的高铁酸钾氧化剂,反应15 min后,将反应溶液过滤洗涤后,通过浓盐酸对所得到的滤液进行酸化处理(pH<2),搅拌10 min得到大量白色沉淀,样品经过滤及洗涤处理后,将得到固体置于50 ℃下真空干燥处理24 h后称重,以计算产物得率,其计算如式(1):
(1)
其中:Y为FDCA的得率,%;m1为反应体系实际所得FDCA的质量,g;m0为加入的HMF完全转化时FDCA的理论质量,g。
1.3 样品表征
采用Bruker Vertex 70傅里叶红外光谱分析仪分析FDCA标准品及氧化产品的官能团,采用德国ADVANCED 400S型核磁共振光谱进行1H NMR和13C NMR分析。
2 结果与讨论
2.1 NaOH-K2HPO4缓冲液对氧化反应的影响
NaOH-K2HPO4缓冲溶液有助于提高高铁酸钾的氧化能力,且缓冲体系中NaOH用量和K2HPO4用量对氧化效果有较大的影响[21]。基于此,首先控制反应总体积为10 mL,HMF的用量为0.1 mol/L,高铁酸钾用量为1.5 mol/L,K2HPO4用量为1.6 mol/L,反应时间为15 min,反应温度为25 ℃,分析NaOH-K2HPO4缓冲溶液中NaOH用量对高铁酸钾氧化HMF制备FDCA效果的影响,实验结果如图1所示。从图1中可以看出,当体系中NaOH浓度为0.4 mol/L以下时,反应体系中几乎检测不到FDCA的生成;而随着NaOH用量的增加,FDCA的产率逐渐升高,当体系中NaOH浓度为1.6 mol/L时,FDCA有最高产率66.1%。其主要原因是因为高铁酸钾在非强碱性水溶液中不稳定,易自身发生氧化还原反应,释放出氧气,从而无法使HMF氧化为FDCA。而随着体系中NaOH用量的增加,高铁酸钾的稳定性逐渐增加,从而提高了氧化效果,使得FDCA的得率逐渐增加[24]。然而,当体系中NaOH浓度超过1.6 mol/L时,会使缓冲液体系中K2HPO4的稳定性降低,并最终影响反应的正常进行。

图1 FDCA得率与NaOH浓度的关系曲线
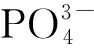

图2 FDCA得率与K2HPO4用量的关系曲线
2.2 助催化剂金属离子对氧化反应的影响
金属化合物有助于提高高铁酸钾的稳定性,从而有望提高高铁酸钾氧化HMF时FDCA的得率[22]。基于此,本文分别分析了NaCl、KCl、CaCl2、Mg(OH)2、Al(OH)3、MnO2、CuO、Fe2O3及Fe(OH)3等金属化合物对反应的影响。研究过程中,反应总体积控制在10 mL,HMF的用量控制在0.1 mol/L,高铁酸钾的用量控制在1.5 mol/L,NaOH的浓度控制在1.6 mol/L,K2HPO4的浓度控制在0.4 mol/L,各组助催化离子浓度控制在0.5 mmol/L,反应时间为15 min,反应温度为25 ℃,实验结果如图3所示。图3显示,NaCl、KCl、CaCl2、Mg(OH)2和Al(OH)3等金属化合物对高铁酸钾催化氧化HMF转化为FDCA有明显的抑制作用,当上述金属化合物在体系中的浓度0.5 mmol/L时,FDCA的得率从对照样品的82.4%分别降低到67.2%、60.5%、65.3%、68.6%和59.6%,降幅分别达到18.4%、26.6%、20.8%、16.7%和27.7%;而CuO和MnO2两种金属化合物对高铁酸钾氧化HMF转化为FDCA有一定的抑制作用,当CuO和MnO2的浓度为0.5 mmol/L时,FDCA的得率从对照样品的82.4%分别下降到74.1%和79.2%,降幅分别达到10.1%和3.9%;而加入Fe2O3和Fe(OH)3两种化合物可在一定程度上提高FDCA的得率。从图3中可以看出:当Fe2O3和Fe(OH)3的浓度为0.5 mmol/L时,FDCA的得率从对照样品的82.4%分别增加到85.7%和86.1%,增幅分别达到4.0%和4.5%。

图3 FDCA得率与助氧化金属离子的关系
基于Fe(OH)3对高铁酸钾氧化HMF产生FDCA有较好的助催化效果[22]。在控制反应总体积控制在10 mL,HMF的用量控制在0.1 mol/L,高铁酸钾的用量控制在1.5 mol/L,NaOH的浓度控制在1.6 mol/L,K2HPO4的浓度控制在0.4 mol/L,反应时间为15 min,反应温度为25 ℃时,进一步研究Fe(OH)3用量对FDCA得率的影响,结果如图4所示。从图4中可以看出,随着体系中Fe(OH)3用量的增加,FDCA得率呈现先增加后下降的趋势;未加入Fe(OH)3时,FDCA的得率为82.4%,随着Fe(OH)3用量的增加,FDCA的得率逐渐上升,当Fe(OH)3的加入量为1 mmol/L的时,FDCA的得率达到最大,为91.7%。进一步增加Fe(OH)3的用量,FDCA的产率反而下降,其原因可能过多的Fe(OH)3的加入时,由于其吸附絮凝作用,会在一定程度上影响HMF的反应及FDCA的洗出,从而导致FDCA的得率出现下降[25]。

图4 FDCA得率与Fe(OH)3浓度的关系曲线
2.3 红外光谱分析
本文通过红外光谱初步确定氧化所得产品的结构,并与FDCA标准样品的红外谱图进行了对比。测试方法为KBr压片法,所得到的红外吸收光谱如图5所示。由图5可知,本文所制取的产物的特征峰与FDCA标准样品高度重合,产物具有明显的呋喃环结构峰和羧基振动峰,其中:波数为3151 cm-1和3124 cm-1的特征峰为呋喃环ν=C-H的伸缩振动峰;962、854 cm-1和762 cm-1峰位为呋喃环ν=C-H面外弯曲振动特征吸收峰;1188 cm-1和1041 cm-1处为呋喃环ν=C-H的面内弯曲振动特征吸收峰;1572 cm-1和1523 cm-1处的特征吸收峰为呋喃环上νC=C的伸缩振动峰;1275 cm-1和1165 cm-1处为呋喃环νC-O的不对称伸缩振动峰。以上数据表明样品中存在呋喃环结构。另外,3433、1700、1423 cm-1和1228 cm-1峰位为羧基的特征吸收峰说明样品结构中存在羧基,其中:羧酸上νO-H的伸缩振动特征吸收峰出现在3433 cm-1处,νC=O的伸缩振动特征吸收峰出现在1700 cm-1,νC-O的伸缩振动特征吸收峰出现在1423 cm-1,而νO-H的面内弯曲振动特征吸收峰出现在1228 cm-1处。因此,本文所制得的产物红外吸收光谱相对于FDCA标准产品,基本没有杂峰出现,说明实验副产物较少,样品具有较高纯度,该结论与本课题组早期所得结论一致[16,23]。

图5 FDCA标准品和氧化产物的红外吸收谱图
2.4 产物的核磁共振谱分析
对制得FDCA产物用核磁共振波谱仪进一步的确定其分子结构,并与FDCA标准样品对比。其中,内标物为四甲基硅烷(TMS),溶剂为氘代二甲基亚砜,所得结果见图6。从图6(a)可以看出,产物具有明显的FDCA质子共振吸收峰,其中:δ=7.29的单峰是呋喃环=C-H的质子共振特征峰;δ=9.72的单峰是FDCA羧基上的质子共振特征峰;从图6(b)的13C NMR谱图可以看出,δ=147.47和δ=118.76的峰是呋喃环季碳和叔碳的共振吸收峰;δ=159.35处的单峰是FDCA羧基碳的特征吸收峰。从核磁共振谱图中可以看出,本文所得产物为FDCA。另外,从氧化产物和标准品的核磁共振谱图对比中还可以看出,本文制取样品没有其他共振峰出现,表明所得样品具有较高纯度,该结论与本课题组早期所得结论一致[16,23]。

图6 FDCA标准样品和氧化产物的核磁共振吸收谱图
3 结 论
论文主要研究了高铁酸钾氧化HMF制备FDCA过程中NaOH用量、K2HPO4用量和助催化剂金属离子等因素对FDCA得率的影响,并通过红外及核磁共振等表征手段对所得FDCA产品进行了结构表征,得到如下结论:
a) 在HMF的碱性氧化体系中,添加适量的K2HPO4的加入能提高高铁酸钾的稳定性,从而最终提高反应产物的得率,其中当反应溶液体积为10 mL,HMF和高铁酸钾的浓度分别为0.1 mol/L和1.5 mol/L,NaOH的浓度为1.6 mol/L,反应时间为15 min,反应温度为25 ℃时,反应体系中加入0.4 mol/L的K2HPO4时,FDCA的得率可从未加K2HPO4时的57.8%明显增加到82.4%。
b) Fe2O3和Fe(OH)3两种金属化合物能明显提高高铁酸钾的催化氧化效果,且Fe(OH)3表现出最佳的助催化氧化效果,当控制反应总体积控制在10 mL,HMF的用量控制在0.1 mol/L,高铁酸钾的用量控制在1.5 mol/L,NaOH的浓度控制在1.6 mol/L,K2HPO4的浓度控制在0.4 mol/L,反应时间为15 min,反应温度为25 ℃时,反应体系中加入1 mmol/L的Fe(OH)3可使FDCA的得率由82.4%提高到91.7%。
c) 红外光谱及核磁共振分析结果表明,实验所得氧化产品具有典型的FDCA红外及核磁吸收峰,表明本文所用方法可较高得率的制得FDCA产品,从而为FDCA的制备提供一条新的途径。
