多肽pPRDX5tide对心肌低氧损伤保护作用的研究
2018-11-07余学钊
余学钊,汪 洋,叶 琦,陶 瑜
缺血性心脏病是由于冠状动脉循环改变引起冠状动脉血流和心肌需求之间不平衡而导致的心肌损害,其中最常见的原因为冠状动脉粥样硬化引起的冠状动脉狭窄和闭塞,约占缺血性心脏病的90%左右。冠心病多发生于40岁以上,其患病率及病死率均随年龄而上升[1];我国人口基数大,正面临人口老龄化的严峻形势,近年来冠心病的发病人数逐年增多,给社会经济和公共卫生系统都带来了极大负担[2]。
多肽是指含少量氨基酸的小分子蛋白,近年来的研究已表明多肽在多种生理和病理过程中发挥着重要作用,但多肽在缺血性心脏病中的研究尚少[3-4]。之前的研究对低氧培养的新生大鼠心肌细胞与常氧培养的新生大鼠心肌细胞进行串联质谱标记法(TMT)检测,筛选出一批显著差异表达的多肽[5]。通过生物信息学对其功能聚类分析,从中挑选出表达明显上调的多肽pPRDX5tide作为研究对象,探讨其在缺血性心脏病中的可能作用。以大鼠心肌细胞H9c2为研究对象,通过两种低氧应激模型:① 低氧袋诱导的无氧环境;② 在培养上清液中加入CoCl2诱导细胞低氧损伤[6-7]。分别检测心肌损伤相关指标,评估多肽对心肌低氧的保护作用。该研究拟检测pPRDX5tide在H9c2细胞不同低氧损伤模型中的作用,探究其在缺血性心脏病中的作用。
1 材料与方法
1.1材料
1.1.1主要试剂 DMEM(批号:8117278)、无糖DMEM(批号:8117165)、PBS(批号:311010035)、trypsin胰酶(批号:1760553)、胎牛血清(FBS,批号:AC10248326)、P/S青霉素/链霉素(批号:1864874)购自美国Gibco公司;AnaeroPack(批号:7097ZJ-3)购自日本Mitsubishi Gas Chemical公司;CoCl2(批号:2016.04.29 )购自天津科密欧公司;乳酸脱氢酶(LDH)细胞毒性检测试剂盒(批号:C0017-5)、台盼蓝染色试剂盒(批号:S0033)、活性氧检测试剂盒(批号:S0033)购自广东碧云天生物技术有限公司;Caspase3抗体(批号:360758)、PARP抗体(批号:GR119170-6)、β-actin抗体(批号:110603)购自美国Abcam公司;实验所用H9c2细胞株购自美国菌种保藏中心ATCC。
1.1.2多肽 多肽序列:DSLVSLF;穿膜序列:RKKRR-QRRR-A;pPRDX5tide:RKKRRQRRR-A-DS-LVSL由上海科肽生物技术有限公司合成。
1.2方法
1.2.1H9c2细胞培养 H9c2细胞为大鼠心肌细胞,用含有10% FBS和1% P/S的DMEM培养基在37 ℃、5% CO2的条件下培养。
1.2.2细胞低氧 物理低氧:以六孔板接种细胞,待密度达到70%~80%后,低氧组换成无糖无血清的DMEM培养基,对照组换成DMEM完全培养基,分别以不同浓度(10、20、50 μmol/L)pPRDX5tide预处理H9c2细胞,2 h后,低氧组置于低氧箱中按条件进行低氧10 h。
化学低氧:以6孔板接种细胞,待密度达到70%~80%后,在正常培养基中按条件加入不同浓度(10、20、50 μmol/L)的pPRDX5tide预处理H9c2细胞,2 h后,低氧组加入模拟物CoCl2使终浓度为700 μmol/L进行24 h化学低氧。
1.2.3乳酸脱氢酶的活性检测 吸取细胞培养基,8 000 r/min离心5 min,96孔板每孔加入样品120 μl和工作液60 μl,室温孵育30 min后,酶标仪检测490 nm下的吸光度。
1.2.4台盼蓝染色 收集所有的H9c2细胞,按照台盼蓝染色细胞存活率检测试剂盒步骤进行染色,染色后用血细胞计数板计数,细胞死亡率=蓝色细胞数/细胞总数×100%。
1.2.5细胞内活性氧(reactive oxygen species,ROS)水平的检测 低氧结束后去除细胞培养液,加入适当体积的用无血清DMEM 1 ∶1 000稀释的DCFH-DA,37 ℃细胞培养箱内孵育20 min,无血清DMEM洗涤细胞3次,直接在荧光显微镜下观察并对各组随机选取区域进行拍摄。
1.2.6Western blot 用细胞刮刮取细胞后,12 000 r/min离心1 min,弃上清液,取适量RIPA裂解蛋白,收取裂解液,制样后进行蛋白质免疫分析。
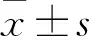
2 结果
2.1生物信息学分析对前期的多肽组学结果中差异较大的前体蛋白(P<0.05,变化倍数>2)进行基因本体(gene ontology, GO)分析(图1A),结果显示,较多基因聚类于细胞凋亡的负性调控、细胞与细胞的黏附、mRNA的加工与处理。其中,凋亡过程(apoptotic process)有较高的富集,已知凋亡在心肌细胞早期损伤中扮演着重要角色,再对其中聚类的蛋白进一步进行热图分析(图1B),从中挑选出差异显著的 pPRDX5tide作进一步生物信息学分析,发现pPRDX5tide(共7个氨基酸序列),前体蛋白为过氧化物酶5(peroxiredoxin 5, PRDX5) (213个氨基酸序列),pPRDX5tide位于前体蛋白序列中的第166~172个氨基酸位点处,参与凋亡过程的调节,在小鼠和人中均具有较高的保守性(图1C)。

图1 多肽组数据分析及pPRDX5tide的生物信息学分析

图2 pPRDX5tide保护物理低氧造成的损伤
A:物理低氧造模;与对照组比较:***P<0.001;B:物理低氧模型下,pPRDX5tide对LDH释放的作用;与低氧组比较:##P<0.01,###P<0.001
2.2pPRDX5tide降低乳酸脱氢酶(lactatedehydrogenase,LDH)的活性通过应用乳酸脱氢酶细胞毒性检测试剂盒,检测细胞的损伤作用。结果显示:采用低氧袋处理10 h和700 μmol/L CoCl2处理24 h分别进行物理和化学低氧造模的方法,检测LDH释放量(OD490 nm),物理低氧(1.667±0.031)较正常对照组(1.017±0.021)以及化学低氧(加入400、700 μmol/L CoCl2的LDH释放量分别为:1.481±0.030、1.924±0.28)较正常对照组(1.028±0.021)差异均有统计学意义,可见均可对H9c2细胞造成损伤(图2A、3C)。加入不同浓度的pPRDX5tide(10、20、50 μmol/L)可呈浓度依赖性地抑制细胞中LDH的释放(分别为1.486±0.043、1.333±0.039、1.322±0.027)(图2B、3D),且在50 μmol/L浓度时的作用最为明显。综上所述,pPRDX5tide可降低LDH的活性水平及释放,对细胞起到保护作用。
2.3pPRDX5tide提高细胞的存活率应用台盼蓝染色细胞存活率检测试剂盒进行细胞存活率的检测。结果显示:低氧后,细胞的死亡率明显增加(0.415±0.019),常氧情况下,细胞死亡率为(0.074±0.009),加入pPRDX5tide后并不影响细胞的存活率,死亡率为(0.095±0.012),对细胞不产生毒性作用,而在低氧时,pPRDX5tide能明显降低细胞的死亡率(0.204±0.023)(图3A、3E)。所以,pPRDX5tide能提高细胞的存活率,对细胞起到保护作用。
2.4pPRDX5tide降低ROS水平应用双氯荧光素(DCFH-DA)染色法检测细胞内ROS水平。结果显示:常氧情况下,pPRDX5tide对ROS水平无影响,荧光强度基本不变,见图3D(c)、3F(c);低氧时,细胞内产生大量的活性氧物质,荧光强度明显增加,见图3D(b)、3F(b)。浓度为50 μmol/L pPRDX5tide能明显抑制低氧时产生的大量ROS,使得荧光强度较低氧时明显降低,该浓度时荧光强度降低也最为明显[图3D(d)、3F(d)],pPRDX5tide能抑制低氧对ROS水平的促进作用。
2.5pPRDX5tide降低凋亡蛋白的水平Caspase3和PARP活化时能产生切割带,表明凋亡的激活,pPRDX5tide呈剂量依赖性的抑制凋亡蛋白Caspase3和PARP的活化,浓度越大,凋亡蛋白活化的表达水平越低,50 μmol/L时作用最为明显,切割带的表达水平最低,即50 μmol/L pPRDX5tide抑制凋亡的效果最佳(图4A)。这表明,pPRDX5tide参与细胞凋亡过程的调节,具有抗凋亡作用,能降低低氧造成的心肌细胞的凋亡。
3 讨论
pPRDX5tide是从低氧新生大鼠心肌细胞中选择的表达上调的多肽。对新生大鼠低氧心肌细胞与未低氧心肌细胞进行检测显示:pPRDX5tide在低氧心肌细胞中显著增高,利用H9c2细胞的物理与化学低氧模型进行研究,结果显示pPRDX5tide能抑制H9c2细胞的凋亡,降低低氧状态下H9c2细胞的死亡率,上述结果表明pPRDX5tide对心肌低氧损伤有一定的保护作用。
作为细胞功能的重要调节分子,细胞内源性多肽已受到越来越多的关注。一般认为,多肽作为其前体蛋白的水解产物,常保留其一部分空间结构及作用位点,在生物功能上能够通过激活、拮抗其前体蛋白的作用靶点发挥与前体蛋白相似或相反的生物功能[8]。在研究中,通过生物信息学分析表明pPRDX5tide定位于 PRDX5的第166个至172个氨基酸,全长7个氨基酸,研究[9-10]显示PRDX5参与细胞凋亡、氧化应激等多种生物过程。目前已有研究[11]显示PRDX5可通过一系列的氧化还原反应保护线粒体DNA免受氧化应激的损伤、抑制p53介导的细胞凋亡。pPRDX5tide是否通过影响PRDX5的靶点功能来抑制细胞凋亡,保护细胞免受低氧损伤,需进一步检测PRDX5的下游信号活性变化以及p53信号通路的激活情况,并通过挽救策略,深入论证其具体的作用机制。

图3 pPRDX5tide保护不同模式的低氧损伤并抑制ROS的产生
A:物理低氧模型下,pPRDX5tide对细胞死亡率的影响;与低氧组比较:**P<0.01;B:化学低氧造模合适条件;与0 μmol/L组比较:##P<0.01,###P<0.001;C:化学低氧模型下,pPRDX5tide对细胞死亡率的影响;与低氧组比较:▽P<0.05;D:物理低氧模型下,pPRDX5tide对活性氧的作用(×200;a:正常培养条件;b:物理低氧条件下;c:常氧下,pPRDX5tide预处理;d:物理低氧条件下,pPRDX5tide预处理); E:化学低氧模型下,pPRDX5tide对乳酸脱氢酶释放的作用;与低氧组比较:△△△P<0.001;F:化学低氧模型下,pPRDX5tide对活性氧的作用(×200;a:正常培养条件;b:化学低氧条件下;c:常氧下,pPRDX5tide预处理;d:化学低氧条件下,pPRDX5tide预处理)
本文研究了pPRDX5tide对H9c2细胞低氧损伤的保护作用,论述了pPRDX5tide与缺血性心脏病之间的相关性。研究结果可能为探究缺血性心脏病的发生发展机制提供新思路,为缺血性心脏病的防治提供新的分子靶点。

图4 pPRDX5tide抑制氧化损伤中凋亡关键蛋白的活化
