ANXA2-siRNA转染对胃癌耐药细胞药物敏感性的影响及机制
2018-11-07余南荣徐厚巍蓝俊松
余南荣,曾 祥,徐厚巍,蓝俊松
胃癌是消化系统中最常见的恶性肿瘤之一,随着社会的发展,胃癌的发病率呈现逐年升高的趋势,甚至有年轻化的倾向[1]。目前在临床上,针对胃癌主要的治疗手段是手术治疗为主的综合治疗,化疗能够在一定程度上缩小肿瘤体积、减慢胃癌的发展速度,为患者争取更多的手术机会。但胃癌是各类恶性肿瘤中化疗敏感性较差的种类之一,对化疗药物的多药耐药是引起化疗效果差的主要原因[2]。近年来针对胃癌耐药性的研究[3]显示,膜联蛋白A2基因(Annexin A2,ANXA2)在胃癌细胞中显现出异常表达,推测其有可能与胃癌的耐药有关。该研究对胃癌细胞进行ANXA2-siRNA转染,观察胃癌耐药细胞的药物敏感性变化以及细胞中信号通路激活状态的变化情况。
1 材料与方法
1.1主要实验材料顺铂(DDP)购自山东德州制药厂;MTT试剂盒购自美国Solarbio公司;Bcl2多克隆抗体、AKT多克隆抗体、p-AKT(磷酸化-ANKT)多克隆抗体、P38多克隆抗体以及p-P38多克隆抗体、羊抗兔二抗、羊抗鼠二抗均购自Santa Cruz公司;ANXA2-siRNA及PCR引物合成自上海生物工程有限公司;SGC-7901/DDP耐药细胞购自南京凯基生物技术有限公司;RNApure超纯总RNA快速提取试剂盒购自北京Biomed公司;EasyScript First-Strand cDNA Synthesis SuperMix试剂盒购自北京TransGen Biotech公司。3131型CO2细胞培养箱购自美国Thermo公司;凝胶成像仪UV-254购自美国基因公司;紫外分光光度计购自美国Bio-Rad Headquarters;电泳仪、垂直电泳槽等购自北京六一仪器厂。
1.2实验方法
1.2.1细胞培养 SGC-7901/DDP耐药细胞接种于含有培养基的培养皿中,培养基配比为RPMI1640培养液中加入10%的胎牛血清、100 U/ml的青霉素和链霉素。当细胞生长至90%~100%融合时,吸去培养液后用PBS清洗3遍后加入0.25%的胰蛋白酶充分消化,使细胞脱离培养皿,丢弃消化液后加入培养基终止消化,反复吹打形成细胞悬液后进行传代。选择无污染处于对数生长期的细胞用于实验。根据处理方法,将细胞分为三组:空白对照组、空白-siRNA组、ANXA2-siRNA组。
1.2.2细胞转染 转染前将细胞培养基置换成不含胎牛血清和抗生素的RPMI1640培养液。将siRNA加入至250 μl不含胎牛血清和抗生素的RPMI1640培养液中,将10 μl阳离子脂质体Lipofectamine 2000TM加入另一250 μl不含胎牛血清和抗生素的RPMI1640培养液中静置5 min后将两者混合,室温下放置20 min后加入至各组细胞的培养基中,6 h后再次更换培养液。
1.2.3细胞总RNA提取及RT-PCR 采用TRIzol一步法提取细胞总RNA,按1 ml/10 cm2培养皿贴壁细胞加入TRIzol,裂解液经氯仿抽提(每1 ml TRIzol 加0.2 ml)后,用RNApure超纯总RNA快速提取试剂盒提取细胞总RNA。利用EasyScript First-Strand cDNA Synthesis SuperMix试剂盒,将总RNA逆转录为cDNA。过程如下:取5.0 μg总RNA,加入1 μl Oligo(dT),2×ES reaction mix 10 μl,esayscriptRT/RI enzyme mix 1 μl,补无核糖核酸酶游离水至20 μl,42 ℃孵育30 min,然后85 ℃ 5 min失活easyscript RT。分装后-20 ℃保存。β-actin、GST、Bax反应体系如下:Mix 10 μl,上游引物0.5 μl,下游引物 0.5 μl,cDNA 1 μl,补ddH2O至20 μl。然后95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环,最后72 ℃延伸10 min。PCR产物进行1.5%琼脂糖凝胶鉴定。引物序列参见表1。重复10次,然后采用Image J软件进行灰度分析。

表1 引物序列
1.2.4细胞蛋白提取及Western blot分析 在各组直径100 mm平皿中,在生长良好的贴壁培养细胞中加入200~300 μl 85 ℃的1×SDS凝胶加样缓冲液(50 mmol/L Tris-Cl,pH 6.8;100 mmol/L DTT;2%SDS;10%甘油;0.1%溴酚蓝)裂解细胞;裂解样品经煮沸、超声、离心后,取上清液,紫外光谱检测定量,-20 ℃分装保存。将50 μg样品加入1×SDS凝胶加样缓冲液,100 ℃变性10 min,顺序加样,行12%的SDS-PAGE电泳。电泳结束后,经湿式电转仪(Bio-Rad)恒流冰浴转膜,5%脱脂牛奶4 ℃封闭1 h;分别孵育一抗后,在4 ℃过夜。加入羊抗鼠或羊抗兔二抗孵育1 h,化学发光、显影、定影。观察杂交信号。重复10次,采用Image J软件进行灰度分析。
1.2.5MTT分析 将各组对数生长期的细胞消化制作成细胞悬液计数后,按照1×104个/孔的数量将200 μl细胞接种于96孔板内,每组设6个平行孔,培养24 h后,将培养孔内的培养基更换为含有不同浓度DDP(0、2、4、8、10 μg/L)、5-氟尿嘧啶(5-FU)(0、2、4、8、10 μg/L)的培养基,再培养48 h后,每个培养孔内加入20 μl MTT继续培养4 h后弃上清液,每孔加入150 μl DMSO后室温下水平震荡10 min后采用酶标仪测定490 nm处每孔的吸光度,取平均值,测定每组细胞的半数抑制浓度(IC50)值。
2 结果
2.1胃癌耐药细胞耐药相关基因表达ANXA2-siRNA转染SGC7901/DDP细胞后,无论在RNA水平还是蛋白水平上,耐药相关基因GST的表达水平显著降低,而Bax的表达水平明显上调,见图1、2和表2、3。

图1 GST、Bax在RNA水平的表达变化

图2 GST、Bax在蛋白水平的表达变化

项目空白对照空白-siRNAANXA2-siRNAF值P值GST灰度201.16±8.98202.98±7.4791.98±7.247.560.000Bax灰度133.63±6.16132.03±5.74153.98±9.6714.820.001

表3 GST、Bax在蛋白水平的表达变化的灰度分析

表4 MTT药敏实验结果

表5 MAPK及PI3K/Akt信号通路激活变化的灰度分析
2.2MTT药敏实验与空白对照组和空白-siRNA组细胞相比,ANXA2-siRNA转染SGC7901/DDP细胞对化疗药物DDP和5-FU的IC50值显著降低,差异有统计学意义(P<0.05)。见表4。
2.3ANXA2-siRNA转染对MAPK及PI3K/Akt信号通路激活的影响与空白对照组和空白-siRNA组细胞相比,ANXA2-siRNA转染SGC7901/DDP细胞后,MAPK信号通路中,P38表达无明显变化,但P38磷酸化水平下降明显。在PI3K/Akt信号通路中,AKT表达无明显变化,但AKT磷酸化水平下降明显。见图3、表5。
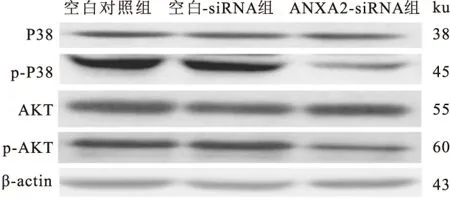
图3 MAPK及PI3K/Akt信号通路激活变化
3 讨论
3.1ANXA2-siRNA转染对胃癌耐药细胞药物敏感性的影响胃癌的发病率高,但早期诊断率低,患者就诊时往往已处于进展期胃癌,失去了手术机会,化疗成为主要的治疗手段。但胃癌细胞在化疗过程中对化疗药物的敏感性不同,甚至会产生耐药性,导致化疗的效果不佳[4]。胃癌耐药细胞的出现是胃癌化疗中棘手的问题之一。促进胃癌耐药细胞对化疗药物的敏感性,降低耐药性,是目前研究的热点。
胃癌的耐药机制目前仍不明确,可能涉及多种耐药基因如P-糖蛋白(P-gp)、谷胱甘肽转移酶(GST)、拓扑异构酶Ⅱ(Topo-Ⅱ)等[5-7]。GST在生理状态下能够通过催化药物与谷胱甘肽的结合,参与药物的代谢,主要有碱性、中性、酸性三种类型。其中酸性GST在多种耐药肿瘤细胞中表达异常[8]。目前认为GST能够使结合到谷胱甘肽上的化疗药物增加,从而使药物外流减少而降低了细胞毒性,在铂类、蒽环类药物的耐药性产生中发挥重要作用[9]。Bax是Bcl-2家族中主要的促细胞凋亡蛋白。细胞凋亡信号激活Bax后,Bax从细胞质转移到线粒体膜上,使线粒体渗透性变化,影响细胞氧化还原作用,从而促进细胞的凋亡[10]。本研究ANXA2-siRNA转染胃癌耐药细胞后显示,耐药基因GST的表达量明显下降,而促细胞凋亡基因Bax表达量升高,这说明胃癌细胞的耐药性发生改变。进一步采用MTT药敏实验法分析胃癌耐药细胞对一线化疗药物DDP和5-FU的敏感性,结果显示ANXA2-siRNA转染后,半数致死量药物浓度明显下降,细胞对DDP和5-FU的敏感性显著升高。有可能ANXA2-siRNA转染后,更多的化疗药物进入胃癌细胞内,从而提高了药物的杀伤能力。
本研究结果结合其他相关研究,推测ANXA2与胃癌的耐药性具有密切的关系,降低胃癌耐药细胞中ANXA2的表达,能够改善胃癌耐药的现状。ANXA2与胃癌的关系密切,多项研究[11-12]已经证实ANXA2在胃癌组织中异常高表达,甚至在胃癌的肿瘤分化、转移浸润中也起到重要作用。也许将ANXA2作为解决胃癌耐药性问题的切入点能够取得突破性进展。
3.2ANXA2-siRNA转染对胃癌耐药细胞信号通路激活的影响细胞内存在多种信号通路,参与细胞的增殖、分化、凋亡等多种生理病理过程。ANXA2是一种膜联蛋白,能够与多种不同的磷脂蛋白结合,参与多个信号通路的激活或抑制,从而调节细胞的生长和凋亡。在鼻咽癌的研究中显示ANXA2能够调控上皮间充质细胞的转化,如果靶向下调ANXA2的表达能够降低鼻咽癌的发生和对化疗药物的耐药性[13]。如前所述,在本研究中转染ANXA2-siRNA,下调胃癌耐药细胞的ANXA2表达后,胃癌耐药细胞中的耐药相关基因表达量明显下降,促凋亡基因表达量明显升高,胃癌耐药细胞对化疗药物的敏感性大大提高。
本研究将MAPK及PI3K/Akt信号通路作为研究点,以探讨ANXA2影响胃癌细胞耐药的机制。MAPK信号通路是丝裂原活化蛋白激酶通路,主要起到将细胞外信号转移至细胞核的作用,在信号通路中,多种蛋白激酶发生磷酸化而发挥信号传导的作用,其中P38及其磷酸化是非常关键的步骤[14]。PI3K/Akt信号通路在胃癌的发生、治疗中起着桥梁的连接作用,PI3K在一系列上游信号的作用下,通过AKT等多种下游信号分子调节细胞的凋亡、对药物的敏感性等[15]。将胃癌耐药细胞SGC7901/DDP进行ANXA2-siRNA转染后,MAPK信号通路中虽然P38表达量无变化,但磷酸化的P38水平明显下降。同样在PI3K/Akt信号通路中,虽然AKT表达量无明显变化,但磷酸化的AKT表达明显下调,这说明ANXA2-siRNA转染后对MAPK及PI3K/Akt信号通路的激活具有一定的影响。因此,ANXA2可能通过MAPK及PI3K/Akt信号通路改变胃癌耐药细胞的化疗药物敏感性。
综上,ANXA2-siRNA转染胃癌耐药细胞能够下调胃癌耐药相关基因的表达,降低胃癌细胞的耐药性,其机制可能是通过影响MAPK及PI3K/Akt信号通路中P38和AKT磷酸化过程实现的。
