c-Myc调控的长链非编码RNA lncRNA55对舌鳞癌细胞生长的影响
2018-11-07韩曈曈徐艳雪朱友明陈乔尔
韩曈曈,徐艳雪,朱友明,陈乔尔
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度大于200个核苷酸但无蛋白编码功能的RNA,研究[1-2]证实lncRNA参与细胞周期、凋亡、分化等多种细胞内生物过程。目前,已经发现了多种lncRNA在肿瘤中异常表达,并且扮演着“癌基因”或“抑癌基因”的角色,如lncRNA HOTAIR、lincRNA-p21、lincRNA-ROR[3-5]。c-Myc是一种关键转录因子,参与细胞增殖、细胞代谢、蛋白合成等重要生命活动,研究[6]表明c-Myc在一些肿瘤中过表达,与肿瘤发生发展有关,并证实lncRNA可能在c-Myc诱导调控的信号通路中发挥重要作用。鉴于c-Myc与lncRNA在肿瘤进展过程中的密切联系,将c-Myc相关的lncRNA作为研究的切入点,利用高通量测序技术在c-Myc tet off的H1299细胞中(在该系统中加入Doxycydine后c-Myc会下调)进行筛选,发现一些c-Myc正调控和负调控的lncRNA,从中选择了一个表达差异显著且由c-Myc负调控的新lncRNA,命名为lncRNA55(ENST00000448595,lncRNA-AC109826.2),确定作为后续研究对象。lncRNA55定位于人类2号染色体上,长约548个核苷酸,目前关于肿瘤中lncRNA55生物学功能的报道较少。该研究旨在验证c-Myc和lncRNA55二者表达之间的相关性,并通过shRNA技术敲低lncRNA55以探究其对舌鳞癌细胞生长的影响,为舌鳞癌的分子靶向治疗提供新思路。
1 材料与方法
1.1材料人舌鳞癌细胞系SCC3、人胚胎肾细胞293T、大肠杆菌DH5α(安徽医科大学口腔实验室保存);10%FBS、胰蛋白酶、DMEM培养液、青-链霉素溶液(美国Gibco公司);该实验所用的表达载体plko.1-shc-Myc及对照组plko.1-shc-Myc-ctrl、flag-c-Myc及对照组flag空载(中国科学技术大学生科院提供);表达载体plko.1-shlncRNA55及对照组plko.1-shlncRNA55-ctrl(该实验室构建);shlncRNA55、对照组shctrl质粒、PCR引物(上海生工技术服务有限公司设计合成);载体质粒plko.1及慢病毒包装质粒pRev、pGag、pVsvg(中国科学技术大学生科院实验室提供);琼脂糖凝胶回收试剂盒(北京天根生物技术有限公司);慢病毒包装试剂(上海和元技术有限公司);蛋白定量试剂盒(美国Thermo公司);Actin抗体、c-Myc兔单克隆抗体(美国Santa Cruz公司,货号CST9402,1 ∶1 000);硝酸纤维素膜(美国Amersham Pharmacia Biotech公司);RNA提取试剂盒(美国Promega公司);逆转录试剂盒、qRT-PCR试剂(日本TaKaRa公司);TRIzol试剂(美国Invitrogen公司);DNA片段回收试剂盒、离心柱型质粒小提试剂盒(美国Axygen公司);LB培养基为1%氯化钠,1%蛋白胨,0.5%酵母提取物(上海生工技术服务有限公司);四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂、嘌呤霉素、结晶紫(美国Sigma公司);二甲基亚砜(dimethylsulfoxide,DMSO)(上海碧云天生物技术有限公司)。高压蒸汽灭菌锅(日本Hirayama公司);恒温干燥箱;数显三用水浴箱(上海讯博公司);高速常温离心机、Master cycler PCR仪(德国Eppendorf公司);二氧化碳孵箱(美国Thermo公司)。
1.2方法
1.2.1细胞培养 SCC3、293T细胞用含有10%胎牛血清的DMEM培养液,置5% CO2的37 ℃培养箱中常规培养,0.25%胰蛋白酶消化传代。
1.2.2Plko.1-shlncRNA55表达载体的构建 结合plko.1载体特点,由上海生工技术服务有限公司设计plko.1-shlncRNA55载体构建所需的引物,上游引物:5′-CCGGGAAGCTCATTTTGTCAGCACTCGAGTG CTGACAAAATGAGCTTCTTTTTG-3′;下游引物:5′-A ATTCAAAAAGAAGCTCATTTTGTCAGCACTCGAGTG CTGACAAAATGAGCTTC-3′,合成shlncRNA55。获得扩增基因后,1%琼脂糖凝胶电泳分离并纯化,回收目的片段。限制内切酶37 ℃水浴双酶切基因片段和质粒载体plko.1,由T4连接酶将回收的酶切产物和载体连接。将上述连接产物转入感受态大肠杆菌DH5α,涂于LB(含Amp抗性)平板上,37 ℃倒置培养过夜,挑取菌落,筛选阳性克隆,送公司测序鉴定,成功构建plko.1-shlncRNA55。
1.2.3慢病毒包装和转染SCC3细胞 慢病毒包装:过程中所需三种包装质粒为pRev、pGag、pVsvg。胰酶消化293T细胞,铺至6孔板培养,待细胞密度50%时,分别取上述已构建成功携带目的片段的表达载体(2 μg)和病毒包装质粒(2 μg pRev、2 μg pGag、1 μg pVsvg)共转染293T细胞,DMEM完全培养基培养48 h后,收集病毒上清液,0.45 μm PVDF滤器过滤,病毒原液分装,-80 ℃保存。慢病毒转染:病毒感染前1 d,胰酶消化SCC3细胞,铺6孔板,待细胞密度30%时,将各病毒液分别感染SCC3,同时加入2 μl的8 μg/ml polybrene,37 ℃孵育4 h,加入嘌呤霉素筛选1~2周。
1.2.4qRT-PCR检测lncRNA55的表达水平 收集转染后48 h共6组SCC3细胞(转染plko.1-shc-Myc、flag-c-Myc、plko.1-shlncRNA55及其各对照组),按TRIzol试剂说明书分别提取各组细胞的总RNA。逆转录合成cDNA,-20 ℃保存备用。lncRNA55上游引物: 5′-GTGGGAGCAAATTAGTAGGTG-3′,下游引物:5′-CACTTCTGCCATCAGCATGCA-3′;GAPDH内参:上游引物:5′-AGGAAGAGCACAAGGAAGGCA-3′,下游引物:5′-GGTTGCACATAGACGAGGACT-3′。将含有待扩增序列的cDNA 为模板进行PCR反应, 30 μl总体积包括:上游引物1 μl, 下游引物1 μl,cDNA 1 μl,2× Pfu PCR MasterMix 15 μl, 无菌蒸馏水12 μl。在PCR扩增仪上完成PCR扩增,扩增反应程序为:94 ℃、2 min,94 ℃、1 min,56 ℃、1 min,72 ℃、2 min,重复30个循环。反应结束后记录各组结果,以GAPDH作为分子内标,采用2-ΔΔCt法比较分析各组lncRNA55的表达。
1.2.5Western blot法检测c-Myc蛋白的表达 细胞裂解液裂解转染后的SCC3细胞(转染plko.1-shc-Myc、flag-c-Myc及各自对照组),提取细胞内总蛋白,定量,用12%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白。将分离出的蛋白转至PVDF膜上,室温下用5%脱脂牛奶封闭2 h,c-Myc兔单克隆抗体(CST9402,1 ∶1 000)4 ℃孵育过夜,TBST清洗3次,相应二抗室温孵育1.5 h,TBST洗膜3次,ECL发光、显色,以Actin作为内参,分析c-Myc的相对表达量。
1.2.6MTT法检测SCC3细胞生长 将转染shlncRNA55、shlncRNA55-ctrl后的SCC3细胞按2×103个/孔密度接种于96孔板,37 ℃分别培养6、12、24、48、72 h,每孔依次加入MTT 20 μl(5 mg/ml),37 ℃继续培养4 h后,终止培养,小心吸去孔内培养液。在每孔加入DMSO 150 μl,低速振荡10 min,在酶标仪570 nm处测量各孔的吸光值(OD)。
1.2.7集落形成实验检测SCC3细胞增殖 取shlncRNA55和shlncRNA55-ctrl对照组SCC3细胞分别接种于6孔板,300个/孔,每孔加入培养液2 ml,培养10 d,4%多聚甲醛固定15 min,1%结晶紫染色4 h,清洗晾干后,观察并拍照。
1.2.8免疫荧光实验检测lncRNA55在SCC3细胞内的定位 将制备好的细胞标本置于含10%固定液的PBS中预变性5 min,取出标本浸在固定液中10 min,2次,立即按顺序将标本经体积分数70%、90%和100%冰乙醇,每次5 min,标本固定后干燥。将50%甲酰胺50 ml倒于湿盒中,37 ℃预热。将固定好的细胞玻片上孵育RNA探针,置于80 ℃的烫板变性10 min,将样本置于之前的湿盒中,37 ℃杂交过夜。次日,洗脱标本,加适当浓度TBST溶解的Hoechst染细胞核1 min,再次洗涤标本,封片。荧光显微镜下观察拍照lncRNA55的细胞内定位。
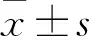
2 结果
2.1目标lncRNA的发现前期利用高通量测序技术在c-Myc tet off的H1299细胞中(在该系统中加入Doxycycline后c-Myc会下调)进行筛选,送公司检测,发现一些表达差异显著的lncRNA。从中选择了一个高表达且变化量约13倍的新lncRNA,认为其表达差异有意义,命名为lncRNA55。由于该系统中c-Myc下调,而在此结果中检测到lncRNA55表达上调,猜测lncRNA55受c-Myc负性调节,lncRNA检测数据见表1。

表1 LncRNA55基本数据
2.2敲低c-Myc对SCC3细胞中lncRNA55表达的影响将shc-Myc转染至SCC3细胞,Western blot检测c-Myc蛋白表达,与转染shc-Myc-ctrl对照组比较,实验组细胞内c-Myc表达降低,证实成功敲低c-Myc表达,见图1A。qRT-PCR检测c-Myc敲低后的SCC3细胞内lncRNA55表达量,显示lncRNA55水平显著高于对照组(F=1 358.34,P<0.05),见图1B。

图1 shc-Myc对SCC3细胞中lncRNA55表达的影响
A:两组c-Myc蛋白的表达情况;B:两组lncRNA55的表达情况;1:转染shc-Myc-ctrl组;2:转染shc-Myc组;与shc-Myc-ctrl对照组比较:*P<0.05
2.3过表达c-Myc对SCC3细胞中lncRNA55表达的影响将flag-c-Myc转染至SCC3,Western blot检测结果显示c-Myc蛋白表达较转染flag空载组增高,证实c-Myc在SCC3内成功过表达,见图2A。qRT-PCR检测过表达c-Myc的SCC3细胞内lncRNA55表达量,显示lncRNA55水平明显低于flag空载组(F=254.82,P<0.05),见图2B。
2.4shlncRNA55干扰lncRNA55表达的效果将shlncRNA55转染SCC3细胞后,qRT-PCR检测结果显示转染shlncRNA55组lncRNA55水平显著低于转染shlncRNA55-ctrl组(F=311.29,P<0.05),表明shlncRNA55成功下调了lncRNA55的表达,见图3。
2.5lncRNA55对SCC3细胞生长、集落形成能力的影响MTT法、集落形成实验检测转染shlncRNA55后SCC3细胞的生长和集落形成能力。结果表明,与shlncRNA55-ctrl组相比,shlncRNA55组转染后72 h的细胞生长速率明显增加[(14.78±0.37)vs(19.62±0.30),F=531.00,P<0.05],见图4,细胞形成的集落数量增多[(81±5.57)vs(151±4.58),F=240.98,P<0.05],见图5。因此,可以看出敲低SCC3细胞中lncRNA55显著促进细胞增殖。

图2 flag-c-Myc对SCC3细胞中lncRNA55表达的影响
A:两组c-Myc蛋白的表达情况;B:两组lncRNA55的表达情况;1:转染flag空载体组:2:转染flag-c-Myc组;与flag空载体组比较:*P<0.05

图3 shlncRNA55转染后lncRNA55表达量变化
1:转染shlncRNA55-ctrl组;2:转染shlncRNA55组;与shlncRNA55-ctrl组比较:*P<0.05
2.6lncRNA55的细胞内定位荧光显微镜下,lncRNA55呈现红色荧光,Hoechst染细胞核为蓝色,合并图像后可以看出lncRNA55定位在SCC3细胞质内,见图6,说明lncRNA55可能在细胞质中发挥作用。

图4 shlncRNA55干扰后SCC3细胞生长情况
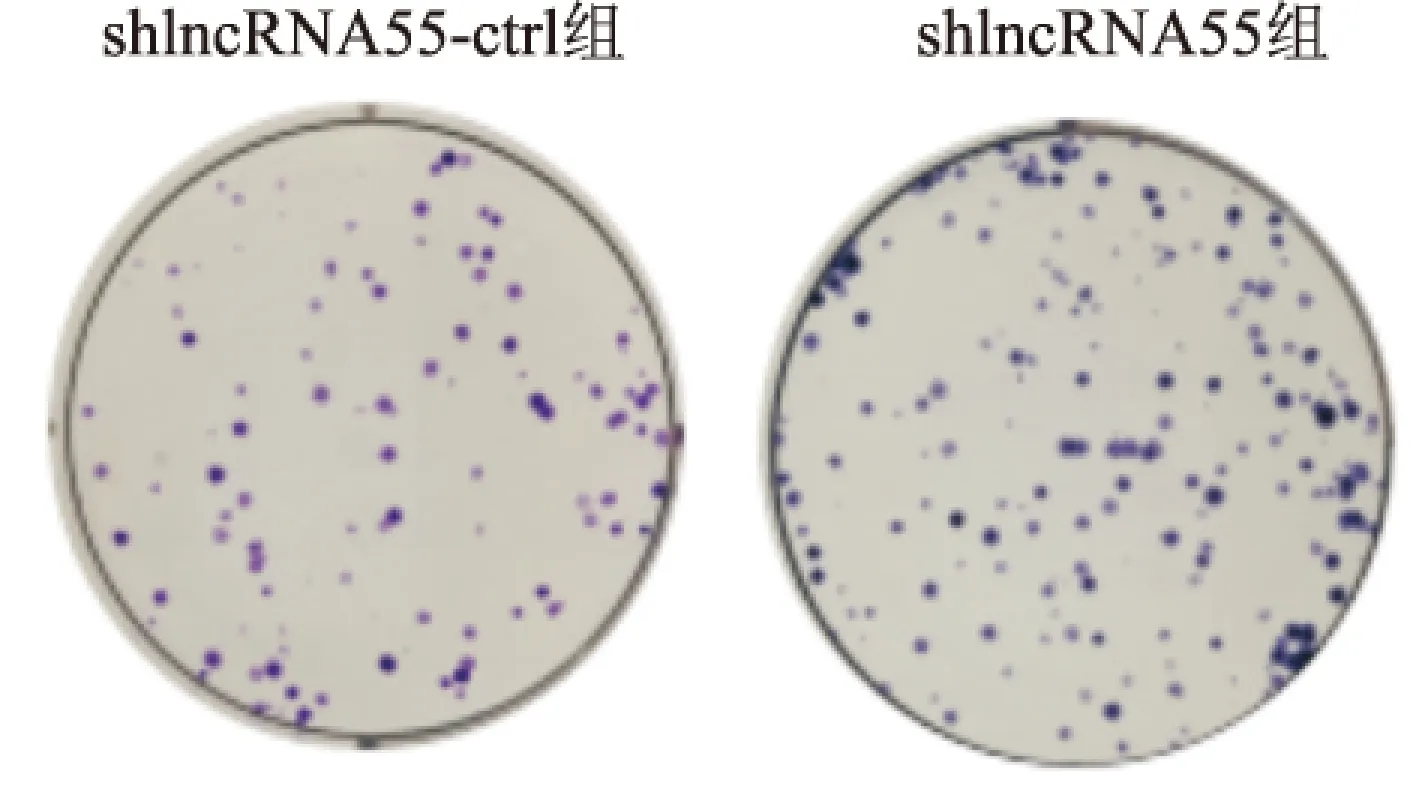
图5 结晶紫染色观察shlncRNA55干扰后SCC3细胞集落形成情况
3 讨论
口腔鳞状细胞癌是一种复杂的肿瘤性疾病,可发生在口腔多个部位,其中以舌鳞状细胞癌最常见[7],因其恶性程度高、预后差成为临床治疗的难题。近年来,随着肿瘤分子生物学发展,基因治疗备受关注,探究舌鳞癌发生发展的潜在机制,寻求调控癌细胞生长的靶基因,这将为肿瘤治疗提供新策略。
MYC是肿瘤发生过程中重要的调控基因,MYC家族包括3个成员:c-Myc、N-Myc(MYCN)、L-Myc(MYCL)。其中c-Myc是重要的癌基因,正常人细胞中c-Myc相对低表达,而癌细胞中c-Myc水平明显升高,研究指出至少一半肿瘤患者体内c-Myc活化,同时,大量体内外试验表明c-Myc促进了肿瘤生长。目前在多种肿瘤中发现c-Myc和lncRNA之间存在密切联系,并证实lncRNA-c-Myc网络在肿瘤的激活、发展和转移中发挥重要作用,c-Myc可以调控一些lncRNA的表达,而lncRNA也能结合c-Myc抑制其表达,二者相互作用共同影响了肿瘤的进展[8-9]。

图6 lncRNA55在细胞内的定位 Hoechst染色×160
研究已经在肿瘤中发现一部分受c-Myc调控的lncRNA,并证实这部分lncRNA可能在c-Myc诱导调控的信号通路中发挥重要作用。研究[10]显示在非小细胞型肺癌中lncRNA H19受c-Myc诱导,c-Myc能上调H19表达,进而H19下调miR-107来促进肿瘤生长。Zhang et al[11]也验证了H19是c-Myc的下游靶基因,通过影响肺癌细胞凋亡在癌发展过程中发挥重要功能,敲低H19能在一定程度上逆转c-Myc诱导的促癌细胞生长效应。有关结肠癌的研究[12]证实lncRNA MYU也是c-Myc的直接靶基因,位于Wnt/c-Myc信号通路下游,在结肠癌中高表达,进一步证实了lncRNA MYU通过与RNA结合蛋白hnRNP-K结合以增强CDK6表达,来促进癌细胞周期和癌发展。在肝癌中发现c-Myc可以直接结合lncRNA CCAT1启动子部位,通过促进对lncRNA CCAT1上游的调控来上调其表达,表明c-Myc/CCAT1通路参与了肝癌的发展[13]。尽管关于c-Myc、lncRNA和肿瘤三者之间关系的研究已经取得了初步进展,但目前在舌鳞癌中相关研究较少。本研究前期应用高通量测序技术筛选因c-Myc下调诱导引起差异表达的lncRNA,发现了一个可能受c-Myc负调控的lncRNA55,作为研究对象进行验证,并探究了lncRNA55对舌鳞癌细胞SCC3增殖的影响。
为了求证舌鳞癌中lncRNA55与c-Myc表达之间的相关性,通过基因转染的方法将载体plko.1-shc-Myc转至舌鳞癌细胞SCC3中,与对照组比较,细胞内c-Myc蛋白水平降低,说明成功敲低了c-Myc表达,同时显示lncRNA55的表达量显著升高。为了增加结果的可信度,在SCC3细胞中过表达c-Myc,检测到c-Myc上调使lncRNA55表达减少,结论与上述一致。这些结果表明在舌鳞癌细胞中lncRNA55与c-Myc表达之间存在负性相关,推测lncRNA55可能受c-Myc负调控。接下来为进一步评估lncRNA55在舌鳞癌细胞中的生物学功能,在体外构建表达载体plko.1-shlncRNA55,转染至SCC3细胞,以敲低lncRNA55的表达。分别通过MTT法、集落形成实验检测SCC3细胞的增殖情况,结果均显示lncRNA55表达下调能显著促进舌鳞癌细胞的增殖,说明lncRNA55可能通过影响癌细胞的生长来参与对肿瘤的调控。此外,免疫荧光实验可以看出lncRNA55定位在SCC3细胞质内,推测lncRNA55在细胞质中发挥作用。
综上所述,在舌鳞癌细胞SCC3中lncRNA55可能受c-Myc负调控,敲低lncRNA55的表达能促进SCC3细胞增殖和集落形成,并证实lncRNA55在细胞质中发挥功能。然而,该实验研究尚浅,lncRNA55对癌细胞的调节方式如何,c-Myc-lncRNA55通路如何从基因水平介导细胞的生长仍不清楚。进一步深入探究lncRNA55在舌鳞癌中的作用机制,实现对lncRNA55表达的有效调控,将为舌鳞癌分子治疗提供新的方向和理论依据。
