姜黄通过肠道菌群改善机体脂质代谢作用的实验研究
2018-11-05李竞
李竞
宁波市鄞州人民医院,浙江 宁波 315100
随着生活水平的不断提高,越来越多的人遭受着肥胖带来的困扰。肥胖人群不仅会饱受各种各样的代谢性疾病的煎熬,而且患心脑血管类疾病的风险还会大大增加[1]。近年来,中药姜黄的降血脂作用逐步为临床所认可,其主要提取物白藜芦醇具有抗氧化[2]、抗炎症[3]、抗肿瘤[4]、保护心血管[5]以及延缓衰老[6]的作用。研究发现姜黄具有抗肥胖作用[7],其提取物白藜芦醇一方面可以增加棕色脂肪组织的产热,另一方面还能抑制脂肪生成相关关键基因的表达。然而由于化学结构的关系,提取物白藜芦醇进入人体后只会大量聚集在人体的肠道,而不能被肠道吸收,所以只有很少量的白藜芦醇能够被内脏脂肪部位所吸收,通过上述机理发挥抗肥胖作用十分有限[8]。因此,本研究团队提出了一个假设,姜黄更有可能是通过肠道菌群介导来调节机体的脂肪代谢从而产生抗肥胖作用。肠道菌群,人体后天获得的第二个“基因组”,可以促进人体营养的吸收,抑制病原菌的侵入,维持正常的黏膜免疫功能,以及调节脂肪代谢[9]。研究证明无菌小鼠接种多形拟杆菌后,其吸收和储存能量的能力得到了一定的提升[10]。此外,肠上皮细胞可以产生一种低密度脂蛋白抑制因子—禁食诱导脂肪细胞因子(fasting induced adipose factor,FIAF)。肠道菌群能够调控FIAF的表达,FIAF水平的变化会引起受体辅助激活因子(peroxisome proliferator-activated receptor-γ co-activator 1,PGC-1α)和腺苷一磷酸活化蛋白激酶(adenosinemonophosphate-activated protein,AMP)活性的变化,从而对甘油三酯的代谢产生影响[11]。本研究采用高脂日粮饲养建立高脂小鼠模型,以姜黄进行干预,从肠道菌群的角度出发,阐述姜黄、肠道菌群以及脂肪代谢三者之间的关系。
1 材料与方法
1.1 实验动物 选取8周龄的健康雄性C57BL/6小鼠30只,体质量(25±2)g,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0009。动物实验在宁波市鄞州人民医院动物房内进行,小鼠饲养在室温18~22℃,相对湿度50%~60%,自由摄食和饮水,每天给予充足的饮水和相应试验方案的饲料,单笼饲养,12 h光照和12 h黑暗交替。
1.2 材料、试剂和仪器 姜黄药材购于鄞州人民医院,经鉴定为姜黄的干燥块茎;按中药煎制方法,制成浓度相当于1 g/mL生药的姜黄汤剂。Trizol试剂盒、反转录试剂盒、PCR试剂盒购于赛默飞世尔公司,荧光素Cy3购于Sigma公司,流式细胞仪购自美国BD公司。
1.3 分组、干预及标本的采集 按随机区组设计分为正常组、模型组以及姜黄组3组,每组10只。正常组用正常饲料饲养(总卡路里3.25 kcal/g,脂肪中卡路里占比10%),模型组和姜黄组均用高脂肪的饲料饲养(总卡路里3.68 kcal/g,脂肪中卡路里占比50%),姜黄组小鼠灌胃姜黄(200 mg/kg),灌胃体积为20 mL/kg,每天1次,连续12周,其他2组灌胃等量的生理盐水。末次给药后,小鼠禁食6 h后通过颈椎脱臼法处死,分离其肠、肝脏及内脏脂肪组织,保存在液氮中,用于后续的研究分析。
1.4 生化分析 小鼠禁食6 h后,抽取血样,3 000 r/min、4℃条件下离心10 min。采用酶比色法测定总胆固醇(TC),甘油三酯(TG),高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的浓度。
1.5 荧光原位杂交法检测肠道主要菌群 ①固定:结肠内容物与磷酸盐缓冲液以1∶9的比例混合并涡旋3 min,吸取0.2 mL的悬浮液加入至3%的福尔马林中储存进行固定,4℃过夜。②探针:拟杆菌特异性探针(Bac303,5'-CCAATGTGGG GGACCTT-3'),乳酸菌特异性探针(Lab158,5'-GGTATTAGCA CTGTTTCCA-3'),双歧杆菌特异性探针(Bif164,5'-CATCCGGC ATTACCACCC-3'),粪肠球菌特异性探针(Enf191,5'-GAAAGC GCCTTTCACTCTTATGC-3'),以及细菌通用探针(EUB388,5'-GCTGCCTCCCGTAGGAGT-3')。采用上述探针对肠道主要菌群进行计数。细菌通用探针用异硫氰酸荧光素(FITC)标记,其他探针均用荧光素Cy3标记。③杂交反应:取20μL探针、10μL亲和素量子点与50μL杂交缓冲液(55 mmol/L NaCl,25 mmol/L Tris-HCl,pH 7.5,甲酰胺 40%,0.01%SDS)混合,最终探针浓度为4ng/μL。④温育及检测:杂交后,吸取150μL杂交溶液,离心15 min,然后再加入清洗缓冲液(55 mmol/L NaCl,25 mmol/L Tris-HCl,pH 8.0,5 mmol/L EDTA,0.01%SDS)温育30 min,吸取200μL加入到500μL的PBS中,用流式细胞仪进行检测。
1.6 实时定量PCR检测分析 总RNA采用Trizol试剂盒分别从小肠和肝组织中提取,随后用脱氧核糖核苷酸酶处理。采用实时荧光定量PCR法,用qPCR试剂盒对总RNA进行逆转录和PCR扩增。每5μLcDNA反应液与1 ng总RNA和900 nM基因特异性引物按照以下参数进行PCR检测,95℃5 min循环1次,95℃20 s循环45次,60℃30 s循环45次,72℃20 s循环45次,72℃5 min循环1次。FIAF引物序列:上游5'-CTCTGGGATCTCCACCATTT-3',下游 5'-TTGGGGATCTCC GAAGCCAT-3';脂蛋白酯酶(LPL)引物序列:上游5'-TACCGC AGCTAGGAATAATGG-3',下游 5'-CGGAACTACGACGGTAT-3’;内参β-Actin引物序列:上游5'-CATCCTGCGTCTGGA CCTGG-3',下游 5'-TAATGTCACGCACGATTTCC-3'。硬脂酰辅酶A去饱和酶1(SCD1)引物序列:上游5'-CCTGAAGTTC ATCTGCACCA-3', 下 游 5'-TCAGCCACTCTTGCAGCTTT-3’;胆固醇7α-羟化酶(Cyp7α1)引物序列:上游5'-AGTTACTC TTCCCGTTTC-3',下游 5'-ATCACCTCCAGCCTCTAC-3'。根据目的基因和内参基因的比值计算各基因的相对表达水平。
1.7 统计学方法 采用SPSS11.0统计软件,计量资料以(±s)表示,两组之间的比较采用单因素方差分析,随后采用Tukey's检验。
2 结果
2.1 各组小鼠体质量和脂肪质量比较 见表1。与正常组比较,模型组小鼠体质量、肝脏脂肪及腹部脂肪明显增加,差异有统计学意义(P<0.05)。与模型组比较,姜黄组小鼠体质量、肝脏脂肪及腹部脂肪明显降低,差异均有统计学意义(P<0.05)。
表1 各组小鼠体质量和脂肪质量比较(±s) g
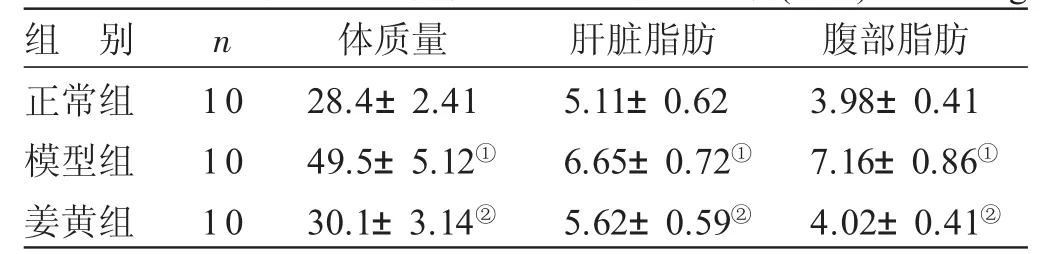
表1 各组小鼠体质量和脂肪质量比较(±s) g
与正常组比较,①P<0.05;与模型组比较,②P<0.05
组 别正常组模型组姜黄组n 1 0 1 0 1 0体质量2 8.4±2.4 1 4 9.5±5.1 2①3 0.1±3.1 4②肝脏脂肪5.1 1±0.6 2 6.6 5±0.7 2①5.6 2±0.5 9②腹部脂肪3.9 8±0.4 1 7.1 6±0.8 6①4.0 2±0.4 1②
2.2 各组小鼠血脂水平比较 见表2。与正常组比较,模型组小鼠血清TC、LDL-C水平明显增加,差异均有统计学意义(P<0.05),而血清TG水平没有明显变化。与模型组比较,姜黄组小鼠血清TC、LDL-C水平明显降低,HDL-C水平明显升高,差异均有统计学意义(P<0.05)。
表2 各组小鼠血脂水平比较(±s) mmol/L
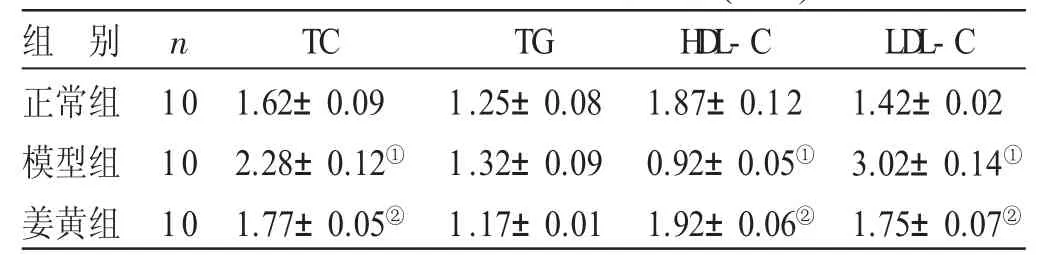
表2 各组小鼠血脂水平比较(±s) mmol/L
与正常组比较,①P<0.05;与模型组比较,②P<0.05
组 别正常组模型组姜黄组n 1 0 1 0 1 0 T C 1.6 2±0.0 9 2.2 8±0.1 2①1.7 7±0.0 5②T G 1.2 5±0.0 8 1.3 2±0.0 9 1.1 7±0.0 1 H D L-C 1.8 7±0.1 2 0.9 2±0.0 5①1.9 2±0.0 6②L D L-C 1.4 2±0.0 2 3.0 2±0.1 4①1.7 5±0.0 7②
2.3 各组小鼠肠道菌群构成比较 见表3。与正常组比较,模型组小鼠肠道菌群中乳酸菌、双歧杆菌显著降低,粪肠球菌显著升高,拟杆菌/厚壁菌的比值显著降低,差异均有统计学意义(P<0.05)。与模型组比较,姜黄组小鼠肠道菌群中乳酸菌、双歧杆菌显著升高,粪肠球菌显著降低,拟杆菌/厚壁菌的比值显著升高,差异均有统计学意义(P<0.05)。
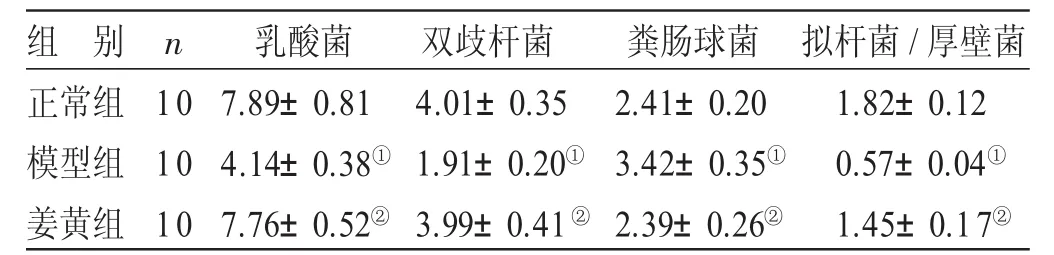
表3 各组小鼠肠道菌群构成比较
2.4 各组小鼠小肠FIAF mRNA和LPL mRNA表达水平比较见表4。与正常组比较,模型组小鼠小肠FIAF mRNA的表达水平降低,LPL mRNA的表达水平升高,差异均有统计学意义(P<0.05)。与模型组比较,姜黄组小鼠小肠FIAFmRNA的表达水平升高,LPL mRNA的表达水平降低,差异均有统计学意义(P<0.05)。
表4 各组小鼠小肠FIAFmRNA和LPLmRNA表达水平比较(±s)
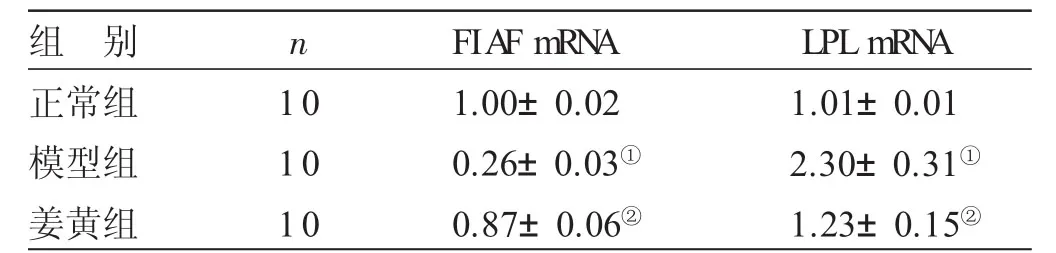
表4 各组小鼠小肠FIAFmRNA和LPLmRNA表达水平比较(±s)
与正常组比较,①P<0.05;与模型组比较,②P<0.05
组 别正常组模型组姜黄组n 1 0 1 0 1 0 F I A F m R N A 1.0 0±0.0 2 0.2 6±0.0 3①0.8 7±0.0 6②L P L m R N A 1.0 1±0.0 1 2.3 0±0.3 1①1.2 3±0.1 5②
2.5 各组小鼠肝脏脂肪生成相关因子水平比较 见表5。与正常组比较,模型组小鼠肝脏LPLmRNA和SCD1 mRNA表达水平显著升高,Cyp7α1 mRNA的表达水平明显降低,差异均有统计学意义(P<0.05)。与模型组比较,姜黄组小鼠肝脏LPL mRNA和SCD1 mRNA表达水平显著降低,Cyp7α1 mRNA的表达水平明显升高,差异均有统计学意义(P<0.05)。
表5 各组小鼠肝脏脂肪生成相关因子水平比较(±s)
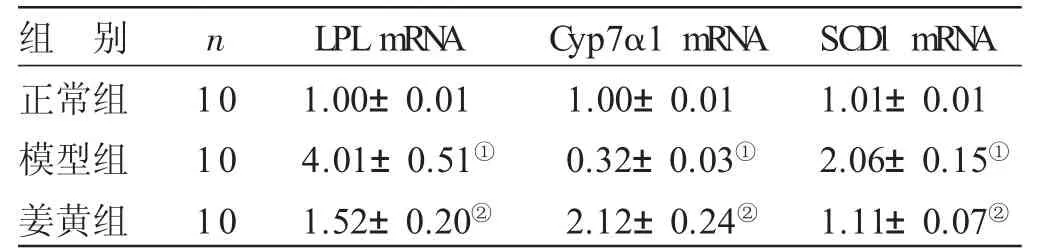
表5 各组小鼠肝脏脂肪生成相关因子水平比较(±s)
与正常组比较,①P<0.05;与模型组比较,②P<0.05
组 别正常组模型组姜黄组n 1 0 1 0 1 0 L P L m R N A 1.0 0±0.0 1 4.0 1±0.5 1①1.5 2±0.2 0②C y p 7 α 1 m R N A 1.0 0±0.0 1 0.3 2±0.0 3①2.1 2±0.2 4②S C D 1 m R N A 1.0 1±0.0 1 2.0 6±0.1 5①1.1 1±0.0 7②
3 讨论
众所周知,造成肥胖的因素即来自机体内部基因,也来自外界环境,通常内外因素共同所致[12]。本研究采用日常高脂肪的饮食构建小鼠内脏型肥胖模型。肠道菌群作为内环境因素的一种,能够加速机体内多糖的代谢和诱导机体脂肪的重新生成,最终起到改善体内脂肪储蓄的作用。小鼠日常的高脂肪饮食会导致肠道菌群失调[13]。本研究发现姜黄的摄入会明显改善小鼠的肠道菌群失调。肠道菌群构成的变化与机体脂质代谢的调节密切相关。拟杆菌属和厚壁菌属是影响机体能量代谢的主要菌属。研究表明肥胖型小鼠肠道中厚壁菌的数量偏高,而拟杆菌的数量则偏低[14]。本研究发现模型组小鼠肠道中拟杆菌/厚壁菌占比要低于正常组小鼠,此外姜黄可以改变肠道菌群构成,能够促使拟杆菌/厚壁菌比例达到平衡。上述研究结果表明姜黄具有一定的益生菌作用,对机体的脂质代谢产生积极的影响。
研究表明,多酚类物质可以与特定细菌的细胞膜相连接从而发挥一定的抑菌作用[15]。而不同的细胞结构也会导致抑菌作用有所不同,比如革兰氏阳性菌对多酚类物质要比革兰氏阴性菌更加敏感。一方面课题组在研究中发现白藜芦醇能明显抑制粪肠球菌的生长,另一方面,姜黄提取物白藜芦醇能够促进乳酸菌、双歧杆菌以及拟杆菌的生长。多酚类物质的抑菌作用机制并不能很好地解释本研究的结果,为此,需要阐明姜黄影响肠道菌群的其它作用机制。
FIAF在在肠上皮、脂肪、肝脏中均有表达,LPL是脂质吸收、转运、清除和代谢的关键酶,而FIAF是LPL的抑制剂;同时肠道微生物可以抑制FIAF在肠道上皮细胞的表达,减弱FIAF对LPL的活性的抑制[16]。本研究显示,模型组小鼠肠道中FIAFmRNA的表达水平低于姜黄组,LPL mRNA的表达水平高于姜黄组,表明姜黄可以提升小鼠肠道脂肪细胞中FIAFmRNA的表达,抑制肠道与肝脏中LPL mRNA的表达,从而控制脂滴的积聚而抑制脂肪的合成,改善机体的脂质代谢。Cyp7α1和SCD1在不饱和脂肪酸的合成和调节方面起着重要的作用[17]。Cyp7α1用于催化胆固醇的分解代谢,而敲除SCD1基因的小鼠体内的脂肪合成减少、体质量减轻、肝脏脂质沉积量降低[18]。在肝脏组织中,姜黄能够提升Cyp7α1的表达水平以及降低SCD1的表达水平,这说明姜黄能够通过控制脂肪酸和胆固醇分解代谢通路来改善机体能量代谢。本研究中姜黄能够抑制脂肪细胞中Cyp7α1 mRNA和SCD1 mRNA的表达,进一步抑制脂肪的合成,改善机体的脂质代谢。
综上所述,姜黄通过肠道菌群能够引起机体脂肪的重新生成,作用机制可能为通过提升小肠FIAF mRNA和Cyp7α1 mRNA的表达水平,抑制小肠和肝脏组织中LPL mRNA和SCD1 mRNA的表达来实现。
