川芎嗪对缺氧复氧诱导H9C2细胞损伤及凋亡的影响及其机制研究
2018-11-05岑晴云蔡清香刘慧慧吴财能
岑晴云,蔡清香,刘慧慧,吴财能
广州中医药大学第一附属医院,广东 广州 510405
心肌缺血再灌注损伤(Myocardial ischemia reperfusion injury,MIRI)是心脏缺血性疾病和心脏外科手术围术期常见的病理生理现象,由心肌细胞在冠脉灌注血流中断后再恢复灌注引起,导致心肌出现能量代谢障碍甚至血管无复流改变,临床上表现为心肌顿抑、心肌收缩及舒张功能下降及反复发作的心律失常事件[1]。因此,如何减少心肌缺血再灌注损伤已成为心脏血运重建治疗领域的新挑战。本研究拟通过体外培养H9C2心肌细胞,构建H9C2心肌细胞缺氧复氧损伤模型,观察川芎嗪(Tetramethylpyrazine,TMP)对缺氧复氧诱导H9C2细胞损伤及细胞凋亡的转导机制的影响,为TMP在心肌保护方面的应用提供理论依据。
1 材料与方法
1.1 细胞标本 H9C2心肌细胞株(北京中科院细胞中心)。
1.2 试剂及仪器 胎牛血清(杭州四季青公司);DMEM/F12培养基(美国Hyclone公司);乳酸脱氢酶(LDH)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);四甲基偶氮唑蓝(MTT)(美国Amresco公司);Annexin V-FITC/PI双标记法测细胞凋亡率试剂盒(奥地利Bender公司);紫外分光光度计(日本shmadzu UV-2401PC);酶标仪(澳大利亚Biocell公司);IP400三气培养箱(日本雅马拓公司)。
1.3 细胞制备 细胞复苏:取出存放于液氮冻存管中的H9C2细胞放入37℃水浴箱中解冻,无菌条件下吸出细胞悬液,置于离心管中,加入10 mL培养基后吹打悬浮细胞。细胞提取及孵育:将离心管置于离心机以700 r/min转速离心5 min,弃上清后加入含10%胎牛血清的DMEM培养基吹打,适当稀释后,以105/mL的密度移入培养瓶并置于培养箱(37℃,5%CO2)中孵育,2~3天传代1次。
1.4 模型制备 对照组(NC组):按正常流程孵育H9C2心肌细胞;缺氧复氧损伤组(HR组):将无血清DMEM/F12培养液移入待用的H9C2心肌细胞培养瓶中,调整三气培养箱参数为缺氧状态(37℃,95%N2,5%CO2,O2≤2%),再将培养瓶置于三气培养箱中孵育3 h,取出后放于恒温培养箱中再孵育3 h。TMP预处理L组(TMP-L组),M组(TMP-M组)和H组(TMP-H组):将无血清DMEM/F12培养液移入待用的H9C2心肌细胞培养瓶,再加入不同浓度TMP预处理后,缺氧及复氧的孵育流程同HR组。TMP-L组、TMP-M组、TMP-H组的浓度分别为60μg/mL、200μg/mL、800μg/mL[2]。
1.5 MTT比色法测定细胞存活率 用酶联免疫检测仪在490 nm波长处测定光吸收值(OD值)。与实验孔平行设不加细胞只加培养基的空白对照孔。细胞存活率=实验组光OD值/对照组OD值×100%[3]。
1.6 测定乳酸脱氢酶(LDH)活力 在缺氧前、缺氧末期及复氧末期,取不同处理组的细胞培养基,按检测试剂盒说明书操作。LDH活力(U/L)=(测定管A值-测定空白管A值)/(标准管A值-标准空白管A值)×标准管浓度(2μmol/mL)×1 000 mL×稀释倍数[4]。
1.7 测定SOD活性和MDA含量 收集H9C2细胞,经超声破碎处理后分别按照试剂盒说明测定SOD活性和MDA含量[5]。
1.8 检测心肌细胞凋亡 用Annexin V/FITC,PI双染流式细胞仪,按照试剂盒说明检测心肌细胞凋亡。
1.9 测定心肌细胞bcl-2 mRNA与bax mRNA表达水平 心肌细胞总RNA提取后,采用紫外光检测样品纯度和定量。
1.10 统计学方法 采用SPSS13.0软件包进行数据分析,计量资料以(±s)表示,多样本均数比较采用单因素方差分析,两变量比较采用Pearson积差相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞OD、LDH、SOD及MDA变化比较 见表1。与NC组比较,HR组细胞活力显著减弱,LDH释放量显著增加,SOD活性降低,MDA含量增多。与HR组比较,TMP-M组和TMP-H组细胞活力显著增强,LDH释放量显著减少;SOD活性增强,MDA含量下降,差异均有统计学意义(P<0.05)。与TMP-L组比较,TMP-M组与TMP-H组LDH释放量,MDA含量均下降(P<0.05),TMP-H组SOD活性升高(P<0.05)。与TMP-M组比较,TMP-H组OD值升高,MDA含量下降(P<0.05)。
表1 各组细胞OD、LDH、SOD及MDA变化比较(±s)

表1 各组细胞OD、LDH、SOD及MDA变化比较(±s)
与NC组比较,①P<0.05;与HR组比较,②P<0.05;与TMP-L组比较,③P<0.05;与TMP-M组比较,④P<0.05
组别N C组H R组T M P-L组T M P-M组T M P-H组O D值0.3 3±0.0 1 0.2 0±0.0 1①0.2 1±0.0 2 0.2 4±0.0 1②0.2 6±0.0 1④L D H(U/L)1 0.5±3.1 9 8.1±4.9①7 3.9±2.6 5 9.4±1.3②③4 2.5±3.7②③S O D(U/m g)1 7 8.8±7.4 1 1 7.5±6.1①1 2 3.6±1 2.8 1 3 7.0±7.4②1 4 6.0±1 2.8②③M D A(n m o l/m g)0.9±0.2 4.4±0.1①3.9±0.2 2.8±0.3②③2.0±0.3②③④
2.2 各组细胞凋亡率、bcl-2 mRNA、bax mRNA表达水平比较 见表2。与NC组比较,HR组出现大量心肌细胞凋亡,bcl-2 mRNA表达显著下降,bax mRNA表达显著升高,差异均有统计学意义(P<0.05);与 HR组比较,TMP-L组、TMP-M组和TMP-H组心肌细胞凋亡率及bcl-2 mRNA表达显著下降,bax mRNA表达显著升高,差异均有统计学意义(P<0.05)。与TMP-L组比较,TMP-M组bcl-2 mRNA表达显著升高(P<0.05);TMP-H组细胞凋亡率及bax mRNA表达下降,bcl-2 mRNA表达上升(P<0.05)。与TMP-M组比较,TMP-H组细胞凋亡率及bax mRNA表达下降,bcl-2 mRNA表达上升(P<0.05)。
表2 各组细胞凋亡率、bcl-2 mRNA、bax mRNA表达水平比较(±s)
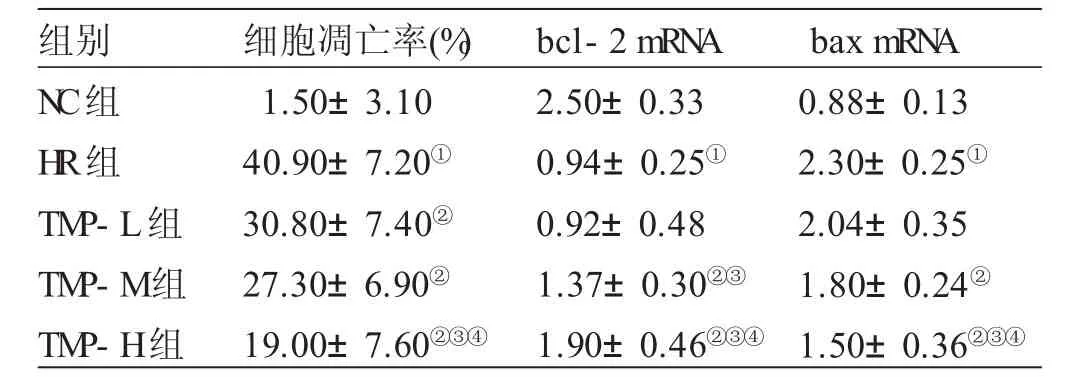
表2 各组细胞凋亡率、bcl-2 mRNA、bax mRNA表达水平比较(±s)
与NC组比较,①P<0.05;与HR组比较,②P<0.05;与TMP-L组比较,③P<0.05;与TMP-M组比较,④P<0.05
组别N C组H R组T M P-L组T M P-M组T M P-H组细胞凋亡率(%)1.5 0±3.1 0 4 0.9 0±7.2 0①3 0.8 0±7.4 0②2 7.3 0±6.9 0②1 9.0 0±7.6 0②③④b c l-2 m R N A 2.5 0±0.3 3 0.9 4±0.2 5①0.9 2±0.4 8 1.3 7±0.3 0②③1.9 0±0.4 6②③④b a x m R N A 0.8 8±0.1 3 2.3 0±0.2 5①2.0 4±0.3 5 1.8 0±0.2 4②1.5 0±0.3 6②③④
3 讨论
随着冠脉支架植入术、冠状动脉溶栓术、经皮腔内冠状动脉成形术等心脏介入手术的广泛开展,冠心病患者的生存率较以前显著提高,但伴随的再灌注损伤仍严重影响后期心肌功能的恢复,因此解决心肌缺氧后复氧产生的再灌注损伤对临床具有重要的意义。目前的体外研究发现,氧自由基(OFR)的大量释放、细胞凋亡、钙超载是MIRI过程极为重要的病理生理改变[6~7]。此外,心肌酶如LDH的大量释放则反映了心肌的损伤程度,已被作为常用的检测指标。
OFR在心肌细胞缺血状态下被大量释放,诱发失控的氧化应激反应,进而损伤细胞膜;更为重要的是OFR具有强烈的引发膜脂质过氧化作用,生成终产物MDA,进一步加剧膜的损伤,使得LDH透过细胞膜被大量释放入血,心肌细胞活力下降[8]。机体基于氧化-抗氧化的平衡机制,SOD作为体内重要的抗氧化物酶亦释放增多,用以清除体内过度释放的自由基,减少细胞膜的损伤。因此MDA常被用于间接反映机体的氧化损伤,而SOD反映抗氧化能力。本研究发现H9C2细胞缺氧复氧后细胞活力显著减弱,LDH释放量显著增加,提示心肌细胞大量损伤;同时MDA含量明显增加,SOD活性显著降低,说明心肌细胞损伤与其膜脂过氧化有关。
机体氧化应激状态下大量产生的OFR除损伤细胞膜,还是细胞凋亡重要的启动因子,同时钙超载亦促进细胞凋亡,细胞凋亡增多则进一步加重MIRI。研究发现,再灌注期通过抑制心肌凋亡可显著减少心肌梗塞面积、改善心肌收缩功能[9]。心肌细胞凋亡受多基因调控,其中bax、bcl-2基因被认为是最重要的2个基因。bax与bcl-2基因结构相似,但作用相反。Bax基因促进细胞凋亡,而bcl-2表达产物可阻断bax、fas等基因产物激活细胞凋亡信号传递系统的最后通路,从而促进细胞成活[10~11]。本研究发现,与NC组比较,HR组出现大量心肌细胞凋亡,TMP组心肌细胞凋亡率则较HR组显著下降。与NC组比较,HR组和TMP组的bcl-2表达均显著下降,bax表达均显著升高。而随着川芎嗪预处理浓度的提升,bcl-2的表达呈上升趋势,bax的表达则呈下降趋势,差异有统计学意义(P<0.05)。
TMP是中药川芎的有效成分,具有保护血管内皮、活血化瘀、抗血小板聚集等作用。动物实验发现,TMP对MIRI具有保护作用,其主要机制有:①促进一氧化氮(NO)合成,抑制内皮素(ET)水平,保护血管内皮并逆转其功能紊乱[12~13];②清除OFR,减少脂质过氧化,减轻心肌能量代谢障碍[12~14];③减轻缺血组织细胞的钙超载[12~13];④降低细胞缺血再灌注损伤后肿瘤坏死因子的表达水平[13~14]。本研究发现,与HR组比较,TMP-L组、TMP-M组、TMP-H组LDH、MDA含量均明显降低,细胞活力和SOD活性明显升高,其中TMP-H组差异最为显著。bcl-2表达升高的同时bax的表达下降,心肌细胞凋亡率下降,提示TMP在缺血再灌注损伤的心肌细胞中能提高细胞抗氧化能力,降低细胞损伤程度。
本研究利用H9C2心肌细胞建立缺氧复氧损伤模型和TMP预处理模型,并通过细胞活力等一系列指标评估心肌细胞的损伤程度,结果表明一定浓度范围内的TMP预处理可减轻心肌细胞的缺氧复氧损伤,且随TMP预处理浓度的增加心肌损伤呈减少趋势;其作用可能与提高心肌细胞活力、增强SOD活性、降低LDH释放量、减少MDA生成、抑制心肌细胞凋亡有关,其具体机制及进一步的临床心肌保护应用尚需进一步研究。
