白头翁汤正丁醇提取物对白念珠菌细胞壁抑制作用研究
2018-11-03胡唐玲施高翔徐志庆段强军邵菁汪天明吴大强汪长中
胡唐玲 施高翔 徐志庆 段强军 邵菁 汪天明 吴大强 汪长中,3
(1.安徽省六安市第二人民医院临床药学部,六安 237008;2.安徽中医药大学中西医结合学院,合肥 230012;3.中药复方安徽省重点实验室,合肥 230012)
抗真菌药物根据对真菌作用靶点分为:以细胞壁为靶点的 (如棘白菌素类),以细胞膜为靶点的 (如唑类)和以DNA为靶点的灰黄霉素等。由于人类细胞无细胞壁,故基于差异毒力的考虑,以细胞壁为靶点的抗真菌药物的研发往往具有良好的应用前景。在临床上对外阴阴道念珠菌病有显著疗效的中药复方白头翁汤对白念珠菌的菌丝、生物膜等毒力因子有抑制作用[1]。本课题组发现白头翁汤的正丁醇提取物 (Butyl alcohol extract of BaiTouWeng decoction,BAEB)抗白念珠菌效果显著[2],对是否通过菌体细胞壁发挥抗菌作用尚不明确。
1 材料与方法
1.1 菌株
白念珠菌C.albicansSC5314,由第二军医大学药学院姜远英教授惠赠。
1.2 药物
白头翁汤按国家中医药管理局统一组织编审的普通高等类教育中医类规划教材《方剂学》中的药物 (白头翁、黄柏、黄连、秦皮)组成,购于安徽中医药大学第一附属医院中药房,并经鉴定。白头翁汤正丁醇提取物的提取方法按照张梦翔等的提取方法,实验所称BAEB为其干粉量,实验中所用BAEB剂量参照张梦翔等所摸索的BAEB剂量[3];卡泊芬净 (上海源叶生物科技有限公司)。
1.3 试剂
刚果红 (CR, solarbio);荧光白 (CFW, sigma);一抗小鼠抗β-1,3-葡聚糖IgG (Biosupplies Australia Pty Ltd);二抗Cy3标记的山羊抗小鼠,IgG (abbkine);0.1%的苯胺蓝溶液工作液 (溶于pH为9.6的甘氨酸缓冲液,solaibio);PBS缓冲液 (pH7.0±2.0,Leagene);二甲基亚砜 (国药集团);RPMI-1640培养基 (life technologies公司);蜗牛酶 (Sigma)。
1.4 仪器
恒温培养箱 (上海博迅实业公司);倒置荧光显微镜 (Olympus IX81,Japan);流式细胞仪 (BD AccuriC6);多功能酶标仪 (ABI Spectra Max M2e,美谷分子仪器 (上海)有限公司);ABI7500荧光定量PCR仪 (美国应用生物系统公司);透射电子显微镜 (EM-1230,JEOL,日本),切片机 (瑞典,LKB-NOVA型)。
1.5 菌液配制
从4℃保存的YPD培养平板上挑取单菌落白念珠菌,接种至液体沙氏培养液,37℃振荡培养箱中过夜培养,离心收集菌体,血细胞计数板计数,RPMI 1640培养液稀释至2×106CFU/mL备用。
1.6 Spot assay检测白念珠菌细胞活性[4]
从4℃保存的YPD培养平板上挑取单菌落白念珠菌,接种至液体沙氏培养液,37℃摇床中过夜培养,离心收集菌体,血细胞计数板计数,RPMI 1640培养液稀释至2×106CFU/mL备用。将菌液稀释成2×105CFU/mL,再按10倍稀释直至2×101CFU/mL,取100 μL不同浓度菌液分别与100 μL终浓度为0、256、512和1 024 μg/mL的BAEB和终浓度为0.125 μg/mL的阳性对照药卡泊芬净混合,依次取5 μL分别点种在固体沙氏培养基上。取100 μL不同浓度菌液分别与100 μL RPMI 1640培养液混合,依次取5 μL分别点种在刚果红 (100 μg/mL)固体沙氏培养基上和荧光白 (100 μg/mL)固体沙氏培养基上。37℃培养48 h后取出,观察CFU生成情况并拍照。
1.7 流式细胞仪检测白念珠菌细胞壁中β-1,3-葡聚糖[5-6]
取1 mL (2×106CFU/mL)菌液分别与1 mL终浓度为0、256、512、1 024 μg/mL BAEB和终浓度为0.003 9 μg/mL的卡泊芬净于6孔板中混合,37℃,培养12 h后,离心收集细胞,无菌PBS洗涤细胞三次,用2%BSA的PBS室温封闭1 h,与一抗4℃孵育过夜,在PBS中严格洗涤除去未结合的一抗,加入二抗30℃孵育1 h,PBS洗涤细胞,将沉淀重新悬浮于1 mL无菌水中,用流式细胞仪BD AccuriC6检测。
1.8 酶标仪检测白念珠菌细胞壁β-1,3-葡聚糖
取1 mL (2×106CFU/mL)菌液分别与1 mL终浓度为0、256、512、1 024 μg/mL BAEB和终浓度为0.003 9 μg/mL的卡泊芬净于试管中混合,37℃,培养12 h后,离心收集细胞,无菌PBS洗涤细胞3次,加入0.1%的苯胺蓝溶液工作液,于80℃避光反应15 min,室温冷却30 min,吸入96孔板中,用酶标仪在398 nm激发波长和508 nm发射波长下进行荧光测定[7-9]。
由于过去长期存在过量、盲目施肥,导致农田土壤板结、酸化、盐渍化等问题日益严重。当前,农业耕地中有益微生物严重缺失,“土壤修复”成为涉农行业,尤其是化肥行业关注、发力的新领域。生产环保、高效、功能的肥料成为化肥生产企业的新责任。
1.9 流式细胞仪检测白念珠菌细胞壁中几丁质[6]
取1 mL (2×106CFU/mL)菌液分别与1 mL终浓度为0、256、512、1 024 μg/mL BAEB和终浓度为0.003 9 μg/mL的卡泊芬净于6孔板中混合,37℃,培养12 h后,离心收集细胞,无菌PBS洗涤细胞3次,用4%的甲醛固定40 min,然后用10 mg/L的CFW在37℃染色30 min,用PBS洗涤细胞3次,用流式细胞仪BD AccuriC6检测。
1.10 qRT-PCR检测细胞壁生物合成相关基因的表达[10]
总RNA的提取 2 mL菌液 (2×106CFU/mL)与2 mL终浓度分别为0、256、512、1 024 μg/mL BAEB混合,37℃孵育6 h后,离心收集菌体,用无菌PBS冲洗3次后进行总RNA提取,调节RNA浓度,使模板量一致,具体操作方法参照ToyoBo公司MagExtractor-RNA-提取试剂说明书进行。
引物的设计与合成 基因序列从NCBI获得,并用Oligo 7.0软件设计所需引物,委托上海生工合成引物,各引物情况见表1。

表1 各引物序列表
逆转录 cDNA 6 μL RNA预变性 (65℃ 5 min,4℃ 1 min),后加入混合液 (4×DNA Master Mix 55 μL和gDNA Remover 1.1 μL)2 μL,5RT-Master MixII 2 μL混合后进行逆转录,反应完成后将cDNA稀释10倍备用。
实时荧光定量PCR反应 采用SYBR荧光法,反应体系25 μL:2×SYBR Green RealtimePCR 12.5 μL,PCR Forward Primer (10 mol/L)1 μL,PCR Reverse Primer 1 μL,cDNA 0.5 μL,ddH2O 10 μL在ABI7500荧光定量PCR仪上进行扩增反应。内参基因为ACT1每个样品均设置3个重复组,实验重复3次。
定量分析 实时荧光定量PCR分别测定目的基因及内参ACT1的Ct值,实验结果取其平均值,基因表达水平用倍数变化来表示 (2-△△Ct法)。
1.11 透射电镜观察白念珠菌细胞壁结构[7]
取1 mL (2×106CFU/mL)菌液分别与1 mL终浓度为0、256、512、1 024 μg/mL BAEB和终浓度为0.003 9 μg/mL的卡泊芬净混合,37℃,培养12 h后,离心收集细胞,取白念珠菌1 mm3大小,置1 mL离心管内离心10 min (2 000 r/min),固定于2.5%戊二醛 (4℃)4~6 h,再固定于1%锇酸1 h,30%、50%乙醇、70%醋酸铀乙醇饱和液、80%、95%乙醇、无水乙醇脱水,浸环氧丙烷30 min,浸环氧丙烷∶环氧树脂1∶1,2 h,环氧丙烷∶环氧树脂1∶2,1 h,浸环氧树脂 (Epon812)2 h,入45℃烤箱中12 h,65℃烤箱中48 h,取出包埋好的组织进行超薄切片 (片厚70 nm),将切片水洗后放入醋酸铀饱和水溶液中染色30 min。双蒸水洗3次,各15 min,入枸橼酸铅染液染色15 min,双蒸水洗3次各10 min,用日产JEM-1230型透射电镜观察。
1.12 统计学处理
2 结 果
2.1 BAEB对白念珠菌细胞活性的影响
和空白对照组 (control)相比,荧光白 (CFW)组、刚果红 (CR)组、卡泊芬净组和BAEB干预组的白念珠菌菌落数均随着菌体浓度递减而逐渐减少,且随着BAEB浓度的增加,白念珠菌菌落数逐渐减少,活性降低 (见图1)。
2.2 BAEB对白念珠菌细胞壁β-1,3-葡聚糖的影响
流式细胞仪检测用一抗和BAEB干预后的白念珠菌细胞壁β-1,3-葡聚糖结合,加入二抗扩大信号所产生的荧光强度。与空白对照组相比,512、1 024 μg/mL BAEB组荧光逐渐增强,且有显著性差异 (见图2)。
酶标仪检测苯胺蓝和BAEB作用后的白念珠菌细胞壁的β-1,3-葡聚糖结合所产生的荧光强度。与空白对照组相比,256、512、1 024 μg/mL BAEB组荧光逐渐增强,且512、1 024 μg/mLBAEB组有显著性差异 (见图3)。
2.3 BAEB对白念珠菌细胞壁几丁质影响
流式细胞仪检测CFW和BAEB干预后的白念珠菌细胞壁的几丁质结合所产生的荧光强度。与空白对照组相比,256、512、1 024 μg/mL BAEB组荧光逐渐增强,且512、1 024 μg/mL BAEB组有显著性差异 (见图4)。
2.4 BAEB对白念珠菌细胞壁合成相关基因表达的影响
qRT-PCR结果显示,256 μg/mL BAEB组FKS1、CHS1、CHS2、CHS3、CHS8分别下调6.60、1.60、8.48、9.52、9.30倍;512 μg/mL BAEB组FKS1、CHS1、CHS2、CHS3、CHS8分别下调11.34、9.46、28.32、37.07、20.99倍;1 024 μg/mL BAEB组FKS1、CHS1、CHS2、CHS3、CHS8分别下调5.57、2.96、3.29、4.47、3.00倍 (见图5)。
2.5 透射电镜观察BAEB干预后白念珠菌细胞壁的变化
空白对照组细胞壁结构比较完整,细胞壁厚度正常。256、512、1 024 μg/mL BAEB组和卡泊芬净组细胞壁结构都有破损,细胞壁厚度较薄 (见图6)。
3 讨 论
细胞壁是白念珠菌最外层结构,完整的细胞壁呈刚性结构,可以作为物理化学屏障保护细胞,并可以调节营养物质的吸收和代谢产物的分泌。白念珠菌细胞壁主要组分是多糖,包括β-葡聚糖、几丁质、甘露聚糖等,其中最外层大多是甘露聚糖和甘露糖蛋白,β-葡聚糖和几丁质则构成细胞壁的骨架[11]。白念珠菌感染时,正是通过其细胞壁的主要组分与宿主细胞上相应受体的相互作用介导对靶细胞的损伤。因此,研究针对细胞壁的抗白念珠菌药物对于防治白念珠菌感染具有重要意义。
荧光白 (CFW)、刚果红 (CR)、卡泊芬净均是真菌细胞壁抑制剂。实验结果显示,和空白对照组 (control)相比,含CFW、CR、卡泊芬净培养基上的白念珠菌菌落明显减少;在含BAEB的培养基上,随着BAEB浓度递增,白念珠菌菌落逐渐减少,表明BAEB对白念珠菌活性也有抑制作用。
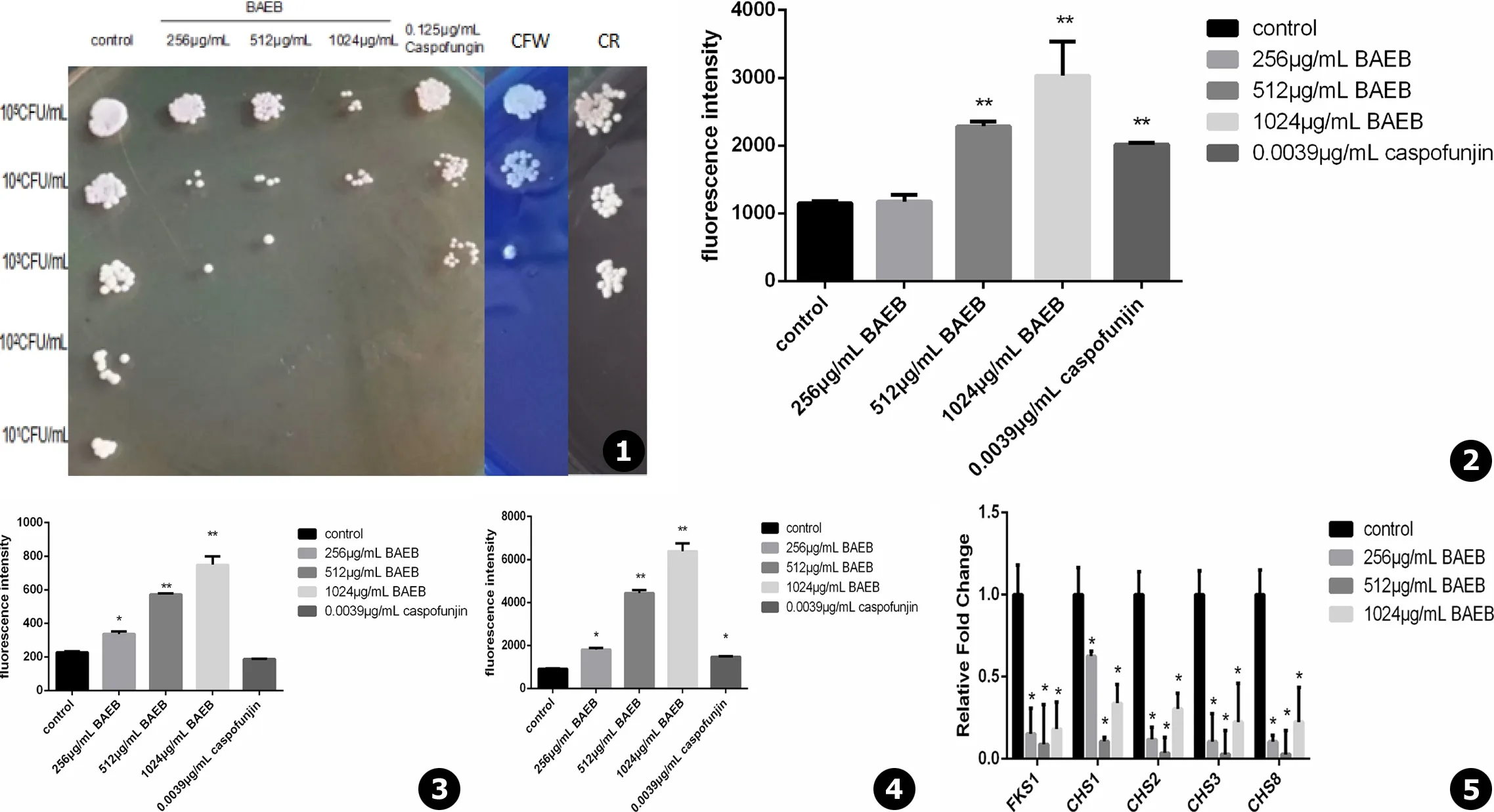
图1BAEB对白念珠菌细胞活性的影响图2抗β-1,3-葡聚糖抗体与β-1,3-葡聚糖结合的荧光强度 (**P<0.01)图3苯胺蓝与β-1,3-葡聚糖结合荧光的强度 (*P<0.05;**P<0.01)图4CFW与几丁质结合荧光的强度 (*P<0.05;**P<0.01)图5qRT-PCR法检测BAEB对白念珠菌细胞壁β-1,3-葡聚糖及几丁质生物合成相关基因表达的影响 (*P<0.05)
Fig.1Effect of BAEB on activity ofCandidaalbicansFig.2Fluorescence intensity of anti-β-1,3-glucan antibody binding to β-1,3-glucan (**P<0.01)Fig.3Fluorescence intensity of aniline blue combine β-1,3-glucan (*P<0.05; **P<0.01)Fig.4Fluorescence intensity of CFW combine chitin (*P<0.05; **P<0.01)Fig.5The effects of BAEB on β-1,3-glucan and chitin biosynthesis related gene expression inCandidaalbicanscell wall by qRT-PCR (*P<0.05)
流式细胞术检测到,用Cy3标记的二抗和一抗 (即抗β-1,3-葡聚糖抗体)结合后,随着BAEB浓度的增加,荧光强度逐渐增强。苯胺蓝和白念珠菌β-1,3-葡聚糖特异性结合,显示荧光[11],酶标仪检测显示,随着BAEB浓度的增加,荧光强度逐渐增强。CFW和白念珠菌细胞壁的几丁质有很强的亲和力,可以显示荧光[12],流式细胞术检测发现,随着BAEB浓度的增加,荧光强度也逐渐增强。上述结果表明,BAEB干预后,有可能破坏了白念珠菌细胞壁结构的完整性 (integrity),从而增加了β-1,3-葡聚糖和几丁质的暴露。从宿主-病原体相互作用角度来说,宿主固有免疫细胞表面的模式识别受体 (PRR)既可以识别白念珠菌表面的甘露聚糖和甘露糖蛋白,也可以识别白念珠菌细胞壁暴露的内层的β-葡聚糖和几丁质,而Dectin-1即为β-1,3-葡聚糖的高亲和性受体,可介导识别和吞噬白念珠菌[13-14]。因此,药物作用所导致的白念珠菌细胞壁β-1,3-葡聚糖和几丁质的暴露在诱导抗真菌免疫应答中发挥了潜在的重要作用。
通过抑制或干扰白念珠菌细胞壁成分的生物合成能有效地抑制或杀灭真菌。FKS1是白念珠菌葡聚糖合酶调控基因[15-16],CHS1,2,3,8是白念珠菌几丁质合酶相关基因[17-20]。qRT-PCR检测显示,BAEB干预后均能使这些基因下调,且有统计学差异 (P<0.05),表明BAEB可能会抑制白念珠菌细胞壁葡聚糖和几丁质的生物合成。
TEM可直接观察白念珠菌细胞壁结构的完整性。空白对照组白念珠菌的细胞壁厚度正常,结构完整,而256、512、1 024 μg/mL BAEB组细胞壁厚度变薄,并且结构有破损,提示BAEB可以破坏细胞壁而损伤白念珠菌。
本研究显示,BAEB既能通过影响白念珠菌细胞壁结构的完整性引起β-1,3-葡聚糖和几丁质的暴露,也能抑制β-1,3-葡聚糖合酶、几丁质合酶生物合成相关基因的表达,因此表明BAEB能从多个角度靶向细胞壁进而抑制白念珠菌,为白念珠菌病治疗提供可靠的依据。

图6BAEB对白念珠菌细胞壁结构的影响 (每组左图为30 000×,右图为50 000×):A.空白对照组;B.256 μg/mL BAEB;C.512 μg/mL BAEB;D.1 024 μg/mL BAEB;E.0.00 39 μg/mL卡泊芬净
Fig.6Candidaalbicanscell wall structure after BAEB intervention (the left picture of each group is magnified by 30 000× and the right picture is magnified by 50 000×): A.control; B.256 μg/mL BAEB; C.512 μg/mL BAEB; D.1 024 μg/mL BAEB; E.0.003 9 μg /mL caspofungin
