谷氨酸清洁发酵工艺研究
2018-11-03户红通徐庆阳
户红通,徐 达,徐庆阳,2,3*,陈 宁,2,3
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.天津市氨基酸高效绿色制造工程实验室,天津 300457)
现有谷氨酸发酵的主要问题是发酵液色泽深、黏度大、杂质多,造成起泡严重、溶解氧不足、传质困难、发酵过程不稳定[1]。其中的主要原因是发酵培养基中添加大量的玉米浆和豆粕水解液这类色素深、杂质多的发酵氮源,同时对于“生物素亚适量型”谷氨酸发酵,玉米浆中生物素的波动也造成了发酵的不稳定。
谷氨酸发酵的氮源主要来源于玉米浆和豆粕水解液,玉米浆和豆粕水解液含有丰富的有机氮源、多种维生素及促进菌体生长的微量元素等多种生长因子,能够促进菌体的快速生长并维持较高的菌体酶活力[2]。但在谷氨酸的发酵过程中并不能大量添加玉米浆,主要原因是玉米浆中含有较多的生物素,对于“生物素亚适量型”谷氨酸生产菌而言,过多的生物素会限制菌体细胞膜的通透性,使得谷氨酸非生产菌向谷氨酸生产菌的转变不完全,发酵产酸较低[3-4]。另外,玉米浆和豆粕水解液中含有大量的色素,尤其是玉米浆中还有大量的不可被菌体利用的蛋白质、少量的淀粉、纤维素以及不可被菌体利用的有毒有害物质[5-7]。这些物质的大量存在,不但引起发酵液黏度大、易起泡、溶氧效率低、搅拌功率低以及生物素含量不稳定等问题,同时引起发酵过程难于控制、发酵不稳定,而且还进一步给后续的谷氨酸发酵提取带来困难,增加了生产成本[8]。因此,需要对谷氨酸发酵培养基进行调整,寻找杂质、色素等较少且营养丰富的有机氮源,对玉米浆和豆粕水解液进行替代是主要的解决方法[9]。
本研究在对玉米浆和豆粕水解液主要成分充分了解的基础上,进行了发酵氮源的近似等效替代。首先使用生物氮素(含有丰富的氨基酸、蛋白质及小分子肽等)作为氮源,维生素B1(vitamin B1,VB1)作为生长因子,生物素使用定量配制的溶液添加,由于所使用的谷氨酸生产菌是甲硫氨酸缺陷型菌株[10],故另外添加一定量的甲硫氨酸,其他培养基成分维持不变,采用单因素及正交试验法,确定了清洁培养基的最佳配比,最终得到谷氨酸清洁发酵培养基。清洁发酵培养基与对照发酵培养基相比,其最大的优点在于大大减少了玉米浆和豆粕水解液中的大量杂质、色素以及毒害物质,所得的发酵液澄清度大大增加,黏度降低,泡沫少,使得发酵液溶氧效率得到提高,搅拌功率降低,发酵过程更加容易控制,生物素的定量添加使得发酵产酸更加稳定,转化率和产酸量也得到了提高。本研究的目的在于获得相对清洁的发酵培养基,减少杂质含量、提高发酵液质量和提高发酵稳定性,最终也相应地提高了发酵产酸和糖酸转化率。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
生物素亚适量型黄色短杆菌(Brevibacterium flavum)GDK-168:由天津科技大学代谢工程研究室保藏。
1.1.2 试剂
生物氮素(总氮≥11.0%,氨基酸态氮≥3.0%,水分≤7.0%,灰分≤10.0%):麦迪尔生物科技江苏有限公司;葡萄糖、Na2HPO4、MgSO4、KCl、VB1、VH(生物素)、MnSO4、FeSO4、甲硫氨酸、豆粕水解液、玉米浆:国药集团化学试剂有限公司。所有试剂均为分析纯或生化试剂。
1.1.3 培养基
对照发酵培养基:葡萄糖80g/L,Na2HPO4·12H2O2.83g/L,MgSO4·7H2O 1.83g/L,KCl 1.33g/L,MnSO4·H2O 2.33 mg/L,VB10.233 mg/L,FeSO4·7H2O 2.33 mg/L,糖蜜1.1 g/L,豆粕水解液10 mL/L,玉米浆4 mL/L。121℃高压灭菌15 min。
清洁发酵培养基:葡萄糖80g/L,Na2HPO4·12H2O2.83g/L,MgSO4·7 H2O 1.85 g/L,KCl 1.5 g/L,MnSO4·H2O 2.5 mg/L,FeSO4·7H2O 2.5 mg/L,生物氮素、VB1、VH(生物素)及甲硫氨酸。121℃高压灭菌15 min。
1.2 仪器与设备
LDZH-100KBS立式压力蒸汽灭菌器:上海申安医疗机械厂;MCGS 5 L不锈钢机械搅拌发酵罐、MCGS 30 L不锈钢机械搅拌发酵罐:上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪:山东省科学院生物研究所;LC-20A高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;A300氨基酸分析仪:德国安米诺西斯公司。
1.3 方法
1.3.1 单因素试验优化培养基组分
(1)生物氮素对谷氨酸发酵的影响
维持部分对照谷氨酸发酵培养基成分(葡萄糖80 g/L,Na2HPO4·12H2O2.83g/L,KCl1.33g/L,MnSO4·H2O2.33mg/L,FeSO4·7H2O 2.33mg/L,MgSO4·7H2O 1.83g/L)不变(下同),在生物素5 μg/L、VB16 mg/L、甲硫氨酸1.0 g/L的条件下,考察不同生物氮素添加量(0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)对谷氨酸发酵的影响。
(2)生物素对谷氨酸发酵的影响
在生物氮素最佳添加量、VB16 mg/L、甲硫氨酸1.0g/L的条件下,考察不同生物素添加量(3 μg/L、5 μg/L、7 μg/L、9 μg/L、11 μg/L)对谷氨酸发酵的影响。
(3)VB1对谷氨酸发酵的影响
在最佳生物氮素添加量、最佳生物素添加量、甲硫氨酸1.0 g/L的条件下,考察不同VB1添加量(2 mg/L、4 mg/L、6 mg/L、8 mg/L、10 mg/L)对谷氨酸发酵的影响。
(4)甲硫氨酸对谷氨酸发酵的影响
在最佳生物氮素添加量、最佳生物素添加量、最佳VB1添加量的条件下,考察不同甲硫氨酸添加量(0.4g/L、0.6g/L、0.8 g/L、1.0 g/L、1.2 g/L)对谷氨酸发酵的影响。
1.3.2 正交试验优化培养基组分
在单因素试验的基础上,以生物氮素(A)、生物素(B)、VB1(C)和甲硫氨酸(D)添加量为研究因素,以OD600nm值、谷氨酸产量和糖酸转化率为考察指标,选用L9(34)正交试验表对谷氨酸清洁培养基的关键影响因素进行研究。正交试验因素与水平见表1。

表1 谷氨酸清洁发酵培养基组分优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for medium composition optimization of glutamic acid clean fermentation
1.3.3 检测分析方法
OD600nm值采用发酵液稀释100倍后测定的数据再乘以100表示。谷氨酸产量及发酵参数的测定参见参考文献[11-12];有机酸的测定使用高效液相色谱分析仪进行。取1mL发酵液于1.5mL离心管中,13000r/min离心2min,取上清液稀释适当倍数,然后用0.22 μm微孔滤膜过滤,使用液相色谱仪进行检测,色谱条件:色谱柱为Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm),0.05 mol/L硫酸缓冲液洗脱,柱温30℃,流速0.5 mL/min,检测波长210 nm;采用氨基酸分析仪测定发酵液中氨基酸的含量,发酵液的处理与有机酸相同,稀释适当倍数后,然后用0.22 μm微孔滤膜过滤,使用氨基酸分析仪进行定量检测,色谱条件:色谱柱为LCAK06/Na色谱柱(4.6 mm×150 mm),缓冲液A(乙腈∶水=1∶1)和缓冲液B(4.1 g/L乙酸钠)洗脱,柱温57℃,流速0.45 mL/min,检测波长570 nm和440 nm。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 生物氮素对谷氨酸清洁发酵的影响
在VH(生物素)为5 μg/L,VB1为6 mg/L,甲硫氨酸为1.0 g/L的条件下,不同生物氮素添加量对谷氨酸发酵的影响见图1。由图1可以看出,随着生物氮素的添加量在0.5~1.5 g/L范围内不断增加,OD600nm值、谷氨酸产量和糖酸转化率都呈上升趋势;当生物氮素添加量为1.5 g/L时,OD600nm值为82、谷氨酸产量为165 g/L、糖酸转化率为68%;但当生物氮素添加量>1.5g/L之后,三者的值都呈现波动趋势,而不是继续增加。分析可知,在现有的发酵条件下,生物氮素的添加量为1.5 g/L时能够提供足够的发酵氮源,不再是发酵的限制性底物,同时,生物量、谷氨酸产量和糖酸转化率也达到了较高的值。过多的氮源不但造成浪费,而且会改变谷氨酸的代谢途径[13],引起异常发酵。因此,选取1.5 g/L作为生物氮素的最佳添加量。
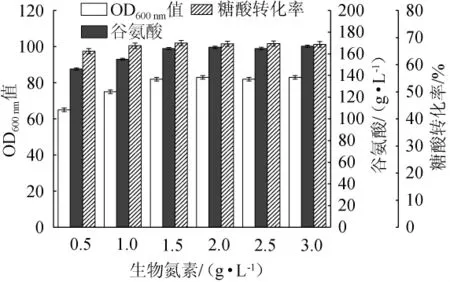
图1 生物氮素添加量对谷氨酸清洁发酵的影响Fig.1 Effect of biological nitrogen addition on clean fermentation of glutamic acid
2.1.2 生物素对谷氨酸清洁发酵的影响
在生物氮素最佳添加量为1.5 g/L,VB1为6 mg/L,甲硫氨酸为1.0g/L的条件下,不同添加量生物素对谷氨酸发酵的影响见图2。由图2可以看出,随着生物素添加量在3~7μg/L范围内的增加,OD600nm值不断增加,谷氨酸产量和糖酸转化率增加的更快;当生物素添加量为7 μg/L时,OD600nm值为82、谷氨酸产量为166 g/L、糖酸转化率为67.8%;当生物素量>7 μg/L之后,OD600nm值增长缓慢,而谷氨酸产量和糖酸转化率则快速下降。分析可知,由于生物素作为多种尤其是催化脂肪酸合成的乙酰辅酶A羧化酶、丙酮酸羧化酶等的辅酶,能够参与细胞膜的合成、CO2的固定和羧化过程[14]。当其添加量增加时,CO2固定反应加强,进一步促进三羧酸循环(tricarboxylic acid cycle,TCA),能够加快菌体的生长,同时增加谷氨酸产量和糖酸转化率。但是当生物素的添加量超过“亚适量”范围后,细胞膜的合成量将大大增加,大量的菌体不能或不完全能实现从非谷氨酸积累型向谷氨酸积累型细胞的转变[15]。因此,谷氨酸的分泌量和糖酸转化率开始下降,综合衡量,选取7 μg/L作为最佳生物素的添加量。

图2 生物素添加量对谷氨酸清洁发酵的影响Fig.2 Effect of biotin addition on clean fermentation of glutamic acid
2.1.3 VB1对谷氨酸清洁发酵的影响
在生物氮素最佳添加量为1.5 g/L,生物素最佳添加量为7 μg/L,甲硫氨酸为1.0 g/L的条件下,添加不同量VB1对谷氨酸发酵的影响见图3。由图3可以看出,随着VB1添加量在2~8 mg/L的范围内增加,OD600nm值、谷氨酸产量和糖酸转化率呈上升趋势,尤其是后两者快速增加;当VB1添加量为8 mg/L时,OD600nm值为81、谷氨酸162 g/L和糖酸转化率为67.5%;而VB1的添加量>8 mg/L后,OD600nm值不再继续增加,而谷氨酸产量和糖酸转化率持续上升,但增加速度变慢。VB1作为谷氨酸生产菌的多种生长因子,它是多种关键酶的辅酶和辅基,添加大量的VB1能够极大提高多种酶的酶活力,加快菌体生长,提高菌活力,进而促进了谷氨酸的分泌和糖酸转化率的提高[16]。因此,选取8 mg/L作为VB1的最佳添加量。

图3 VB1添加量对谷氨酸清洁发酵的影响Fig.3 Effect of VB1 addition on clean fermentation of glutamic acid
2.1.4 甲硫氨酸对谷氨酸清洁发酵的影响
在生物氮素最佳添加量为1.5g/L,生物素最佳添加量为7μg/L,VB1最佳添加量为8mg/L的条件下,添加不同量甲硫氨酸对谷氨酸发酵的影响见图4。由图4可以看出,OD600nm值和谷氨酸产量随着甲硫氨酸在0.4~1.2 g/L范围的增加而不断增加;而糖酸转化率在甲硫氨酸添加量在0.4~0.8 g/L范围呈上升趋势,当甲硫氨酸的添加量分别为0.8g/L、1.0g/L和1.2 g/L时,其所对应的糖酸转化率分别为67.6%、67.5%和67.6%,此时糖酸转化率出现波动,甲硫氨酸已不是影响转化率的主要因素。甲基化在菌体的生物合成与代谢中发挥着重要的作用,尤其对蛋白质和核酸的修饰加工也极为重要。而甲硫氨酸作为体内最重要的甲基供体,经三磷酸腺苷(adenosine triphosphate,ATP)的进一步活化生成S-腺苷甲硫氨酸(最直接有效的甲基供体),能够提供活化的甲基。四氢乙酸虽然能够携带甲基,但由于转运势能低、不能直接将甲基转移至甲基受体,而是转移至同型半胱氨酸生成甲硫氨酸[17]。因此,在培养基中添加一定量的甲硫氨酸能够促进了菌体的快速生长,进而提高谷氨酸产量和糖酸转化率。因此,选择0.8 g/L作为甲硫氨酸的最佳添加量。
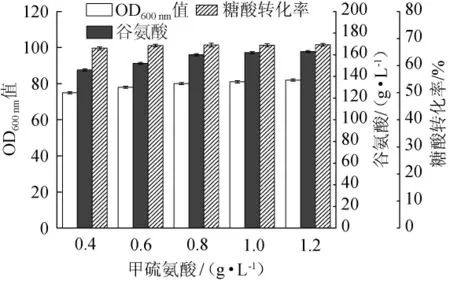
图4 甲硫氨酸添加量对谷氨酸清洁发酵的影响Fig.4 Effect of methionine addition on clean fermentation of glutamic acid
2.2 培养基优化正交试验
以菌体OD600nm值、谷氨酸产量和糖酸转化率作为考察指标,根据表1所设计的正交试验进行正交优化,正交试验结果与分析见表2,方差分析见表3。
由正交试验结果及极差(R)分析可知,影响OD600nm值的4个因素次序为A>D>C>B,即生物氮素>甲硫氨酸>VB1>生物素,最佳添加量组合为A3B1C3D1,即生物氮素2.0 g/L、生物素5 μg/L、VB110 mg/L、甲硫氨酸0.6 g/L;影响谷氨酸产量的4个因素次序为B>A>C>D,即生物素>生物氮素>VB1>甲硫氨酸,最佳添加量组合为A3B2C2D2,即生物氮素2.0 g/L、生物素7 μg/L、VB18 mg/L、甲硫氨酸0.8 g/L;影响糖酸转化率的4个因素次序为B>C>A>D,即生物素>VB1>生物氮素>甲硫氨酸,最佳添加量组合为A2B1C3D1,即生物氮素1.5 g/L、生物素5 μg/L、VB110 mg/L、甲硫氨酸0.6g/L。
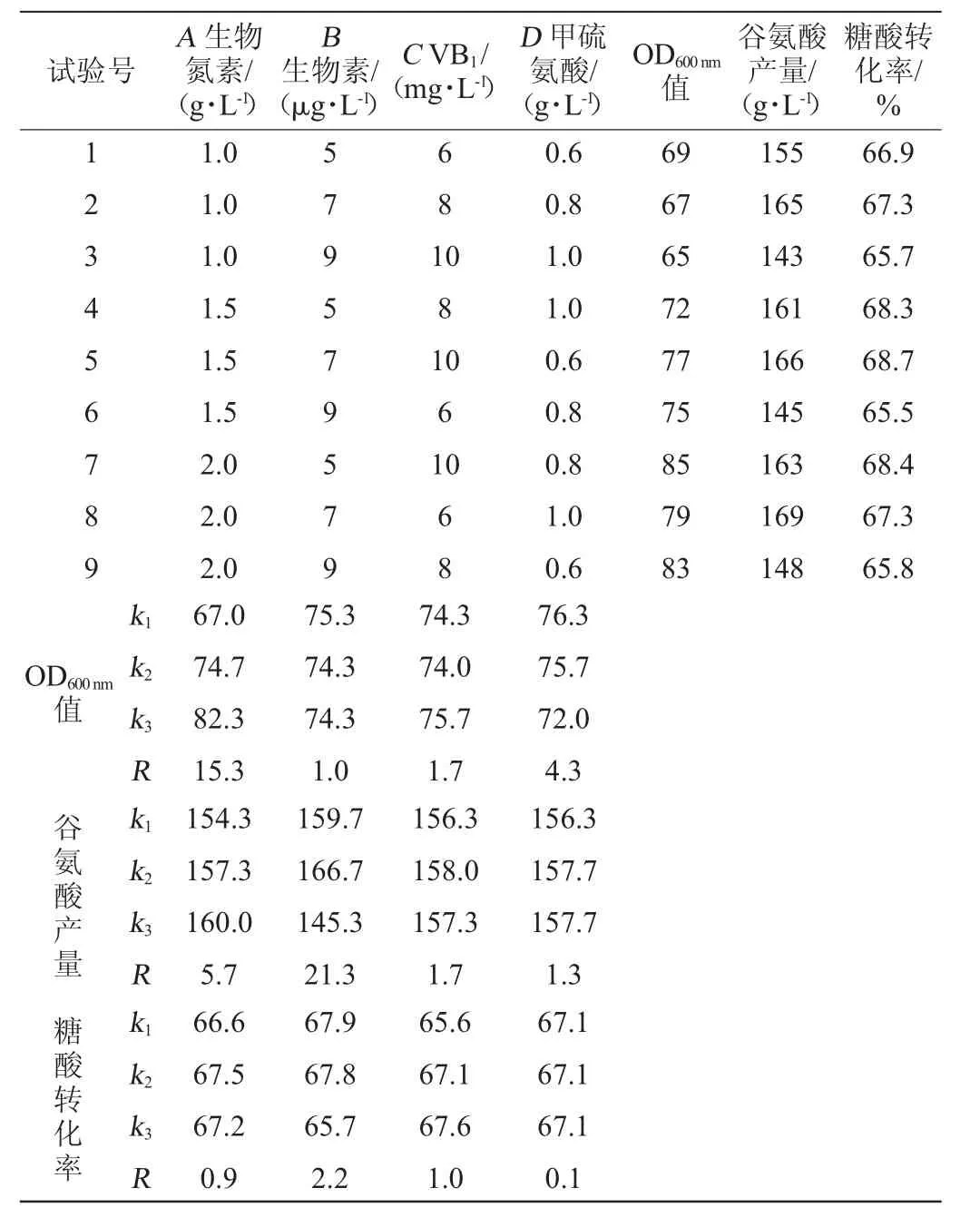
表2 谷氨酸清洁发酵培养基组分优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for clean fermentation medium composition optimization of glutamic acid

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal tests results
由表3可知,生物氮素对OD600nm值影响显著(P<0.05),生物素对谷氨酸影响显著(P<0.05),生物氮素、生物素和VB1对糖酸转化率影响显著(P<0.05)。
综合考虑以上试验结果,在满足一定量OD600nm值的情况下,又同时有较高的谷氨酸产量和糖酸转化率,因此,最佳添加量组合选取A3B2C3D1,即生物氮素2.0 g/L、生物素7 μg/L、VB110 mg/L、甲硫氨酸0.6 g/L。
2.3 清洁发酵培养基验证试验
2.3.1 清洁发酵培养基对OD600nm值、谷氨酸产量和糖酸转化率的影响
对照发酵与清洁发酵的考察指标对比情况结果见图5。由图5可知,相对于对照发酵,清洁发酵的OD600nm值和谷氨酸产量都有较大的提高,糖酸转化率虽然不明显,但是也有一定程度的提升。总的来说,OD600nm值由对照发酵的72.5提升至84.2,提高16.14%;谷氨酸由152 g/L提高至171 g/L,提高12.50%;糖酸转化率由65.4%提升至68.5%,提高4.74%。
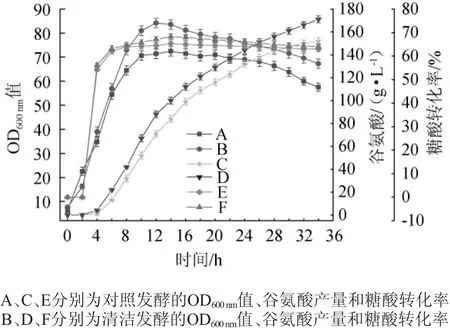
图5 清洁发酵与对照发酵对考察指标的影响Fig.5 Effects of clean and control fermentation on evaluation indicators
2.3.2 清洁发酵培养基对发酵参数的影响
对照发酵培养基和清洁发酵培养基所获得的发酵上清液的透光率结果见图6。
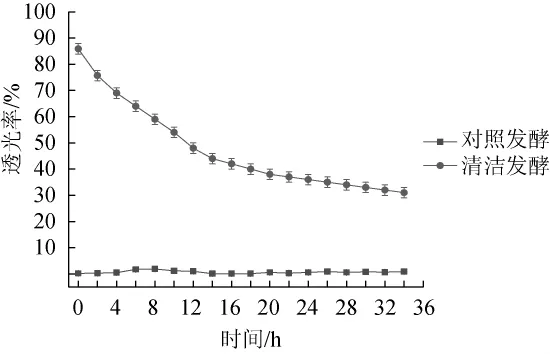
图6 清洁发酵对发酵液透光率的影响Fig.6 Effect of clean fermentation on the light transmittance of fermentation liquor
由图6可知,对照发酵的发酵液透光率非常低,因为其含有大量的色素及不可被菌体分解利用的杂质,菌体所产生的影响透光性的物质相对培养基自身的杂质可以忽略不计,因而其透光率呈现稳定的趋势。而虽然清洁发酵的发酵液透光率随着菌体产生杂质的增多而不断下降,但是其总体透光率远远高于对照发酵,尤其对后续的谷氨酸分离提取而言,可以大幅度降低生产成本[18]。发酵结束时的对照发酵上清液透光率为0.9%,清洁发酵的上清液透光率为31%。
进一步分析可知,玉米浆、豆粕水解液和糖蜜的替代,大大减少了发酵液中的不可被菌体分解利用的杂蛋白以及有毒害作用的物质,降低了发酵液的黏度、减少了泡沫的生成量、提高了氧的溶解效率[19]。清洁发酵对消泡剂用量及副产物影响的结果见图7。由图7可以看出,消泡剂的用量也由对照发酵的1.0 g/L降低至0.7 g/L。由于溶氧效率的提高,对于TCA循环而言,其产生的还原力烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)+H+和黄素腺嘌呤二核苷酸(flavine adenine dinucleotide,FADH2)很大程度上可以使用O2作为氢受体,进而减少丙酮酸作为氢受体,因此副产物乳酸的生成量减少[20]。TCA循环的加强,减少了丙酮酸的积累,进而使得副产物丙氨酸的生成量降低[21]。从图7可以看出,乳酸的生成量由对照发酵的3.7g/L降低至2.4g/L,丙氨酸的生成量由对照发酵的2.60g/L降低至1.86 g/L。
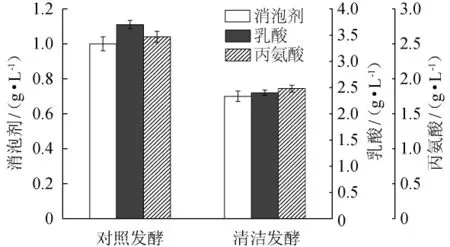
图7 清洁发酵对消泡剂用量及副产物的影响Fig.7 Effects of clean fermentation on defoamer dosage and by-products
3 结论
通过单因素试验和正交试验对谷氨酸对照发酵培养基中的关键因素进行优化,得到最佳添加量,即生物氮素2.0 g/L、生物素7 μg/L、VB110 mg/L、甲硫氨酸0.6 g/L,获取谷氨酸清洁发酵培养基。应用生物氮素作为发酵氮源的清洁发酵培养基进行谷氨酸发酵,其获得的菌体OD600nm值为84.2,谷氨酸产量为171 g/L,糖酸转化率为68.5%,发酵上清液透光值高达31%。对比可知,本研究所获得的谷氨酸清洁发酵培养基取得了比对照发酵培养基和复合氨基酸粉或棉籽饼粉作为发酵氮源更好的发酵结果,并解决了谷氨酸生产中色素、杂质多的问题,实现了谷氨酸高效清洁生产。另外,该清洁发酵培养基中是否可以通过添加其他种类的维生素、氨基酸等提高菌体活力的物质,进一步提高谷氨酸发酵效益,有待于更多的研究探索。
