江西酸芋荷中乳酸菌的分离鉴定及在泡菜发酵中的应用
2018-11-03赵山山杨晓艳杜秋玲张莎莎邸一桓赵国忠郝光飞
赵山山,杨晓艳,杜秋玲,张莎莎,王 磊,邸一桓,赵国忠,郝光飞*
(1.河北工程大学 生命科学与食品工程学院,河北 邯郸 056000;2.天津科技大学 食品工程与生物技术学院 教育部食品营养与安全重点实验室,天津 300457)
腌菜制品是赣南客家常上桌的传统小菜,在客家菜中地位突出。由于赣州气候因素,客家人多以碱性米制食品为主食,而赣南客家发酵蔬菜具有开胃、消食等特征,对人体肠胃能起到酸碱中和作用。酸芋荷是一种赣南特产,客家人用芋荷、辣椒、大蒜等腌制而成的一道美食佳肴,传统加工工艺已有上千年的历史,为色香味俱全的特色赣州小吃。
泡菜的生产是在食盐的高渗透压作用下以乳酸发酵为主的微生物发酵过程[1]。近年来,国内外学者对发酵蔬菜中的乳酸菌多样性进行了分析,潘晴等[2]从四川老坛泡菜分离得到12株疑似乳酸菌,经鉴定5株为植物乳杆菌(Lactobacillus plantarum)、3株短乳杆菌(L.brevis)、2株肠膜明串珠菌(Leuconostoc mesenteroides)、1株干酪乳杆菌(L.casei)和1株屎肠球菌(Enterococcus faecium)。MONIKA等[3]从印度传统泡菜中分离出15株乳酸菌,经过形态观察、生理生化特征和16S rDNA序列分析鉴定为7株粪肠球菌(E.faecalis)、3株植物乳杆菌(L.plantarum)、2株戊糖片球菌(Pediococcus pentosaceus)、1株肠膜明串珠菌(L.mesenteroides)、1株乳酸乳球菌(L.lactis)和1株肠球菌(Enterococcus sp.)。SAEEDI M 等[4]从伊朗自然发酵腌菜样品中分离鉴定出小球菌(Pediococcus)、乳酸杆菌(Lactobacillus)、魏斯氏菌(Weissella)、肠球菌(Enterococcu)和明串珠菌(Leuconostoc)。
由此可见,发酵蔬菜中的丰富乳酸菌资源证明了发酵蔬菜是潜在的优质乳酸菌的自然资源库,其中具有生产应用价值的乳酸菌,成为制备不同种类的乳酸菌发酵剂的良好选择[5]。乳酸菌是泡菜生产中的优势菌群,菌株性能与泡菜品质有直接关系[6]。敖晓琳等[7]从四川泡菜中筛选出两株产酸能力良好的乳酸菌,经鉴定为发酵乳杆菌(L.fermentum)和植物乳杆菌(L.plantarum),并通过人工接种两种乳酸菌发酵萝卜,提高了产品的质量。吴伟杰等[8]分离筛选一株具有优良发酵性能的乳酸粪肠球菌WJ03,接种发酵萝卜泡菜后缩短泡菜发酵周期,改善了泡菜风味。
本研究对江西赣州传统发酵蔬菜酸芋荷中产酸乳酸菌进行分离纯化及形态观察、生理生化、分子生物学鉴定,旨在为传统发酵蔬菜食品中的菌种多样性提供依据,为研究及改善传统食品工业生产提供了原始数据及优质的菌种来源。人工接种优良乳酸菌发酵泡菜,为泡菜发酵工艺的优化和工业化生产提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酸芋荷样品:江西省赣州市宁都县梅江镇河东村采集的农家自制发酵食品。
1.1.2 培养基
MRS肉汤培养基、明胶液化培养基、接触酶试验培养基、H2S产生试验培养基、硝酸盐还原试验培养基:国药集团化学试剂有限公司;糖发酵培养基:上海晶纯试剂有限公司。
MRS-碳酸钙培养基:含1.5%碳酸钙的MRS固体培养基。
1.1.3 化学试剂
氯化钠、无水乙醇(均为分析纯):天津欧博凯化工有限公司;牛胆盐(生化试剂):美国Solarbio公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Invitrogen公司。
1.2 仪器与设备
DHG-9070A电热鼓风干燥箱、DHP-9162电热恒温培养箱:上海一恒科学仪器有限公司;YXQ-LS-50SII立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;SW-CJ-2D型超净工作台:苏州净化设备有限公司;Microfuge 20高速离心机:美国贝克曼库尔特公司;T100Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、Power pac2000电泳仪、Universal Hood II凝胶成像仪:美国Bio-Rad公司。
1.3 方法
1.3.1 乳酸菌的分离[9]
将各种样品分别于MRS肉汤培养基中,37℃发酵24~48 h,在无菌条件下用无菌生理盐水进行10倍稀释,选取10-4、10-5、10-6、10-7稀释度的稀释液1 mL于无菌培养皿(每个稀释梯度做3个平行)中,用MRS-碳酸钙培养基浇注,待凝固后,37℃恒温培养箱倒置培养48 h。挑取有明显溶钙圈的单菌落平板划线,37℃培养48 h,并反复多次划线、分离、纯化。将得到的单菌落接种于MRS肉汤培养基中,37℃培养12 h,取1 mL培养液于4 500 r/min离心5 min,弃上清,菌体加入30%甘油重悬后-80℃保存,其余菌液用于后续实验。
1.3.2 产酸菌株的筛选[10]
选取1.3.1溶钙圈较大的菌株接种于MRS肉汤培养基培养24 h,产酸量测定按照GB/T 12456—2008《食品中总酸的测定》中的方法,用0.1 mol/L NaOH滴定,1%酚酞为指示剂。产酸量计算公式如下:

式中:c为氢氧化钠标准滴定溶液浓度,mol/L;V1为样品消耗氢氧化钠溶液的体积,mL;V2为空白消耗氢氧化钠溶液的体积,mL;m为样品的质量,g。
1.3.3 产酸乳酸菌的形态观察
观察1.3.2中产酸能力较强的菌株单菌落的菌落色泽、形态、大小,并进行接触酶试验及革兰氏染色、镜检。
1.3.4 乳酸菌耐酸能力测定[11]
1.3.2 中所述菌株的菌悬液5 000 r/min离心1~2 min,弃上清,用生理盐水清洗菌体3次,pH 2.0的盐酸重悬。酸处理2 h后分别用生理盐水进行10倍梯度稀释,并取适合稀释度的稀释液于无菌培养皿中,MRS培养基浇注平板,37℃培养48 h后,计菌落数,计算乳酸菌的存活率。同时未经酸处理的菌株作为对照。每个实验重复3次,每株菌每次实验做3个平行。乳酸菌耐酸存活率计算公式如下:
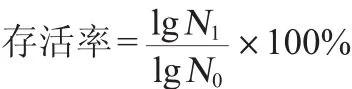
式中:N1为酸耐受2 h的活菌数,CFU/mL;N0为酸耐受前的活菌数,CFU/mL。
1.3.5 乳酸菌耐胆盐能力测定[12]
1.3.2 中所述菌株的菌悬液5 000 r/min离心1~2 min,弃上清,生理盐水清洗菌体3次后,0.3%胆盐水重悬。处理2 h后进行10倍梯度稀释,取适宜稀释度的稀释液于无菌培养皿中,MRS培养基浇注平板,37℃培养48 h后,计菌落数,计算乳酸菌的存活率。同时未经胆盐处理的菌株作为对照。每个试验重复3次,每株菌每次试验做3个平行。乳酸菌耐胆盐存活率计算公式如下:
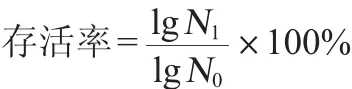
式中:N1为胆盐耐受2 h的活菌数,CFU/mL;N0为胆盐耐受前的活菌数,CFU/mL。
1.3.6 乳酸菌耐盐能力测定[11]
初筛:在无菌培养皿中倒入10 mL的MRS培养基,皿底斜放,凝固后,将培养皿放平,再在其上倒10 mL10%NaCl的MRS培养基,待凝固后,室温静置24 h,NaCl扩散平衡就制成耐盐的浓度梯度平板。菌株在耐盐浓度梯度平板上从NaCl浓度低到高的方向平行划线,观察菌株生长情况。
复筛:耐盐初筛菌株的菌悬液以2%接种量(菌悬液浓度约为108CFU/mL)分别接种于不含NaCl及8%NaCl的MRS液体培养基中,37℃静置培养,每2 h测定培养液在波长600 nm处的吸光度值,根据吸光值绘制生长曲线。每个试验重复3次,每株菌每次试验做3个平行。
1.3.7 乳酸菌生理生化鉴定[9]
将试验菌株进行明胶液化试验、糖发酵试验、吲哚产生试验、硫化氢产生试验、硝酸盐还原试验、乳酸菌生长温度试验、6%NaCl生长试验,观察试验结果。
1.3.8 乳酸菌的16S rRNA基因序列分析[13]
乳酸菌基因组DNA的提取:按照DNA提取试剂盒说明书提取。
乳酸菌16S rRNA基因序列的确定。PCR体系(25 μL):脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mixture12.5μL,DNA模板1μL,正向引物(5'-AACTGAGTTTGATCCTGGCTC-3')、反向引物(5'-TACGGTTACCTTGTTACGACTT-3')各1 μL,无酶水9.5 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,42℃退火30 s,72℃延伸2 min,30个循环;72℃终延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测后,送至上海生物工程有限责任公司进行测序。
同源性分析:将测序得到的序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站上采用基本局部比对搜索工具(basic local alignmentsearch tool,BLAST)同源序列比对分析,从GenBank中得到参比标准菌株的16S rRNA基因序列,进行相关的同源性分析,最后运用MEGA7.0软件构建系统发育树。
1.3.9 泡菜发酵[14]
(1)泡菜制作工艺
将新鲜芋荷、豆角洗净,晾干,切段,入坛,添加质量分数为6%的盐水(蔬菜∶盐水为1∶1)浸泡,添加乳酸菌(或不添加,自然发酵)。密封常温放置发酵。
优良乳酸菌接种于MRS液体培养基,37℃培养24 h后,5 000 r/min离心1~2 min,弃上清,生理盐水清洗菌体,调整菌体浓度约为1×108CFU/mL,接菌量为3%。泡菜制作分为自然发酵组,人工接种A03c4组,人工接种A03d1组[15]。
(2)泡菜发酵过程中pH的测定
每24 h测定泡菜汁pH,使用标准缓冲液校准pH计后,浸入泡菜汁中,稳定后读数,记录pH值。
(3)感官评价
对3组泡菜进行感官评定。由20名专业人员组成评定小组,对发酵泡菜的色泽、气味、质地、滋味进行评价,每一项满分9分。感官评分标准见表1。

表1 泡菜感官评分标准Table 1 Sensory evaluation standards of pickles
2 结果与分析
2.1 产酸菌的筛选
从江西省赣州市宁都县梅江镇河东村采样的发酵蔬菜酸芋荷中分离筛选得到103株产酸细菌,选取具有明显溶钙圈、菌落呈圆形凸起、湿润且边缘整齐的菌株进行产酸能力的测定。产酸类细菌在MRS-碳酸钙培养基上产生溶钙圈,溶钙圈的直径大小反映出菌株产酸能力的强弱。选取溶钙圈直径较大且产酸量较大的15株菌(见表2)进行后续实验。
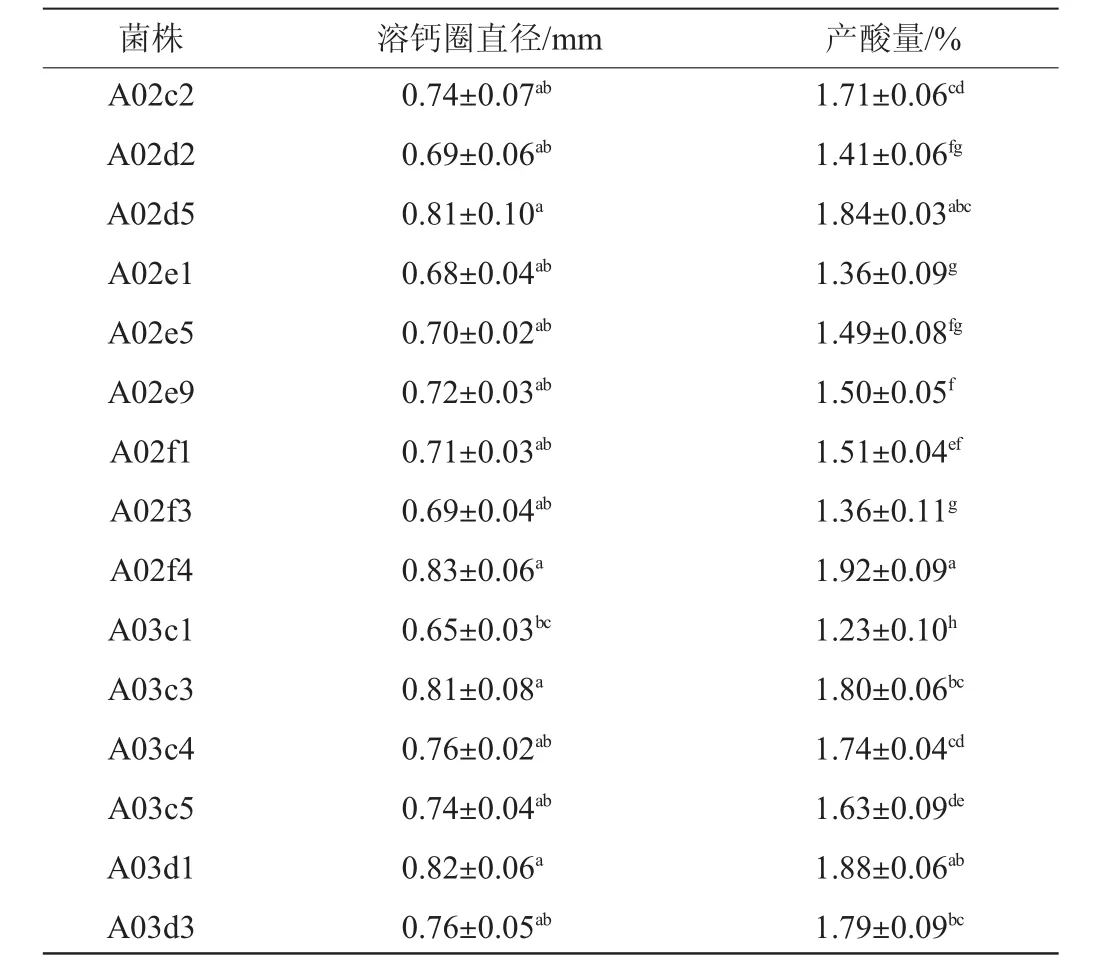
表2 产酸乳酸菌的筛选结果Table 2 Screening results for acid-producing lactic acid bacteria
2.2 筛选菌株的菌落形态
15株菌形态学特征结果见表3。由表3可知,15株菌进行革兰氏染色,结果均为革兰氏阳性(G+)。镜检结果显示,A02c2、A02d2、A02e1、A02e9、A02f3、A02f4、A03c4、A03c5、A03d1、A03d3共10株菌的菌体成杆状,A02d5、A02e5、A02f1、A03c1、A03c3共5株菌的菌体呈短杆状。各菌株的接触酶(过氧化氢酶)试验结果均为阴性。15株菌初步满足乳酸菌的特征,为疑似乳酸菌。

表3 不同菌株形态学特征Table 3 Morphological characteristics of different strains
2.3 乳酸菌耐酸能力实验结果
乳酸菌经口进入胃肠道后,由于人体胃液中pH较低,一般介于1.5~2.0,只有少数能够适应胃液的强酸环境。因此,乳酸菌要经过胃液进入肠道发挥作用,必须对低pH有一定的耐受能力。不同菌株的酸耐受能力结果见表4。由表4可知,分离得到的15株菌在pH 2.0的环境中处理2 h后活菌数仍可以达到108CFU/mL以上,耐酸存活率均>96%,说明15株菌都具有良好的耐酸能力。

表4 不同菌株的酸耐受能力Table 4 Acid resistance of different strains
2.4 乳酸菌耐胆盐实验结果
人体小肠胆盐浓度通常为0.03%~0.30%,乳酸菌进入肠道,会受到小肠胆盐的抑制,因此乳酸菌进入并且定植肠道,发挥益生作用,就必须能够耐受0.3%胆盐浓度。如表5所示,不同的乳酸菌对胆盐的耐受力不同,其中菌株A02e1、A03d3胆盐处理2 h后,平板内无菌落生长,而菌株A03c4、A03d1胆盐处理2h后,胆盐耐受能力最好,菌株A03c4活菌数达108CFU/mL,菌株A03d1活菌数达106CFU/mL。
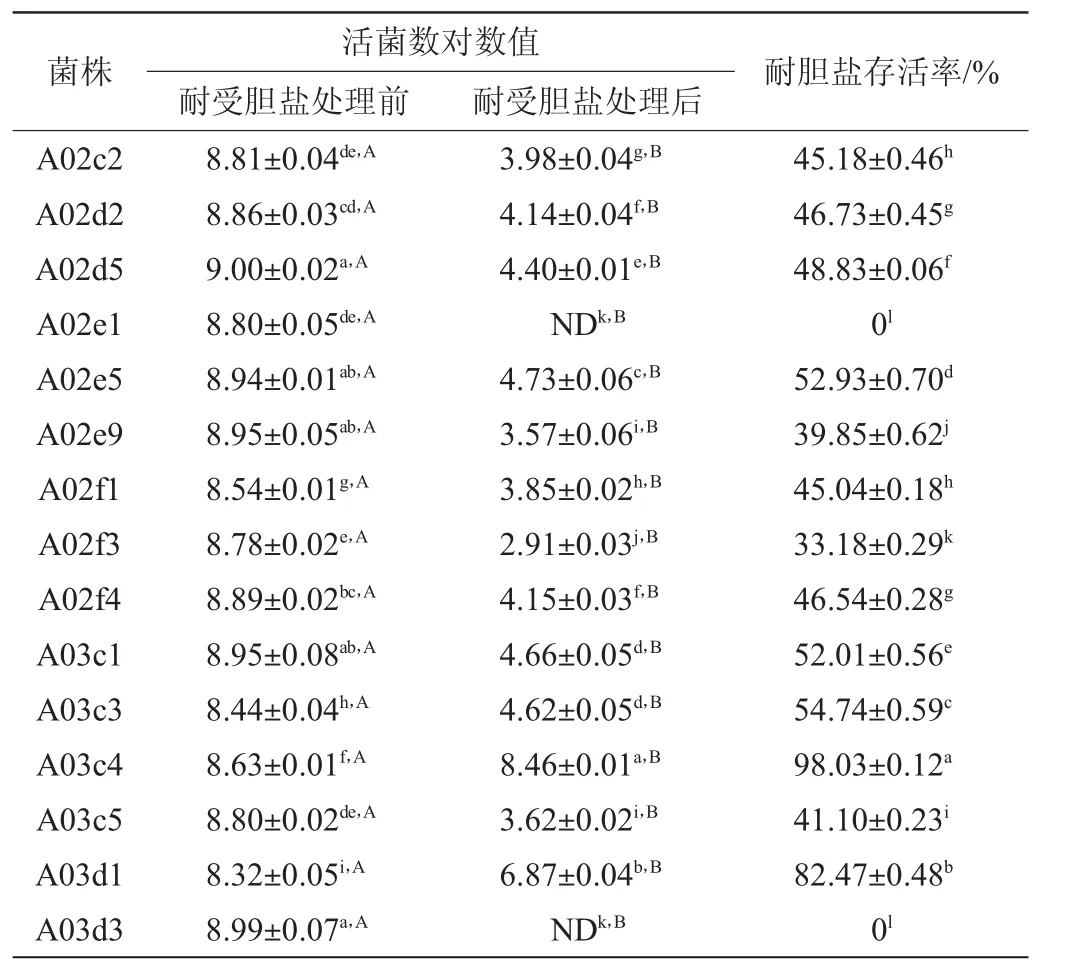
表5 不同菌株的胆盐耐受能力Table 5 Bile salt resistance of different strains
2.5 乳酸菌耐盐实验结果
实验菌株在NaCl浓度梯度平板上平行划线进行耐盐性能的初筛,培养48 h后发现15株菌均能在NaCl浓度梯度培养基表面生长,但是随着NaCl浓度的升高,菌株生存能力逐渐降低,其中菌株A02e1、A02e9、A02f3、A02f4、A03c4、A03d1、A03d3在NaCl培养基浓度高的一侧生长较好,选取这7株菌在不含有NaCl及含有8%NaCl的MRS培养基中生长,对其耐盐能力进行复筛,结果见图1。
如图1a所示,初筛得到的7株菌株在不含NaCl的培养基中生长,其中菌株A03d3、A03d1、A02f3、A02e1、A02f4、A02e9的延滞期较短,培养2 h后进入对数期,培养12 h即进入稳定期;而菌株A03c4延滞期较长,生长较为缓慢,培养14 h后进入稳定期。
如图1b所示,7株菌株在含有8%NaCl的MRS培养基中菌株生长时均受到不同程度的抑制。菌株A03c4延滞期最长,约10 h;菌株A02f3延滞期最短,培养3 h后进入对数期。菌株A03d1、A03d3、A02f4、A02e9和A02e1在含有8%NaCl的环境中生长时延滞期依次递增。

图1 在无盐(a)及8%NaCl浓度(b)条件下各菌株的生长曲线Fig.1 Growth curves of the strains under the condition of without NaCl(a)and with 8%NaCl(b)
2.6 菌株生理生化鉴定
15株菌生理生化试验结果如表6所示,结合《伯杰细菌鉴定手册》[16]和《乳酸细菌分类鉴定及实验方法》[9]。这15株菌初步满足乳酸菌的特征,为疑似乳杆菌,其中菌株A02c2、A02e1、A02e9、A02f3、A02f4、A03c4、A03d1、A03d3的发酵特征与植物乳杆菌一致,可以发酵葡萄糖、麦芽糖、乳糖、半乳糖、海藻糖等大部分糖类,但是不能发酵鼠李糖,能在15℃条件下生长,45℃条件下不生长,因此初步鉴定这8株菌为植物乳杆菌(Lactobacillusplantarum)。菌株A02d2、A03c5具有乳杆菌属的特征,且与干酪乳杆菌具有相似的糖发酵特征,可以发酵葡萄糖、乳糖、半乳糖等,不能发酵棉子糖、阿拉伯糖,因此初步鉴定这2株菌为干酪乳杆菌(Lactobacillus casei)。菌株A02d5、A02e5、A02f1、A03c1、A03c3除了具有乳杆菌属的特征外,还可以发酵麦芽糖、蔗糖、半乳糖、果糖、苦杏仁苷等多种糖类,但不能发酵纤维二糖、鼠李糖、甘露醇、山梨醇,根据其生理生化特征将这5株菌初步鉴定为短乳杆菌(Lactobacillus brevis)。
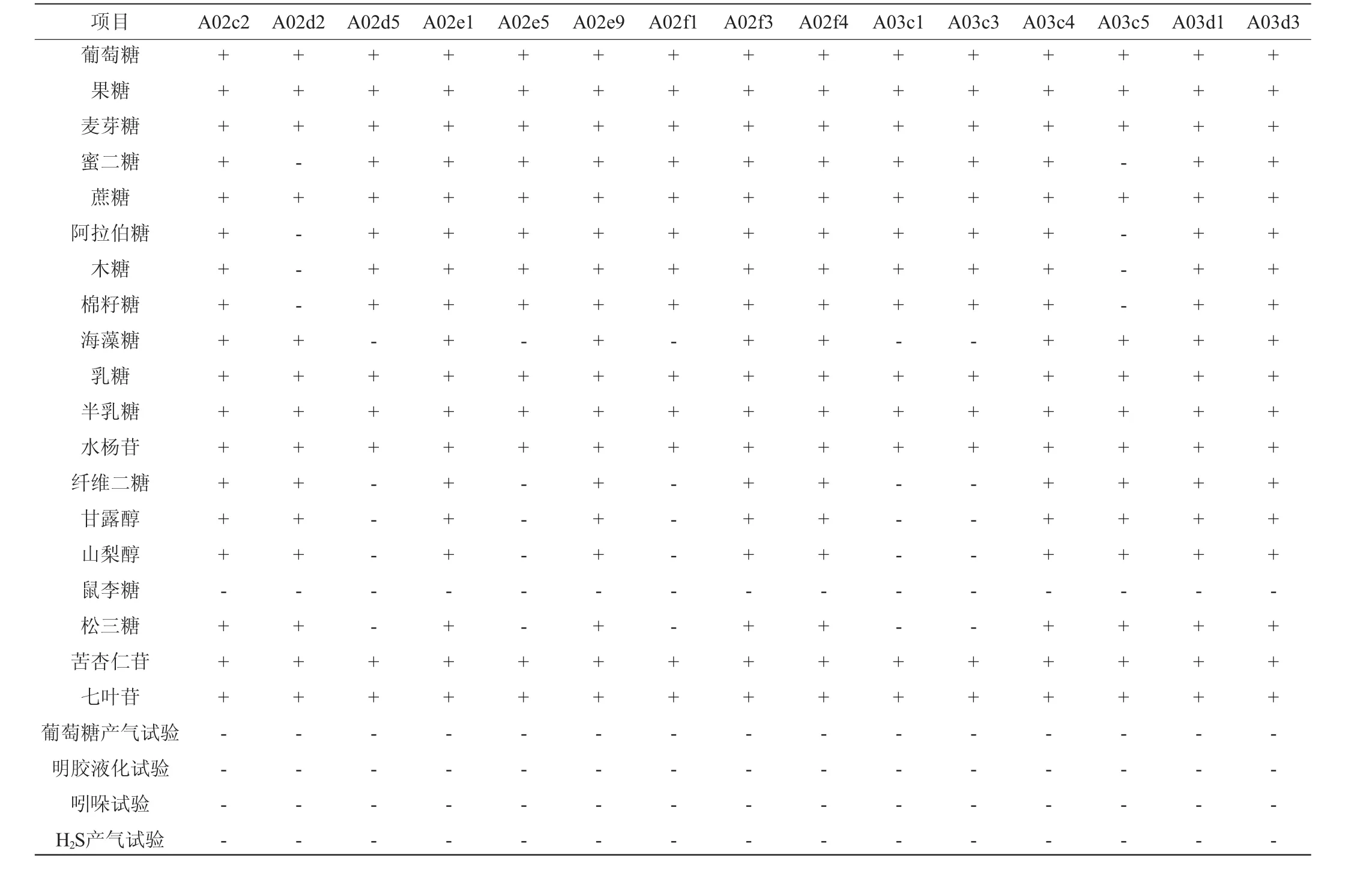
表6 15株菌生理生化试验结果Table 6 Physiological and biochemical test results of 15 strains
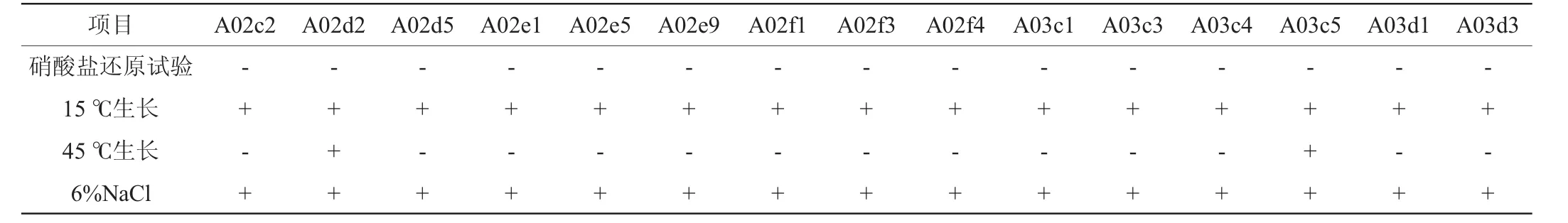
续表
2.7 菌株分子生物学鉴定结果
乳酸菌表型特征鉴定主要是通过乳酸菌的菌落形态特征和生理生化特征来鉴定,通常只能鉴定到属[17]。KHALIL M I等[18]根据菌落形态和生理生化特性从鲜奶、巴氏杀菌奶、酸奶样品中分离的13株乳酸菌中,鉴定出7株属于乳杆菌属,6株属于乳酸杆菌属。表型特征相似,并不代表基因型亲源关系相近,必须利用基因型特征来进一步鉴定[19]。在16S rRNA基因序列比对中,对属和种的界定为:属于同一个属的最低同源性为95%[20],当同源性>97%时,属于同一个种[21],如尹雪等[22]运用16S rRNA基因序列和系统发育对从新疆传统发面面肥中分离得到的3株乳酸菌进行种属鉴定,鉴定出一株同源性为100%的类芽孢杆菌,两株同源性为100%的芽孢杆菌。因此16S rRNA基因序列的测定与比对被广泛用于细菌分类地位的确定。
各乳酸菌总DNA提取后,使用通用引物分别对其16S rRNA基因序列进行扩增,经1%琼脂糖凝胶电泳检测,扩增大小约为1 500 bp的产物送至上海生工生物工程股份有限公司进行测序。测序结果在NCBI网站进行BLAST同源序列的比对分析,并使用MEGA7.0软件构建系统发育树,结果见图2。
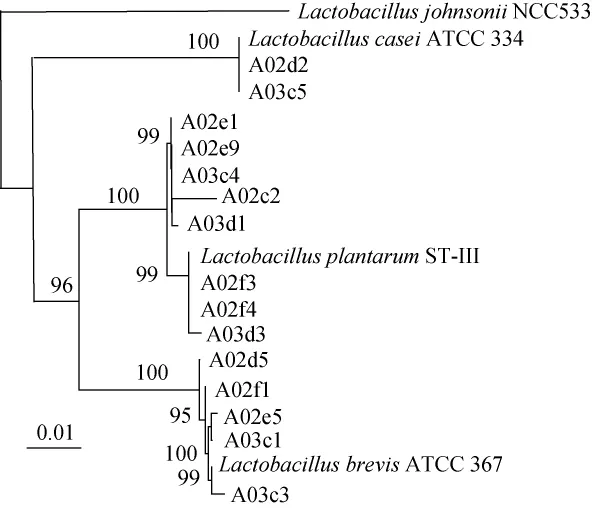
图2 基于16S rDNA基因15株菌的系统发育树Fig.2 Phylogenetic tree of 15 strains based on 16S rDNA genes
由图2可知,菌株A02d2、A03c5与Lactobacillus casei ATCC334(Genbank登陆号:KC429784)的同源性高达100%,这两株菌被鉴定为干酪乳杆菌(Lactobacillus casei)。菌株A02e1、A02e9、A03c4、A02c2、A03d1、A02f3、A02f4、A03d3与Lactobacillus plantarum ST-III(Genbank登陆号:FJ423546)的同源性分别为99.21%、99.71%、99.86%、99.86%、99.86%、99.93%、99.86%、100%,这8株菌被鉴定为植物乳杆菌(Lactobacillusplantarum)。菌株A02d5、A02f1、A02e5、A03c1、A03c3与Lactobacillus brevis ATCC 367(Genbank登陆号:NR_075024)的同源性高达100%,这5株菌被鉴定为短乳杆菌(Lactobacillus brevis)。
2.8 乳酸菌发酵泡菜品质的研究
2.8.1 泡菜发酵过程中pH变化
乳酸菌发酵泡菜过程中产生乳酸,使得发酵蔬菜具有特殊的风味,并且不破坏蔬菜的品质。结合菌株产酸、耐酸、耐胆盐、耐盐能力结果,选取两株优良菌种A03d1、A03c4人工接种发酵泡菜。
泡菜发酵过程中pH值的变化结果见图3。由图3可知,3组发酵泡菜的初始pH值基本相同,均为6.40±0.03。无论是自然发酵还是人工接种乳酸菌发酵,发酵0~3 d的pH值下降较为明显,3 d后pH值趋于平缓。生产过程中添加乳酸菌加速了泡菜的发酵,人工接种泡菜的两组pH值明显低于自然发酵组。人工接种乳酸菌组的pH值下降较快,相比自然发酵组,缩短了发酵泡菜达到泡菜所需pH值的发酵时间,提高了发酵泡菜的生产率。此外,由于菌株A03d1产酸能力较高,因此,接种菌株A03d1组发酵泡菜过程中的pH值下降所用时间短于接种菌株A03c4组。
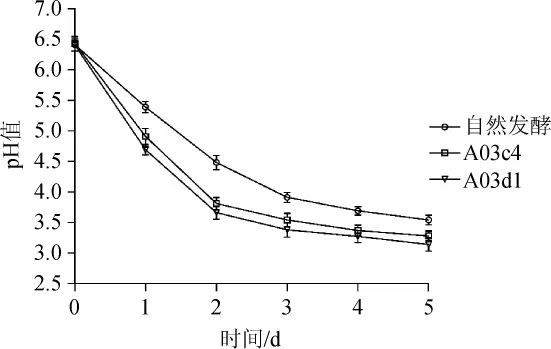
图3 泡菜发酵过程中p H变化Fig.3 Changes of pH value during pickles fermentation process
为了提高泡菜生产效率和降低生产成本,缩短发酵时间是非常重要的,乳酸菌发酵泡菜可快速增加发酵体系中乳酸菌数量,降低pH值,有效缩短泡菜发酵时间;产酸性能可以增加发酵过程中酸性环境,抑制其他细菌生长,提高泡菜生产的安全性。
2.8.2 发酵泡菜感官评价
3组发酵泡菜感官评分结果见表7。由表7可知,综合色泽、气味、质地、滋味评分,感官评分从高到低依次为人工接种A03d1发酵>人工接种A03c4发酵>自然发酵。自然发酵组色泽评分优于其他两组,但气味、质地和滋味评分较低,证明了人工接种乳酸菌发酵泡菜可以提高泡菜的品质和风味。人工接种A03d1、A03c4评分有所差异,说明菌种不同发酵泡菜的品质也有所不同。
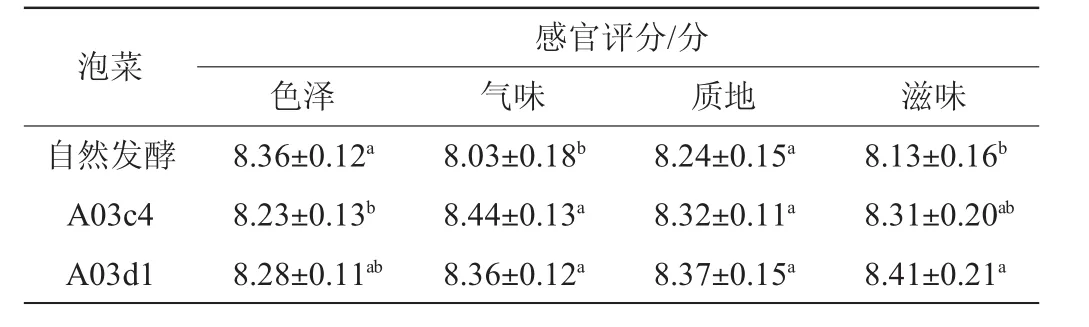
表7 发酵泡菜感官评分结果Table 7 Sensory evaluation results of fermented pickles
3 结论
本研究筛选出的15株产酸菌经形态、生理生化特征及16S rRNA分子生物学鉴定为8株植物乳杆菌(Lactobacillus plantarum)、5株短乳杆菌(Lactobacillus brevis)和2株干酪乳杆菌(Lactobacilluscasei)。通过耐酸、耐胆盐、耐渗透压能力的测定,15株产酸菌的酸耐受和耐盐能力较好,在pH 2.0的酸性环境中处理2 h后活菌数并没有明显的下降,且均能在含有6%NaCl的环境中生长。菌株A03c4、A03d1则具有较高的耐胆盐能力,在0.3%胆盐环境中处理2 h活菌数仍保持在106CFU/mL以上,确定为优良菌株。人工接种乳酸菌A03c4、A03d1发酵泡菜,确定了人工接种乳酸菌在泡菜发酵中的作用,保证了泡菜品质。
乳酸菌在发酵食品的制备中应用愈加广泛。优良菌种的筛选,为食品发酵剂的开发提供基础微生物资源。对传统发酵食品中的乳酸菌多样性进行分析,从中筛选出具有生产价值的优良菌株,为用于制备泡菜的乳酸菌提供借鉴,为传统发酵行业的转型和食品发酵剂的开发提供科学依据。
