“三段式”模板突破化学反应速率及化学平衡的计算
2018-11-03河南省郸城县第一高级中学杨艳菊
■河南省郸城县第一高级中学 杨艳菊
可逆反应由某一状态达到另一状态时的计算,涉及数字较多,可以采用三段法来解决,三段法中的三段包括起始、转化、终态三种状态,对同一种物质的不同状态,单位要相同。
【基本模板构建】
类型一:对于较为复杂的关于反应速率的题目常采用以下模板计算。
1.明确三个关系。
(1)写出有关反应的化学方程式。
(2)找出各物质的起始量、转化量、某时刻量。
(3)根据已知条件列方程式计算。
2.构建三段式。

此三种浓度中,只有转化浓度之比等于计量数之比,常常要用转化浓度的数据求反应速率的数值。
类型二:对于化学平衡状态常采用以下模板计算。
1.明确三个关系。
(1)对于同一反应物,起始量-变化量=平衡量。
(2)对于同一生成物,起始量+变化量=平衡量。
(3)对应状态物理量可以为物质的量、物质的量浓度或气体体积等。
2.构建三段式。
化学平衡计算模式:对于反应mA(g)+nB(g)⇌pC(g)+qD(g),设A、B起始物质的量(mol)分别为a、b,达到平衡后,A的消耗量为mx,容器容积为VL。

【典型例题剖析】
应用1:计算反应速率。
例1已知CO(g)+H2O(g)⇌H2(g)+CO2(g),在1L密闭容器中通入10 molCO和10mol水蒸气,在500℃(平衡常数为9)下经过30s达到平衡,则30s内CO的平均反应速率为____。
解析:在1L密闭容器中通入10mol CO和10mol水蒸气,在500℃下经过30s达到平衡,设CO的浓度变化量为c,三段式法用c表示出平衡时各组分浓度。

代入500℃时反应平衡常数有k=解得c=7.5,则30s内CO的平均反应速度=
答案:0.25mol·L-1·s-1
应用2:计算平衡转化率。
例2已知可逆反应M(g)+N(g)⇌P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol· L-1,c(N)=2.4mol·L-1,达到平衡后,M 的转化率为60%,此时N的转化率为____。
(2)若反应温度升高,M的转化率____(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N)=amol·L-1,达到平衡后,c(P)=
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=bmol·L-1,达到平衡后,M的转化率为____。

(2)由于该反应的ΔH>0,即该反应为吸热反应,因此升高温度,平衡右移,M的转化率增大。
(3)根据(1)可求出各平衡浓度:c(M)=0.4mol·L-1,c(N)=1.8mol·L-1,c(P)=0.6mol·L-1,c(Q)=0.6mol·L-1。因此化学平衡常数
由于温度不变,因此K不变,新状态达到平衡后,c(P)=2mol·L-1,c(Q)=2mol·L-1,c(M)=2mol·L-1,c(N)=(a-2)mol·L-1。

解得a=6。
(4)设M的转化率为x,则达到平衡后各物质的平衡浓度分别为:c(M)=b(1-x)mol·L-1,c(N)=b(1-x)mol·L-1,c(P)=bxmol·L-1,c(Q)=bxmol·L-1。
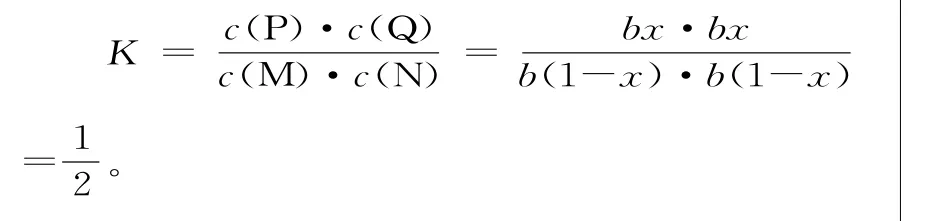
解得x≈41%。
答案:(1)25% (2)增大 (3)6(4)41%
应用3:计算平衡浓度。
例3已知CO(g)+H2O(g)⇌H2(g)+CO2(g),在800℃时的平衡常数为1,在2L容器中加入3.0molCO2(g)、2.0molH2(g)、1.0molCO(g)、5.0molH2O(g),在该条件下,CO2(g)的平衡浓度为____mol·L-1。
解析:这是一个4种物质作为起始量的反应,计算CO2(g)的平衡浓度时,必须注意到CO2的起始浓度。计算时我们可设CO的平衡转化率为α。

答案:1.45
应用4:计算平衡常数。
例4CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为____mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如表1。

表1
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是____。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图1所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是____(填标号)。

图1
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图2所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为____。

图2
解析:(1)某温度下,在体积为2L的容器中加入2molCH4、1mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,根据方程式可知:

(2)①根据表中数据可知相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大,所以催化剂X劣于Y。正反应均是吸热反应,升高温度平衡向正反应方向进行,因此K积、K消均增加,A项正确;升高温度反应速率均增大,B项错误;根据A中分析可知C项错误;积碳量达到最大值以后再升高温度积碳量降低,这说明v消增加的倍数比v积增加的倍数大,D项正确。
②根据反应速率方程式可知在p(CH4)一定时,生成速率随p(CO2)的升高而降低,所以根据图2可知pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为pc(CO2)、pb(CO2)、pa(CO2)。
答案:(1)(2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD ②pc(CO2)、pb(CO2)、pa(CO2)
应用5:计算混合气体的平均相对分子质量。
例5非金属元素氮有多种氧化物,如NO、NO2、N2O4等,已知 N2O4和 NO2相互转化关系为N2O4(g)⇌2NO2(g) ΔH=+57kJ·mol-1。在100℃时,将0.400mol的NO2气体充入2L抽空的恒容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到表2数据。

表2
(1)上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为____。
(2)若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是____。
(3)计算②中条件下达到平衡后混合气体的平均相对分子质量为____。(结果保留小数点后一位)
(4)某温度时测得2NO2(g)⇌N2O4(g)ΔH=-57kJ·mol-1的平衡常数K的值为0.28,则该 温度____100 ℃(填“>”“<”或“=”);升高温度后,反应2NO2⇌N2O4的平衡常数K将____(填“增大”“减小”或“不变”)。
解析:(1)从反应开始直至20s时,N2O4的平均反应速率0.00125mol·L-1·s-1,NO2的平均反应速率为N2O4的平均反应速率的2倍,即为0.0025mol·L-1·s-1。
(2)若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是cmol·L-1,则

(3)根据题意可知:

(4)100℃时,在60s时,反应已达平衡状态,所以n3=n4,当N2O4的浓度为时,NO2的浓度是0.12mol·L-1,反应的平衡常数K=,该反应的正反应是放热反应,升高温度平衡常数减小,因0.28<2.78,该温度大于100℃,升高温度后,反应2NO2⇌N2O4的平衡常数K将减小。
答案:(1)0.0025mol·L-1·s-1(2)0.10mol·L-1(3)57.5 (4)>减小
