化学反应原理核心考点测试题(A卷)
2018-11-03河南省郸城县第一高级中学王圆圆
■河南省郸城县第一高级中学 王圆圆
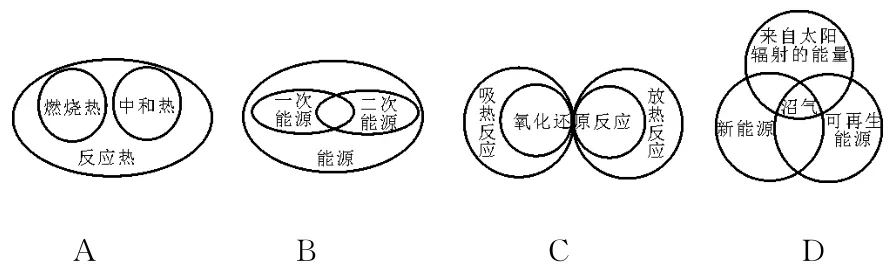
1.下列图示关系不正确的是( )。 是( )。
2.自来水加工处理流程如下,下列有关说法不正确的是( )。
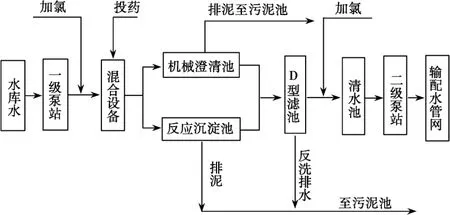
A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池
C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染
D.用ClO2消毒自来水,比等质量氯气的消毒效率高
3.近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图1所示。下列有关说法正确的是( )。

图1
A.碳极发生氧化反应
B.有机电解质和水溶液不可以互换区域
C.Li电极的电极反应式为Li++e-==Li
D.若电源工作时产生标准状况下1.12LH2,则有0.1mol电子通过有机电解质传递到正极
4.仅根据题中图示得出的结论不合理的

5.Ca(OH)2/CaO体系的能量循环如下所示。
下列说法正确的是( )。
A.ΔH5>0
B.ΔH1+ΔH2=0
C.ΔH3=ΔH4+ΔH5
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
6.近年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl-4和有机阳离子构成电解质溶液,其放电工作原理如图2所示。下列说法不正确的是( )。

图2
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
7.葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:

下列说法不正确的是( )。
A.葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B.通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C.若试剂A选择氯水,则试剂B可选择NaOH标准液
D.若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
8.向含1molNa2CO3的饱和溶液中缓缓通入CO2气体,使之充分反应,下列图像表示正确的是( )。

9.水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。用稻壳灰(SiO2:65%~70%,C:30%~35%)制取水玻璃的工艺流程如下。

下列说法正确的是( )。
A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B.操作A与操作B完全相同
C.该流程中硅元素的化合价发生改变
D.反应器中发生的复分解反应为SiO2+2NaOH==Na2SiO3+H2O
10.氯碱工业的尾气——氯气和氢气,按照一定比例在合成炉内燃烧,可制备盐酸。反应过程中的能量变化如下所示。

则 H2(g)+Cl2(g)==2HCl(g)的 ΔH为( )。
A.184.5kJ·mol-1
B.-184.5kJ·mol-1
C.1542.7kJ·mol-1
D.-1542.7kJ·mol-1
11.电石浆是氯碱工业中的一种废弃物,其大致组成如表1所示。
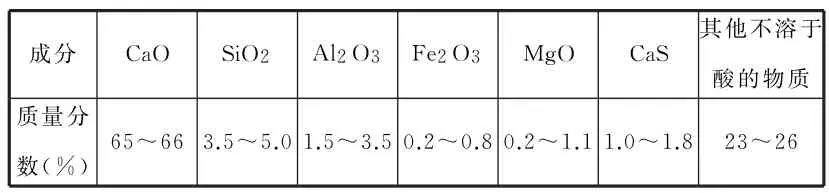
表1
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程。
观察组护士安全管理意识、安全防范完善性优于对照组,P<0.05,其中,观察组护士安全管理意识、安全防范完善性96.55±2.89分、98.62±1.78分优于对照组82.50±3.13分、82.67±2.27分,P<0.05。

已知氯化钙晶体的化学式是CaCl2·6H2O,H2S是一种酸性气体,且具有还原性。下列说法错误的是( )。
A.反应器中加入的酸应选用硫酸
B.脱色槽中应加入的物质X是活性炭
C.设备A的作用是蒸发浓缩,设备C的作用是脱水干燥
D.将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益。

图3
B.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9
D.若是0.1molNaOH 反应后所得的1L溶液pH=10时,溶液中存在以下关系:

13.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:

以下说法正确的是( )。
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确

表2
有关物质在101.3kPa时沸点如表3。

表3
该反应的化学平衡常数表达为K=。有关下列叙述不正确的是( )。
A.由题给条件不能判断出K值随温度变化是增大还是减小
B.表中a应该等于0.63mol·L-1
D.在起始浓度相同的情况下,要提高产率,可采取的措施是适当升高温度,将甲酸乙酯蒸出
15.传统的引爆炸药由于其中含Pb,使用时将产生污染,同时其引爆后的剩余炸药还严重危害接触者的人身安全,美国UNC化学教授ThomasJ.Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,爆炸后不会产生危害性残留物。已知10mLNa2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为( )。
A.N×10-2mol·L-1
16.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应____(填标号)。
a.一定向正反应方向移动
b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动
d.在平衡移动过程中逆反应速率先减小后增大
②若反应的容器容积为2.0L,反应时间为4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为____。
③在850℃时,若向1L的密闭容器中同时充入3.0molCO2(g)、1.0molH2(g)、1.0molCH3OH(g)和5molH2O(g),上述反应向____(填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图4所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________。

图4
②为了提高该反应中CO2的转化率,可以采取的措施是____。
17.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用图5表示。

图5
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是____(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是____(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与

(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,表4为对10L人工海水样本的监测数据。

表4
硝化细菌去除氨氮的最佳反应温度是____,在最佳反应温度时,48h内去除氨氮反应的平均速率是____mg·L-1·h-1。
18.现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图6所示),并测定电离平衡常数Kb。

图6

图7
(1)实验室可用浓氨水和X固体制取NH3,X固体可以是____。
A.生石灰 B.无水氯化钙
C.五氧化二磷 D.碱石灰
(2)检验三颈瓶集满NH3的方法是____。
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,____,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图7所示。图7中____点时喷泉最剧烈。

图8
(4)从三颈瓶中用____(填仪器名称)量取20.00mL氨水至锥形瓶中,用0.05000mol·L-1盐酸滴定。用pH计采集数据,电脑绘制滴定曲线如图8所示。
(5)据图8计算,当pH=11.0时,NH3·H2O电离平衡常数Kb的近似值,Kb≈____。
19.某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
ⅰ.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+。
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O⇌[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6)
ⅱ.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验Ⅰ】如图9。

图9
【实验Ⅱ】
分别用试管①③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

图10 Fe(NO3)3溶液透光率随温度变化曲线

图11 FeCl3溶液透光率 随温度变化曲线
(1)实验Ⅰ中,试管②溶液变为无色的原因是____。
(2)实验Ⅰ中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是____。
(3)由实验Ⅱ图10、图11可知:加热时,溶液颜色____(填“变浅”“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O⇌[Fe(H2O)6]3++4Cl-,得出此结论的理由是____。
[结论二]结论一中反应的ΔH____(填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,___(请描述必要的实验操作和现象)。
20.镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取的。从海水中提取镁需先将海水淡化获得淡水和浓海水,浓海水的主要成分如表5。

表5
利用浓海水提镁的一段工艺流程如下。

请回答下列问题:
(1)浓海水主要含有的四种离子中物质的量浓度最小的是____。在上述流程中,可以循环使用的物质是____。
(2)在该工艺过程中,X试剂的化学式为____。
(3)“一段脱水”的目的是制备MgCl2·2H2O;“二段脱水”的目的是制备电解原料,若将MgCl2·6H2O直接加热脱水,则会生成Mg(OH)Cl。若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为____。
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由 Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为____g。
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为Mg+V2O5+2LiCl==MgCl2+V2O4·Li2O,该电池的正极反应式为____。
(6)Mg合金是重要的储氢材料。2LiBH4/MgH2体系放氢焓变如下所示。

则:Mg(s)+2B(s)==MgB2(s) ΔH=____。
