盖斯定律的理解及应用
2018-11-03河南省郸城县第一高级中学
■河南省郸城县第一高级中学 王 杰
盖斯定律是热化学计算的基本规律,正确理解盖斯定律的概念,建构思维模板,把握各步反应中的守恒关系,对突破和应用盖斯定律十分重要。
【盖斯定律的要点归纳】
1.定律内容。
一定条件下,一个反应不管是一步完成,还是分几步完成,反应的总热效应相同,即反应热的大小与反应途径无关,只与反应的始态和终态有关。
2.常用关系式(见表1)。

表1
题型一:利用盖斯定律求焓变
【思维建模】叠加法求焓变。
步骤1:“倒”。
为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的数值不变,但符号相反。这样,就不用再做减法运算了,实践证明,方程式相减时往往容易出错。
步骤2:“乘”。
为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要相乘。
步骤3:“加”。
上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。
例1(1)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。SiHCl3在催化剂作用下发生反应:

(2)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用水吸收NOx的相关热化学方程式如下:

(3)过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。已知:

解析:(1)将已知热化学方程式标记为:
①2SiHCl3(g)==SiH2Cl2(g)+SiCl4(g)ΔH1=+48kJ·mol-1
②3SiH2Cl2(g)==SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
①×3+②可得:4SiHCl3(g)==SiH4(g)+3SiCl4(g) ΔH=48kJ·mol-1×3+(-30kJ·mol-1)=+114kJ·mol-1。
(2)将已知热化学方程式标记为:
①2NO2(g)+H2O(l)==HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
②3HNO2(aq)==HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9kJ·mol-1
(①×3+②)÷2可得:3NO2(g)+H2O(l)==2HNO3(aq)+NO(g) ΔH=[(-116.1kJ·mol-1)×3+75.9kJ·mol-1]÷2=-136.2kJ·mol-1。
(3)将已知热化学方程式标记为:
②H2(g)+O2(g)==H2O2(l) ΔH1=-188kJ·mol-1
(①-②)×2可得:2H2O2(l)==2H2O(l)+O2(g) ΔH=(-286kJ·mol-1+188kJ·mol-1)×2=-196kJ·mol-1;该反应正反应为放热反应,升高温度,化学平衡向逆反应方向移动,平衡常数减小,即K313K<K294K。
答案:(1)+114 (2)-136.2(3)-196 小于
题型二:构建虚拟路径
【思维建模】化学反应过程包含物质变化和能量变化两大变化,由此,化学反应中存在两大守恒:质量守恒和能量守恒。若反应物A变为生成物D有两条途径,一是A直接变为D,反应热为ΔH;二是A经过B变为C,再由C变为D,每步的反应热依次为ΔH1、ΔH2、ΔH3,则ΔH=ΔH1+ΔH2+ΔH3。设计“虚拟路径”时,要注意物质的聚集状态及计量数转化关系。

根据题设要求可从以下视角设立虚拟路径。
例2室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)△==CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )。
A.ΔH2>ΔH3
B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2
D.ΔH1+ΔH2=ΔH3
解析:根据题意,可以设计如下转化关系:
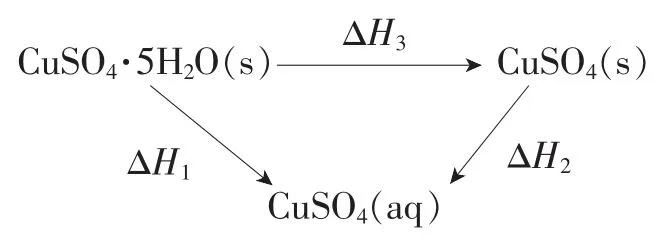
CuSO4·5H2O(s)溶于水(溶液温度降低,该过程为吸热过程):CuSO4·5H2O(s)==Cu2+(aq)+SO2-4(aq)+5H2O(l) ΔH1>0
CuSO4(s)溶于水(溶液温度升高,该过程为放热过程):CuSO4(s)==Cu2+(aq)+SO2-4(aq) ΔH2<0
CuSO4·5H2O(s)受热分解的热化学方程式:CuSO4·5H2O(s)△==CuSO4(s)+5H2O(l) ΔH3
根据盖斯定律可知:ΔH3=ΔH1-ΔH2>0。根据上述分析,ΔH2<0,ΔH3>0,所以A项错误;ΔH3=ΔH1-ΔH2(ΔH2<0),所以ΔH3>ΔH1,B 项正确;ΔH3=ΔH1-ΔH2,C 项错误;ΔH1+ΔH2<ΔH3,D 项错误。
答案:B
题型三:利用键能计算反应热
【思维建模】利用键能计算反应热,要熟记公式:ΔH=反应物总键能-生成物总键能,其关键是弄清物质中化学键的数目。在中学阶段要掌握常见单质、化合物中所含共价键的数目。
例3CO2是一种廉价的碳资源,其综合利用具有重要意义,CO2与CH4经催化重整,制得合成气:
已知上述反应中相关的化学键键能数据如表2。

表2
则该反应的ΔH=____。
解析:化学反应的焓变等于反应物的键能减去生成物的键能,所以焓变为(4×413kJ·mol-1+2×745kJ·mol-1)-(2×1075kJ·mol-1+2×436kJ·mol-1)=+120kJ·mol-1。
答案:+120kJ·mol-1
题型四:热化学方程式的书写
【思维建模】热化学方程式的书写模板。
步骤1:写方程。
写出配平的化学方程式。
步骤2:标状态。
用s、l、g、aq标明物质的聚集状态。
步骤3:标条件。
标明反应物的温度和压强(101kPa、25℃时可不标注)。
步骤4:标ΔH。
在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”。
步骤5:标数值。
根据化学计量数计算写出ΔH的数值。
例4近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)==2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)==SO2(g)ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:___。
解析:根据过程,反应Ⅱ为SO2催化歧化生成 H2SO4和S,反应为3SO2+2H2O==2H2SO4+S。应用盖斯定律,反应Ⅰ+反应Ⅲ得,2H2SO4(l)+S(s)==3SO2(g)+2H2O(g) ΔH= ΔH1+ ΔH3=(+551kJ·mol-1)+(-297kJ·mol-1)=+254kJ·mol-1,反应Ⅱ的热化学方程式为3SO2(g)+2H2O(g)==2H2SO4(l)+S(s)ΔH=-254kJ·mol-1。
答 案:3SO2(g)+2H2O(g)==2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1
题型五:热化学方程式的正误判断
【思维模板】热化学方程式书写的正误判断模板。
步骤1:审“+”“-”。
放热反应一定为“-”,吸热反应一定为“+”。
步骤2:审单位。
单位一定为“kJ·mol-1”,易漏写或错写成“kJ”。
步骤3:审状态。
物质的状态必须正确,特别是溶液中的反应易写错。
步骤4:审数值的对应性。
反应热的数值必须与方程式的化学计量数相对应,即化学计量数与ΔH成正比。当反应逆向时,其反应热与正反应的反应热数值相等,符号相反。
步骤5:审是否符合概念。
注意燃烧热和中和热的概念以及与此相关的热化学方程式。
例5通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )。
①C(s)+H2O(g)==CO(g)+H2(g)ΔH1=akJ·mol-1
②CO(g)+H2O(g)==CO2(g)+H2(g)ΔH2=bkJ·mol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3=ckJ·mol-1
④2CH3OH(g)==CH3OCH3(g)+H2O(g) ΔH4=dkJ·mol-1
A.反应①②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
D.反 应 2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1
解析:反应③中的反应物为CO2、H2,由反应可知,反应①②为反应③提供原料气,A项正确;反应③中的反应物为CO2,转化为甲醇,则反应③也是CO2资源化利用的方法之一,B项正确;由反应④可知,物质的量与热量成正比,且气态水的能量比液态水的能量高,则反应,C项错误;由盖斯定律可知,②×2+③×2+④得到2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g),则ΔH=(2b+2c+d)kJ·mol-1,D项正确。
答案:C
