化学反应原理核心考点测试题(B卷)
2018-11-03河南省郸城县第一高级中学张亚涛
■河南省郸城县第一高级中学 张亚涛
1.C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍,如图1所示。该电池的电池反应式为NaMO2+nC⇌Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )。

图1
A.电池放电时,溶液中钠离子向负极移动
B.该电池负极的电极反应为NaMO2-xe-==Na(1-x)MO2+xNa+
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少
D.电池充电时的阳极反应式为nC+xNa+-xe-==NaxCn

图2
A.N2(g)+3H2(g)⇌2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)⇌2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+3H2(g)⇌2NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+3H2(g)⇌2NH3(g) ΔH=(a+b-c)kJ·mol-1
3.在298K时,实验测得溶液中的反应H2O2+2HI⇌2H2O+I2在不同浓度时的化学反应速率(v)见表1。

表1
由此可推出当c(HI)=0.500mol·L-1、c(H2O2)=0.400mol·L-1时的反应速率为( )。
A.0.038mol·L-1·s-1
B.0.152mol·L-1·s-1
C.0.608mol·L-1·s-1
D.0.760mol·L-1·s-1
4.利用图3所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是( )。

图3
A.a为直流电源的负极
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
5.化学平衡状态 Ⅰ、Ⅱ、Ⅲ的相关数据如表2。

表2
根据以上信息判断,下列结论错误的是( )。
A.a>b
B.增大压强,平衡状态Ⅱ不移动
C.升高温度平衡状态Ⅲ向正反应方向移动
D.反应Ⅱ、Ⅲ均为放热反应
6.假设图4中原电池产生的电压、电流均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )。

图4
A.当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C装置中pH不变
7.白磷与氧可发生反应P4+5O2==P4O10。已知断裂下列化学键需要吸收的能量:P—P为akJ·mol-1,P—O 为bkJ·mol-1,为dkJ·mol-1。根据图5所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )。

图5
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
8.已知25℃时有关弱酸的电离平衡常数如表3。

表3
下列有关说法正确的是( )。
A.等物质的量浓度的各溶液pH关系为pH(Na2S)>pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)>pH(NaHCO3)
B.NaHCO3和Na2CO3混合溶液中,一定有
C.pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)]
D.等浓度的①CH3COONH4、②NH4F、③(NH4)2CO3、④NH4HCO3溶液中的③>②>①>④
9.常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图6。下列分析不正确的是( )。

图6
A.a~b导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液中存在c(NH4)>c(R-),c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
10.碱性硼化钒(VB2)—空气电池工作时反应为4VB2+11O2==4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图7所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )。

图7
A.VB2电极发生的电极反应为2VB2+11H2O-22e-==V2O5+2B2O3+22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,c电极表面先有红色物质析出,后有气泡产生
D.若B装置内的液体体积为100mL,则CuSO4溶液的物质的量浓度为0.05mol·L-1
11.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
下列说法不正确的是( )。
A.由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol-1
B.等物质的量的甲烷分别参加反应①②,反应转移的电子数不同
C.若用标准状况下4.48LCH4还原NO2至N2,则放出的热量为173.4kJ
D.若用标准状况下4.48LCH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6mol
12.常温下,向20mL0.2mol·L-1H2A溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如图8(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法不正确的是( )。
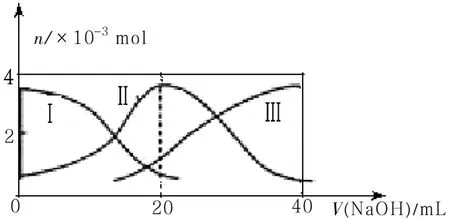
图8
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HĀ)>c(H+)>c(A2-)>c(OH̄)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的小
C.NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
13.甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
反应Ⅰ:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1
反应 Ⅱ:CO(g)+2H2(g)⇌CH3OH(g) ΔH2
(1)图9是反应Ⅰ进行过程中的能量变化示意图。根据图像判断,升高温度,反应Ⅰ的平衡常数将____(填“增大”“减小”或“不变”)。反应Ⅰ的逆反应的活化能为____(用含E1、E2的表达式表示)。

图9
(2)已知在催化剂和一定压强下,反应Ⅱ能自发进行。若保持容器容积不变,下列措施可增加该反应中CO转化率的是____(填字母)。
A.适当降低温度
B.将甲醇从反应体系中分离出来
C.充入He,使体系总压强增大
D.按原比例再充入CO和H2
(3)一种甲醇燃料电池以多孔石墨为电极,一极通入甲醇蒸气,另一极通入氧气,电解质溶液为4L1mol·L-1的KOH溶液。当有3mol甲醇放电时,电解质溶液中各种离子的浓度由大到小的顺序为____。
(4)图10甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2==2CO2+4H2O。
①M电极的电极反应式为____。

图10
②以上述电池做电源,用图10乙所示装置,在实验室中模拟铝制品表面“钝化”处理的过程,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示)____。Al电极应接燃料电池的____(填“M”或“N”)极。
14.工业上可以从冶炼锌、锌制品加工企业回收的废渣 (含有 ZnCO3、ZnO、FeO、Fe2O3、CuO、Al2O3)来提取氧化锌和金属铜等,其主要工艺流程如下所示。

有关氢氧化物开始沉淀和沉淀完全的pH如表4。

表4
(1)向酸浸液中加入的试剂A有多种选择,若 A是 H2O2,反应的离子方程式是____。
(2)若试剂A为KOH稀溶液,当滴加至Cu2+恰好完全沉淀时,则滤液甲中
(已知:Ksp(Fe(OH)2)=8.0×10-16,Ksp(Cu(OH)2)=2.2×10-20)
(3)当酸浸液的pH用____(填试剂的化学式)调节到3.7至5.2时,可以使两种离子完全沉淀,写出其中任意一种沉淀反应的离子方程式:____。
(4)检验沉淀丙是否洗涤干净,操作方法是____,在实验室进行焙烧时,盛放沉淀丙的仪器名称是____。
(5)上述流程中所得ZnO产品中锌的含量远超过锌渣中锌元素的含量,其原因是____。
15.磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如表5(各元素均以氧化物形式表示)。

表5
磷及部分重要化合物的相互转化如图11所示。

图11
(1)①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是____。
②不慎将白磷沾到皮肤上,可用0.2mol·L-1CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为____。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有____。
(3)磷灰石中,碳元素的质量分数为____%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到(保留两位小数)。
(5)取mg磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol·L-1、硫酸为0.1mol·L-1)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值:___。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下。

表6
(2)该碘盐中肯定不含的物质是____(用化学式或离子符号表达)。
(4)第③份试液中加入足量KI固体后,反应的离子方程式为____,____。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
(1)滴定终点的现象是____。
(2)CuCl2溶液与KI反应的化学方程式为____。
(3)该试样中CuCl2·2H2O的质量分数为____。的
