Na+修饰团簇的结构及其储氢性能
2018-11-02雪麒
, ,,, ,雪麒
(井冈山大学 数理学院,江西 吉安 343009)
1 引 言
经济的发展面临着环境污染和能源紧缺的双重压力,全球可持续发展战略的推进迫切需要寻找既可再生、又对环境无污染的新型能源。氢具有来源广、无污染且能量转换率高等优点,是未来世界能源的核心之一,在新能源汽车等领域具有广泛的应用前景[1]。但利用氢能源需解决好三个主要问题,即氢的制备、储存以及运输,其中最关键的问题是氢的储存[2]。目前最常用的储存方式为高压压缩气体和低温液化储氢,这在运输和使用过程中存在着一定的安全隐患,且能耗和成本较高,无法满足氢能规模化利用,解决氢能储存的关键是开发合适的储氢材料。
储氢材料[3]包括金属氢化物、配位氢化物、无机氢化物、有机材料、金属有机骨架化合物等。其中部分储氢材料如碳、硼、硅纳米管等[4]储氢时,氢分子通过范德瓦尔斯力吸附在材料表面,由于吸附强度很弱(物理吸附),很难在室温条件下应用;而另一部分储氢材料如镁基储氢合金和镁基储氢复合材料[5]、硼氢化锂(LiBH4)及配位金属氢化物等,使氢解离成氢原子,通过化学键紧紧束缚在材料上(化学吸附),必须在高温条件下才能脱氢。理想储氢不仅要有比较高的储氢密度,而且还应具备在常温常压下良好的吸放氢行为和循环稳定性等。可见,以上情况储氢都不理想,理想储氢应该是材料与氢分子之间的相互作用应介于物理吸附与化学吸附之间,既能保证具有较高的储氢能力,又在常温常压下有良好的吸放氢行为[6]。
为了寻找理想的储氢材料,人们对各类储氢材料进行了广泛研究。研究发现在纳米材料表面采用金属原子来修饰,可以较大地提高材料的储氢效率。如纯粹纳米管与氢分子的结合太弱不能有效储氢[7]。而Sc修饰硼富勒烯[8]储氢密度达到8.77wt%;Ti修饰碳纳米管[9]储氢密度可达7.69wt%,均较大地提高了材料的储氢密度。研究也发现,多个金属原子在纳米材料表面可能发生聚合,这不利于储氢循环利用[10]。由于碱金属原子间的内聚力较小,人们采用碱金属原子修饰纳米材料,可减少材料表面的聚合,提高储氢性能,同时可使储氢密度增大[11-15]。
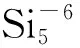
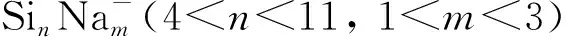
2 计算方法
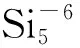
(1)
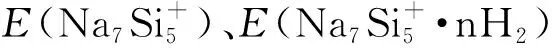
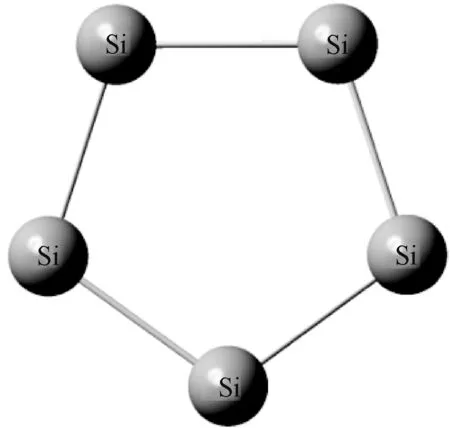
图团簇的稳定结构Fig.1 Stable structure of cluster
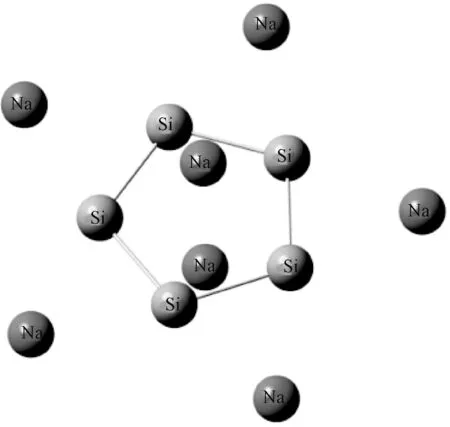
图2 Na7Si5+团簇的稳定结构Fig.2 Stable structure of cluster
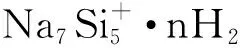
(2)
3 结果与分析
3.1 钠离子修饰团簇的结构特征分析
3.2 氢分子在表面吸附的结构特征
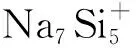
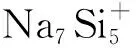
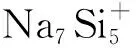
3.3 储氢机理分析

图团簇的稳定结构Fig.3 Stable structures of clusters
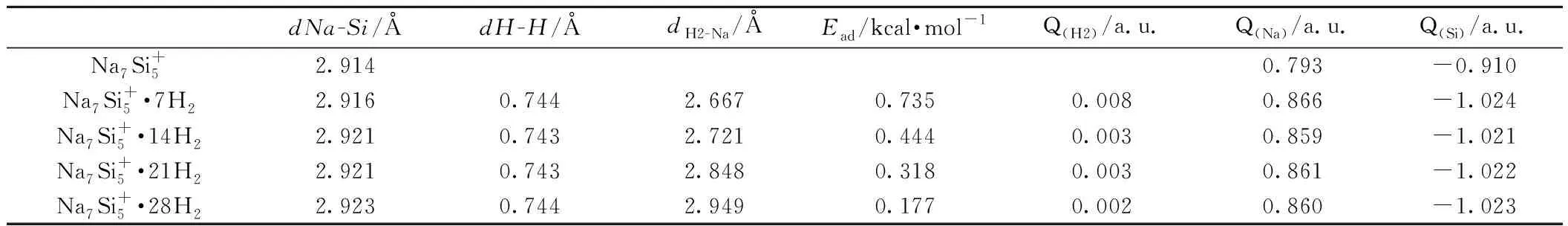
dNa-Si/ÅdH-H/ÅdH2-Na/ÅEad/kcal·mol-1Q(H2)/a.u.Q(Na)/a.u.Q(Si)/a.u.Na7Si+52.9140.793-0.910Na7Si+5·7H22.9160.7442.6670.7350.0080.866-1.024Na7Si+5·14H22.9210.7432.7210.4440.0030.859-1.021Na7Si+5·21H22.9210.7432.8480.3180.0030.861-1.022Na7Si+5·28H22.9230.7442.9490.1770.0020.860-1.023
