聚乙烯醇微球的制备与表征
2018-11-02,,,,,,,,
,,,, ,, ,,
(1.华东师范大学物理与材料学院,上海市磁共振重点实验室,上海 200062; 2.苏州博创同康生物工程有限公司,江苏 苏州 215300)
1 前 言
1955年Vanderhoff[1]等成功地合成了单分散的聚苯乙烯微球,开辟了高分子科学的新研究领域。高分子微球不仅有固相化载体特有的易于分离和提取的优点,还具有廉价、比表面积大、单分散性好、易于制备及功能化等特点[2]。目前,高分子微球已广泛运用于材料科学,化学工程等领域[3]。
聚乙烯醇是一种由聚醋酸乙烯醇解而得到的水溶性高分子,它是一种水溶性高分子材料,具有良好的成膜性及成膜后的抗拉强度、耐磨损性及耐弯曲性等机械性能[4],被广泛应用于纤维加工、纸加工、薄膜等制造工业[5];PVA也可以与其他材料混合,形成复合材料。孙复钱等[6]采用静电纺丝技术制备聚乙烯醇/二氧化钛复合纳米纤维膜,这种材料具有良好的光催化性能,有望在环境污染治理、污水处理等领域得到应用。PVA还具有良好的生物相容性和生物可降解性,近年来相继开发了聚乙烯醇水溶液在眼科[7]、伤口敷料[8]和人工关节[9]等方面的应用,聚乙烯醇薄膜在药用膜,人工肾膜[10]、血管移植[11]等方面的应用;聚乙烯醇微球在药物缓释[12]方面的应用。
以往研究中,作为PVA的交联剂通常为醛类[13],也有的会使用甲基丙烯酸缩水甘油酯(GMA)[14]做为交联剂,但都有一定的毒性。三偏磷酸钠(STMP)是一种对人体无毒的钠盐,为白色结晶或白色粉末,易溶于水,在食品工业中用作淀粉改性剂、果汁饮料防混剂、肉制品保水、黏合剂、分散剂、稳定剂等[15]。本文以三偏磷酸钠为交联剂,与以往常用的交联剂(如甲醛,戊二醛,环氧氯丙烷等)相比,会使交联得到的微球具有更好的生物相容性。而采用反相悬浮的方法制备聚乙烯醇微球,则可以得到粒径分布均匀,球型较佳的微球,这为之后将聚乙烯醇微球作为一种安全的体内植、介入材料,成为一种药物缓释载体提供了基础。
2 实 验
2.1 主要仪器与试剂
以聚乙烯醇(PVA 124,化学纯)为原料,三偏磷酸钠(STMP,化学纯)为交联剂,液体石蜡(化学纯)和失水山梨醇单油酸酯(span-80,化学纯)为油相,氢氧化钠(分析纯)为催化剂来制备聚乙烯醇微球。在制备过程中,向样品加入无水乙醇(分析纯)和异丙醇(分析纯)进行离心处理。
在实验过程中,需要用到的仪器有:电子天平(JA2003),酸度计(PHS-25),鼓风干燥箱(CT-C),离心机(YXJ-B),恒温数显磁力搅拌器(WYP 11-2)。制备微球后,利用傅里叶变换红外光谱仪(Nicolet Nexus 670)和核磁共振波谱仪(AVANCE Ⅲ)分析交联产物的结构;通过扫描电子显微镜(S-48000)以及生物显微镜观察微球的表面形貌,并分析微球的粒径分布和平均粒径大小;利用表面接触角测量仪(Easy Drop FM40)测量微球的表面接触角,分析微球的亲水性。
2.2 聚乙烯醇微球的制备
在搅拌条件下,向40mL液体石蜡中加入2.0g表面活化剂Span-80,构成连续油相;搅拌一段时间后,向油相中加入10mL质量分数为5%的PVA,充分混合后,加入2.0g STMP作为交联剂,最后加入1mL NaOH作为催化剂。设置转速为400r/min,在50℃反应 16h。
交联反应结束后,静置30min。加入少量的无水乙醇,放入离心机中进行离心分离,取出上清液,将沉淀物反复用无水乙醇,异丙醇以及纯水洗涤,最后放入鼓风干燥箱中干燥24h,得到白色粉末。
2.3 测试与表征
将PVA原料和干燥后的PVA微球分别与溴化钾混合研磨、压片后在3900~600cm-1范围内进行红外扫描测试。比较反应前后的特征峰,分析产物的结构,确定交联产物的生成。
采用AVANCE Ⅲ 300MHz 固体核磁共振波谱仪测定产品波谱,并用高功率质子去耦31P NMR光谱分析样品。该仪器1H的共振频率为300.16MHz,31P的共振频率为121.50MHz,样品粉末放入直径为5mm的Zro转子中,转速为8kHz。P的化学位移以85%的磷酸作为参考。所有的循环延迟时间为5s,扫描1024次。
取一定量未经筛分的微球,置于扫描电镜下,观测微球的表面形貌以及计算微球的平均粒径。
Dn=Σnidi/Σni
(1)
其中,Dn为平均粒径,di为微球的直径,ni为该粒径微球的数目。
采用座滴法测量微球接触角,使用去离子水作为液体样品。取一定量聚乙烯醇微球,压片,放入样品台上,调整样品台高度,让聚乙烯醇压片能够承接挤出的液滴,并能在其表面形成液滴。记录此时的接触角大小,并多次测量,取平均值。
精密称取PVA微球50mg(W1),将其浸泡于0.9%的生理盐水中,分别在浸泡15,30,45,60,75及90min时取出微球,擦干微球表面的水分进行称重(W2)。按式(2)计算溶胀率,并绘制溶胀率与时间的关系曲线:
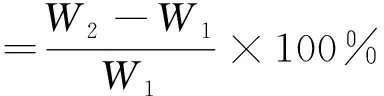
(2)
取50mL质量分数为25%的Nacl溶液,向其中加入50mg PVA微球粉末,超声振荡将微球打散;将pH计插入到配置好的溶液中,用磁力搅拌器慢速搅拌;一边搅拌一边向其中加入浓度为0.1mol/L的HCl准溶液,使得溶液的pH值为4;最后向混合溶液中滴加浓度为0.01mol/L的NaOH标准溶液进行反滴定,滴定到pH值为9,而且保持5min不变时方可视为滴定终点。并用式(3)计算微球表面所含羟基的数量:
(3)
其中,N为羟基的数量,V为所用NaOH的体积(单位为ml),M为PVA的质量,即0.05g。
3 结果与讨论
3.1 PVA的反应机理
STMP作为交联剂,在碱性的条件下,易与聚合物中的-OH基团发生交联酯化反应。据文献[13]推测,其反应如Scheme 1所示。
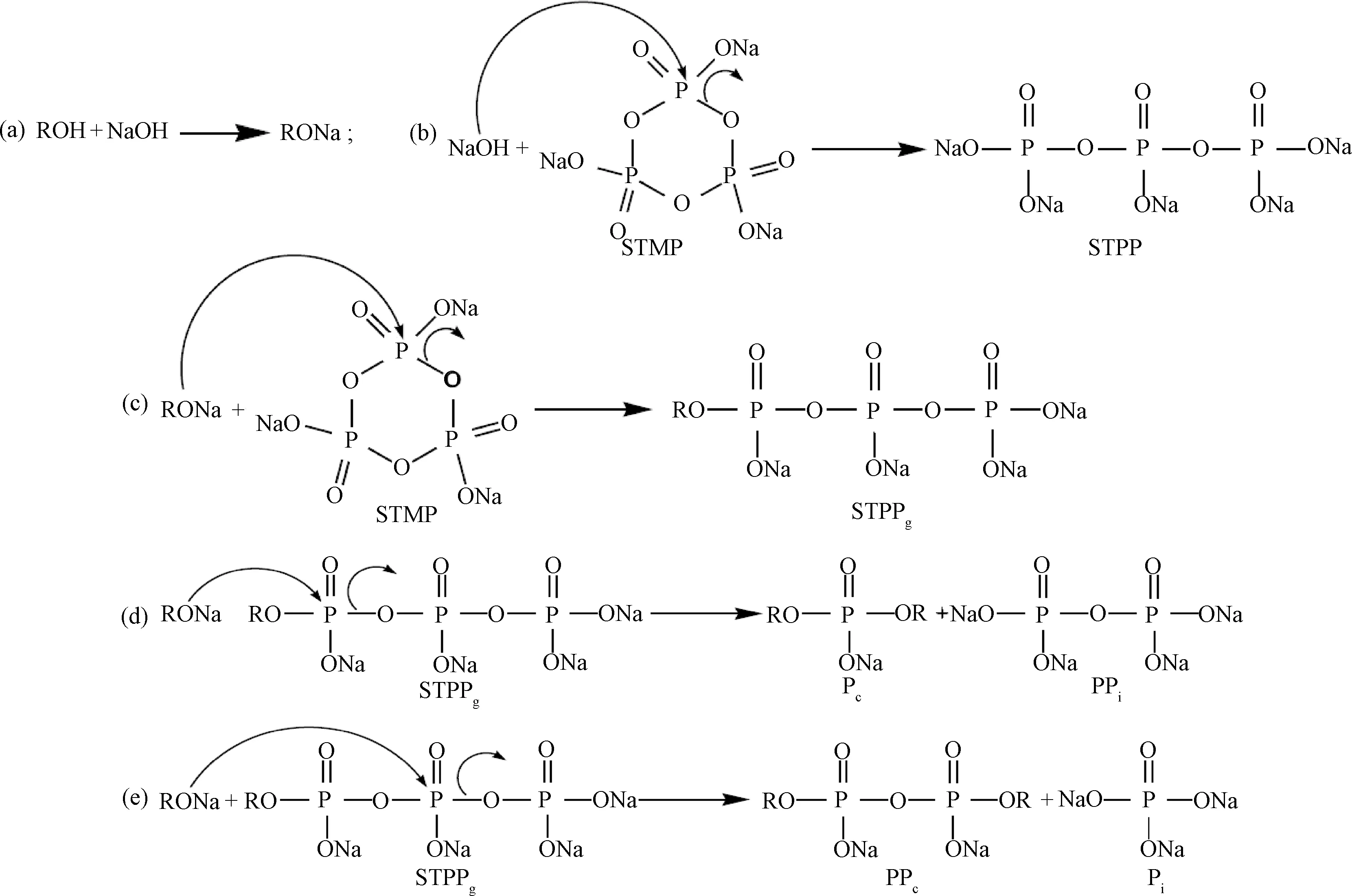
PVA和STMP在碱性条件下发生交联反应的化学反应方程(a) 醇化物的形成; (b) STMP在碱性条件下的分解; (c) STMP的开环; (d) 单磷酸酯的形成; (e) 焦磷酸钠的形成。Scheme 1 STMP reaction with poly(vinyl alcohol)(ROH) in alkaline medium. Alcoholate formation(a), alkaline degradation of STMP(b), STMP opening (c), monophosphate crosslinking formation (d) and pyrophosphate crosslink formation(e)
3.2 红外谱图分析
由于PVA中含有大量的-OH,会与STMP发生酯化反应产生交联,生成磷酸酯类产物。对照PVA和交联之后的PVA谱图可以发现(见图1),交联之后的PVA在3200~3500cm-1范围内的羟基峰有所变化,说明STAM与PVA中的羟基发生了反应。在2937cm-1处的吸收峰为主链亚甲基(-CH2-)的不对称伸缩振动峰。该峰在交联之后的PVA中变得圆滑,且峰的强度有所降低。在1165cm-1处,出现了新的吸收峰,根据文献[15],可把其归结为P=O的振动峰。在1095cm-1处为C-O的吸收峰,对比两图可发现,此处的吸收峰强度变强,是原料和三偏磷酸钠交联之后生成P-O-C基团造成的[16]。
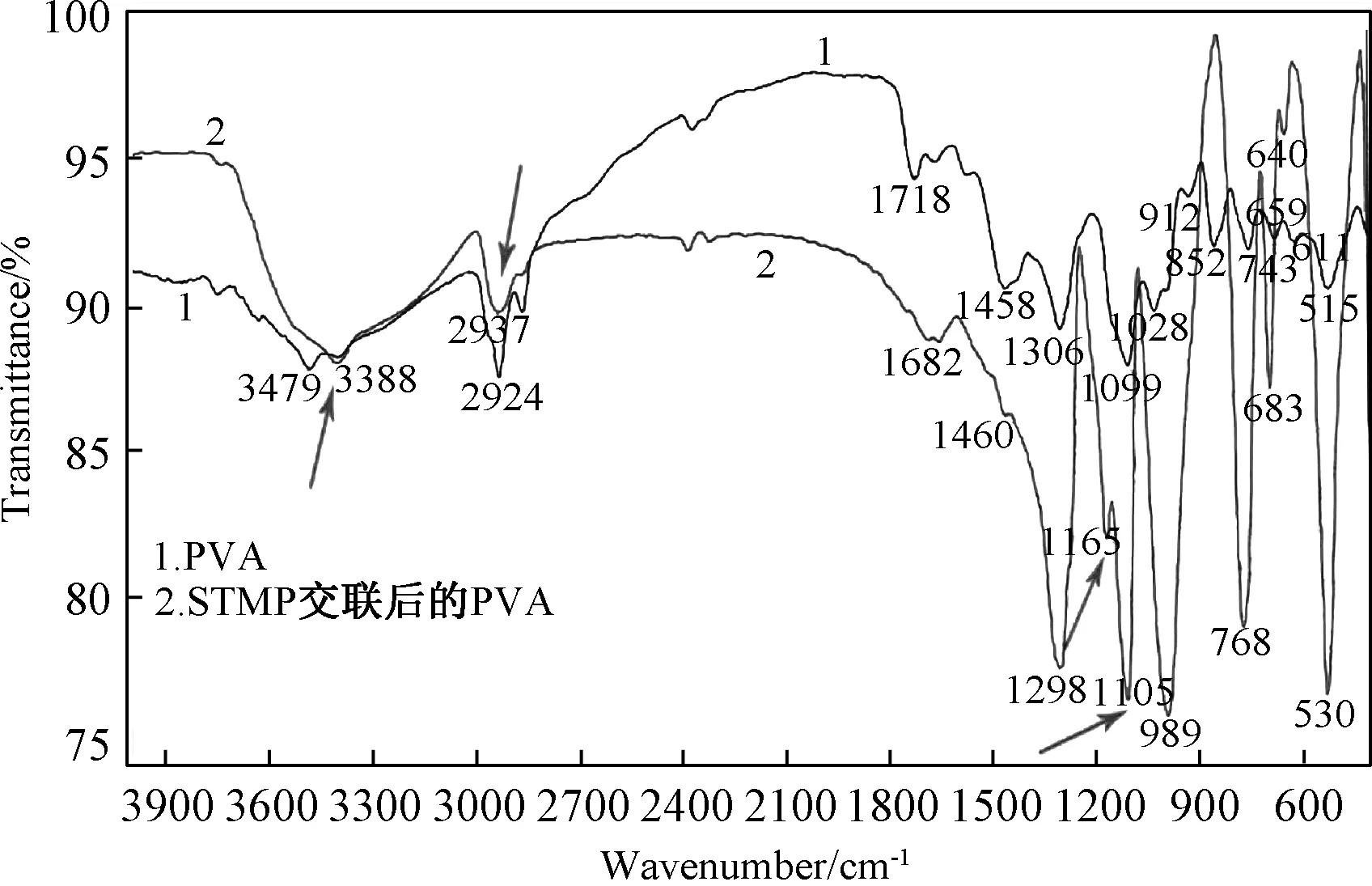
图1 红外图谱(1是PVA,2是STMP交联之后的PVA)Fig.1 FT-IR spectra of PVA without (1) and with crosslinking by STMP (2)
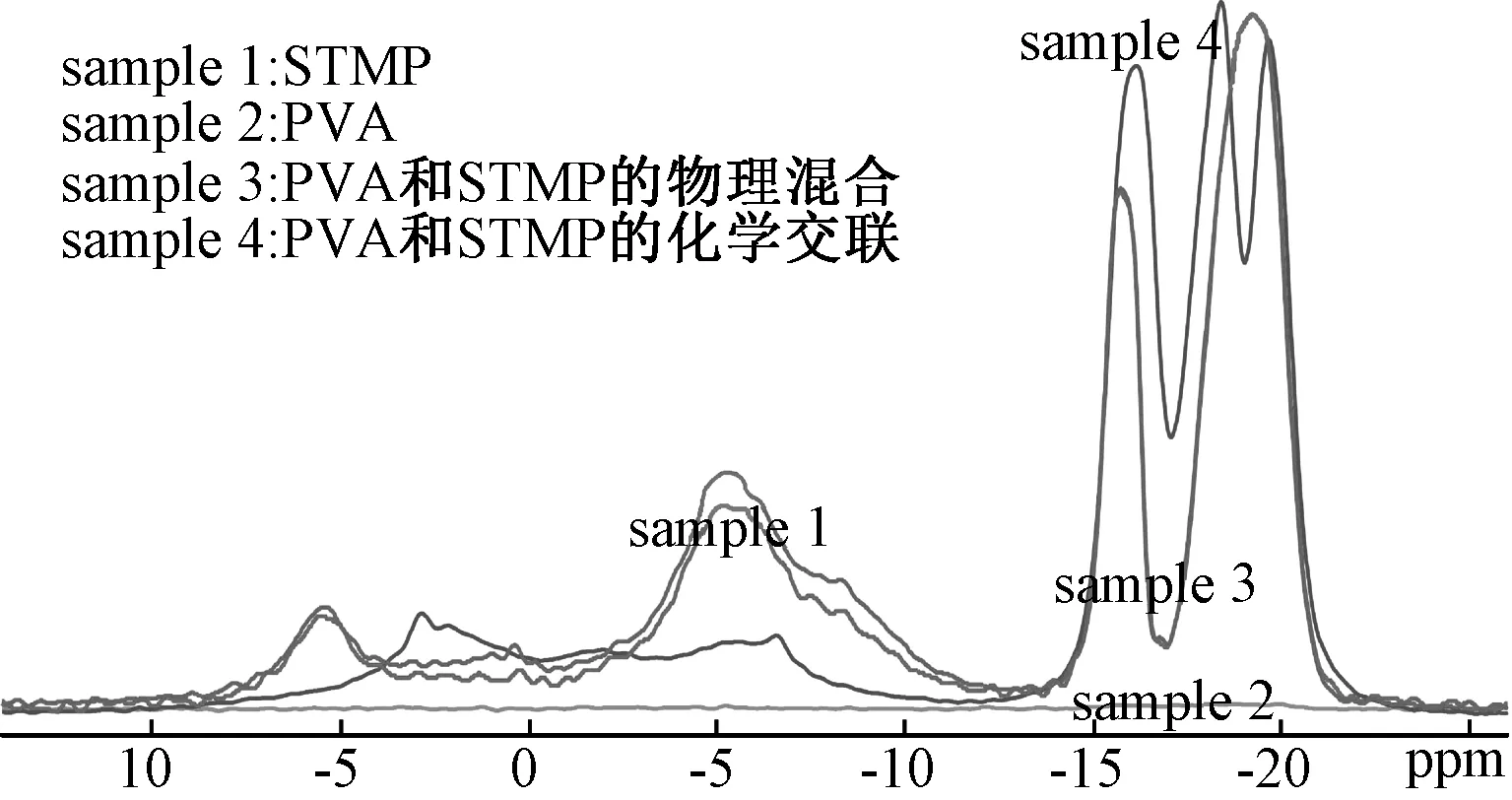
图2 31P核磁谱图(样品1:STMP;样品2:PVA;样品3:PVA和STMP的物理混合;样品4:PVA和STMP的化学交联)Fig.2 Nuclear Magnetic Resonance spectra(Sample 1:STMP; Sample 2:PVA; Sample 3: the physical blending of PVA and STMP; Sample 4: the chemical crosslinking of PVA and STMP)
3.3 核磁波谱分析
图2中,由Sample 2谱可知,PVA中不存在P元素;对比Sample 1和Sample 3谱可以发现,PVA和STMP物理混合的谱和STMP原料的谱相同,说明物理混合后,没有新产物生成;根据文献[17]可知,在-19.05ppm处为STMP的特征峰,代表P=O;除此以外在5.47ppm,-4.89ppm,-15.75ppm处出峰,这是由于在制备STMP过程中的副产物残留,由文献[18,19]可知,其分布对应磷酸钠、焦磷酸钠、多聚磷酸钠;将sample 4谱与Sample 1或Sample 3谱对比可以发现,sample 4谱在多处出现新的峰,根据Sang[20]等人对STMP与-OH发生交联反应之后的产物的31P谱图的分析可推断得:-16.03ppm处对应的产物为三磷酸单聚物(如:单聚乙烯醇三磷酸(MPTP)),-6.38ppm处推断是单聚乙烯醇双磷酸酯(MPDP)的特征峰,而2.72ppm处可归属于单聚乙烯醇单磷酸酯(MPMP)和双聚乙烯醇单磷酸酯(DPMP)。从sample 4中还可以发现在-19.3ppm处仍然存在着P=O的特征峰,以及-18.30ppm处对应的三聚磷酸钠(STPP)的峰,这是因为PVA的粘性比较大,故无法将产物中的杂质完全清除所致[21]。从反应前后的谱图的差异可以看出:PVA与STMP之间发生了交联反应。
3.4 扫描电镜分析
从图3可见,微球的表面形貌良好,粒径较均匀。根据SEM照片中微球的数目,以及每个粒径范围内微球的数量,绘制出图4所示的粒径分布图。
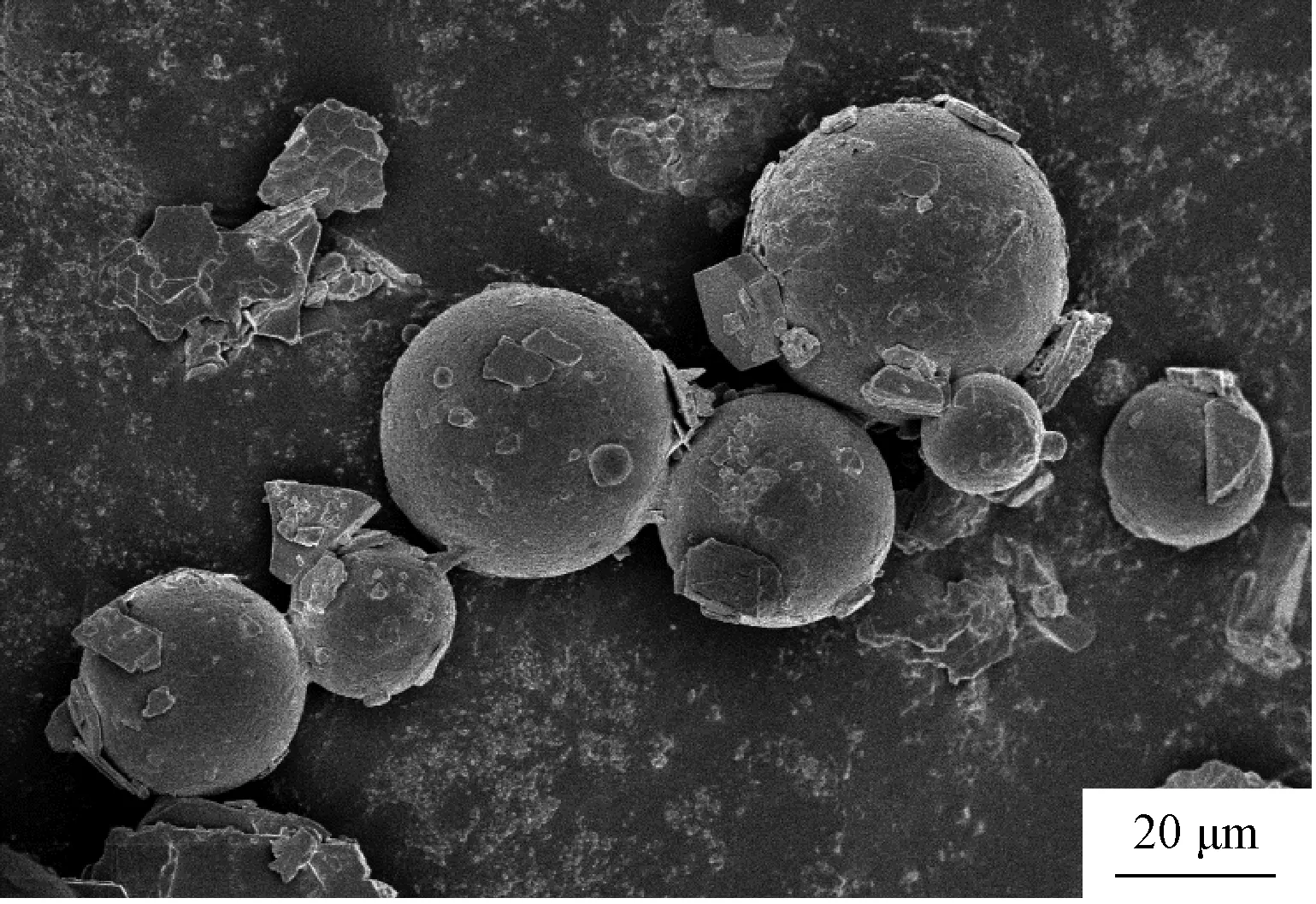
图3 PVA微球的扫描电子显微镜照片Fig.3 SEM image of PVA microspheres
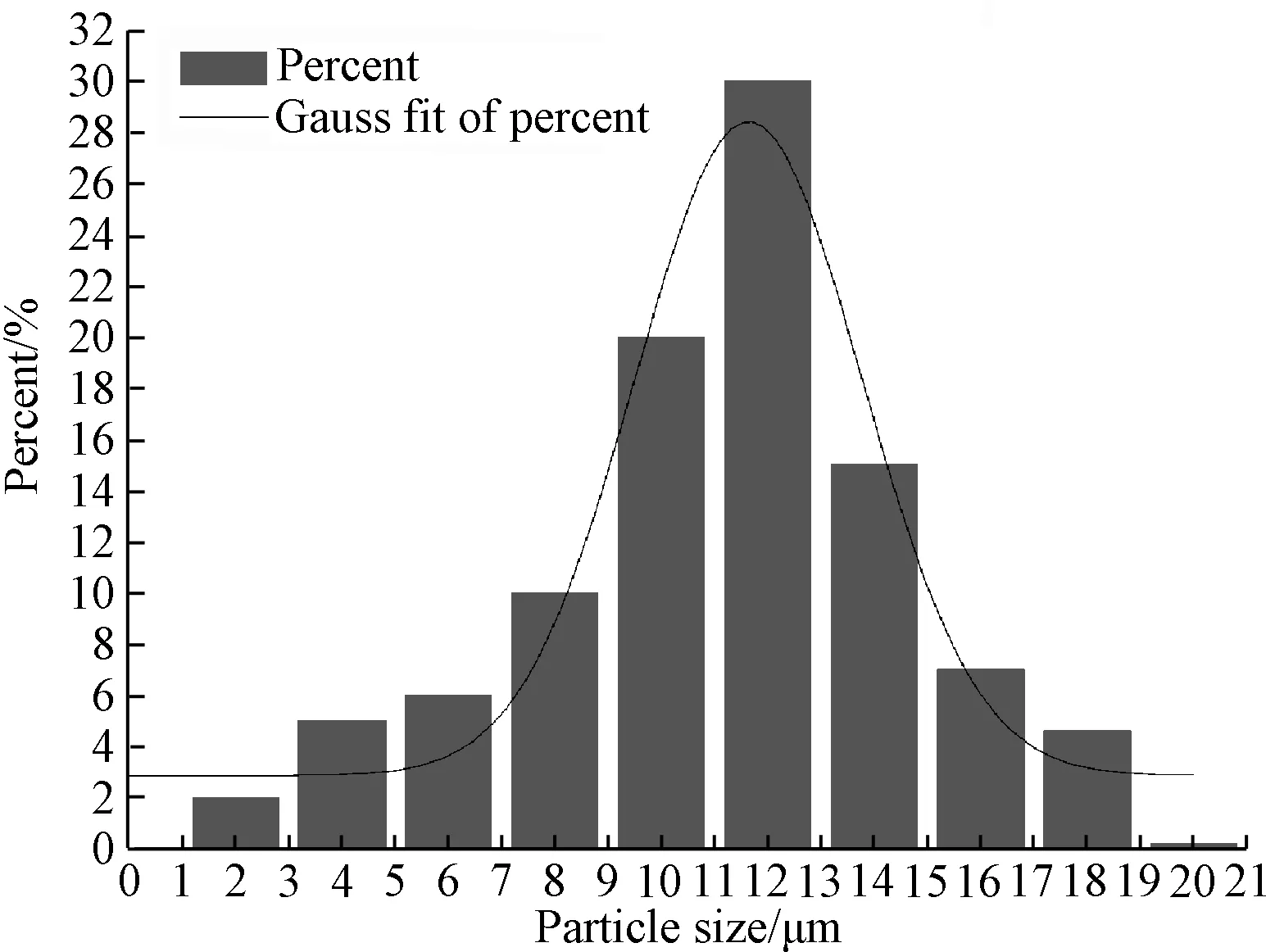
图4 PVA微球的粒径分布图Fig.4 Image of particle size distribution of PVA microspheres
综合所有的微球SEM照片可知,微球的粒径大致分布在1~20μm之间,根据公式计算得出微球的平均粒径为11.5μm。
载药微球系药物与高分子材料制成的球形或类球形实体,通常粒径范围为1 ~ 250μm。药物微球相较于一般的给药系统,具有更好的靶向性。目前,药物微球的给药途径有注射给药、口服给药、肺部给药和鼻腔给药等,而微球粒径的大小就影响着给药途径。本文的PVA微球的粒径可满足药物载体对微球粒径的要求。而由文献[22]可知,PVA水溶液的浓度、PVA与STMP的比例,交联时间、转速、催化剂的用量等都会影响微球的粒径分布。
3.5 接触角测定
接触角是表征液体在固体表面润湿性的重要参数之一,其可以反映液体在一定固体表面的润湿程度。若θ<90°,则固体表面是亲水性的,即液体较易润湿固体,其角越小,表示润湿性越好;若θ>90°,则固体表面是疏水性的,即液体不容易润湿固体,容易在表面上移动。
由于PVA微球表面含有大量羟基,所以具有很好的亲水性,以致于液体样品不能在PVA微球表面形成液滴,而是在非常短的时间(1s)内浸入到压片中,如图5所示。
3.6 溶胀率分析
分别在0~90min时取7个时间点,每隔15min从生理盐水中取出PVA微球,擦干表面水分后称重,计算微球的溶胀率,并绘制出溶胀率与时间的关系曲线,如图6所示。
从图可见,干燥微球在0~15min内快速膨胀,15~30min内溶胀速率逐渐降低,至30min时达到饱和状态,微球的饱和溶胀率为119.6%。
微球作为药物载体进入体内后,在体液的作用下膨胀。膨胀的过程中,会使得微球表面的孔隙增大,以达到释放药物的效果。本文制备的PVA微球在生理盐水中30min后到达饱和,饱和溶胀率为119.6%,这为PVA微球作为载药释药系统奠定了基础。
3.7 微球表面所含羟基数量
按照第2.3节中的实验步骤,最终所使用的0.01 mol/L NaOH溶液的体积为0.15mL,按式(3)计算微球表面所带羟基的数量为:

图5 PVA微球接触角 (a) t=0.2s; (b) t=0.4s; (c) t=0.6s; (d) t=0.8s; (e) t=0.9s; (f) t=1.0sFig.5 Contact angle (a) t=0.2s; (b) t=0.4s; (c) t=0.6s; (d) t=0.8s; (e) t=0.9s; (f) t=1.0s
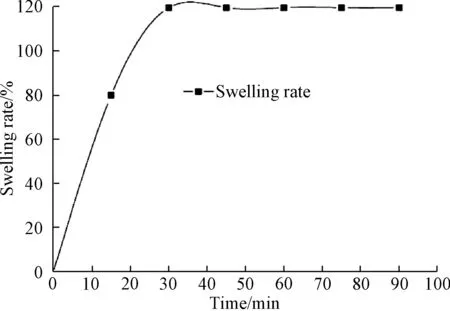
图6 PVA微球的溶胀曲线和溶胀率Fig.6 Curve of the relation of time and the swelling rate
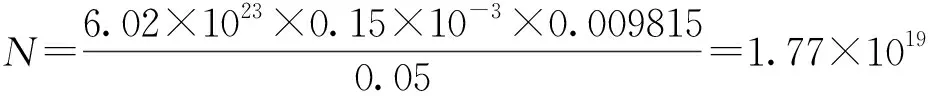
4 结 论
本文用一种无毒的、生物相容性更佳的STMP作为交联剂,采用反相悬浮—化学交联的方法,制备PVA微球。
通过FTIR和NMR对交联产物的结构进行分析,发现 STMP可以与PVA中的-OH发生酯化反应,验证了STMP的确与PVA发生了交联反应,并推测出了PVA与STMP的反应机理:一分子STMP可以与两分子PVA发生交联反应,交联过程分为两步,第一步生成三聚磷酸钠(STPP)和单聚乙烯醇三磷酸酯(STPPg);第二步生成了双聚乙烯醇单磷酸酯(Pc)和焦磷酸钠(PPi)以及双聚乙烯醇双磷酸酯(PPc)和磷酸钠(Pi)。
利用SEM观察到交联之后的微球球型良好,微球的粒径大致分布在1~20μm之间,根据公式计算得出微球的平均粒径为11.5μm。
由接触角的测定分析说明制备得到的交联PVA微球保留有良好的亲水性,而生物材料的亲水性会影响到细胞在材料表面的吸附以及基因表达,以此影响着生物材料的生物相容性[23]。
由公式测得微球在生理盐水中的饱和溶胀率为119.6%。PVA微球的这些性能为之后应用于载药释药系统研究提供了理论依据。
