急性脑梗死患者血清Ⅰ型胶原羧基末端肽改变及其与颈动脉粥样硬化斑块的关系
2018-11-01刘晓辉宋艳玲焦建雄艾文婷
刘 燕 刘晓辉 宋艳玲 焦建雄 艾文婷
越来越多研究证据显示基质金属蛋白酶(matrix metalloproteinase,MMPs)与动脉粥样硬化斑块不稳定性密切相关[1-2]。Ⅰ型胶原是动脉粥样硬化斑块的主要成分,Ⅰ型胶原羧基末端肽(carboxy-terminal telopeptide of type Ⅰ collagen,ⅠCTP)是MMPs依赖性的Ⅰ型胶原的降解产物[3]。因此,有理由推测ⅠCTP也颈动脉粥样硬化斑块破裂相关,可用于评估颈动脉粥样硬化性脑梗死患者斑块稳定性。本研究通过检测226例急性脑梗死患者血清ⅠCTP水平变化,探讨血清ⅠCTP水平与颈动脉粥样硬化斑块稳定性、严重程度的关系,为临床提供参考。
资料与方法
1.研究对象 连续性选择2016年1月至2017年3月,于我科治疗的266例急性脑梗死患者作为病例组,纳入标准:①年龄45~80岁;②急性脑梗死诊断符合《中国急性缺血性脑卒中诊治指南2010》[4],头颅CT/MR检查证实为前循环脑梗死;③且按照TOAST(Trial of Org 10172 in Acute Stroke Treatment)分型标准为大动脉粥样硬化性脑梗死;④初次发病,发病到入院时间≤48h;⑤临床资料完整。排除标准:①其他TOAST分型脑梗死;②合并其他中枢神经系统疾病;③合并恶性肿瘤,或严重肝、肾器疾病;④妊娠期女性;⑤合并精神疾病,或意识障碍。按照颈动脉超声检查结果将病例组分为稳定斑块组,不稳定斑块组和无斑块组。其中稳定斑块组73例,包括男性45例,女性28例,平均年龄(67.2±7.1)岁;不稳定斑块组116例,包括男性77例,女性39例,平均年龄(65.8±7.5)岁;无斑块组77例,包括男性42例,女性35例,平均年龄(67.0±8.2)岁。另外,随机选择同期在我院体检的80例颈动脉超声检查双侧颈动脉均无粥样硬化斑块的健康体检者作为对照组,其中包括男性46例,女性34例,平均年龄(66.5±7.8)岁。本研究通过我院伦理委员会审核批准,所有病例组和对照组成员均充分知情同意。
2. 颈部血管超声检查 所有检测人员经过统一培训,仔细记录被检者双侧颈动脉狭窄程度及斑块回声强度。将内中膜厚度>1.5 mm并突向管腔内作为诊断斑块标准。颈动脉狭窄程度分级:轻度狭窄(<50%)、中度狭窄(50%~69%)、重度狭窄(70%~99%)及闭塞。采用常规超声联合微血流成像(superb microvascular imaging,SMI)技术评价颈动脉斑块性质,分为稳定斑块和不稳定斑块,不稳定斑块的超声回声及血流特征: 低回声或极低回声;斑块内部含低-无回声区;溃疡斑块;新生血管形成斑块。SMI诊断斑块内新生血管标准:斑块内可见短线或条状血流信号[5]。颈动脉粥样硬化斑块狭窄率及稳定性均以病灶侧颈动脉检查结果进行区分。上述检查由2位超声科专业医师依据上述标准对超声图像进行判定,重测信度为97%。
3. 血清ⅠCTP、MMP-2、MMP-9检测 采集清晨空腹外周静脉血3mL,采集的血液30min内3 000r/min离心20 min,提取上清液1mL,-80℃保存备用。采用ELISA法血清ⅠCTP、MMP-2、MMP-9水平,ⅠCTP检测试剂盒购自美国R&D公司,MMP-2和MMP-9检测试剂盒购自武汉博士德生物工程有限公司,严格按照说明书进行操作。
4. 统计学方法 采用SPSS19.0统计软件分析处理。计量资料以均数±标准差表示,两组均数比较用t检验,多组均数比较采用单因素方差分析,其组内两两比较采用SNK-q检验;计数资料结果以百分比表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
1. 各组基本临床特征比较 各组在年龄、性别、体质量指数(body mass index,BMI)、吸烟、高血压、糖尿病、TC和低LDL-C等方面,均差异无统计学意义。

表1 各组基本临床特征比较
2.各组血清ⅠCTP,MMP-2和MMP-9比较 四组血清ⅠCTP水平依次升高。不稳定斑块组较稳定斑块组血清MMP-2和MMP-9均显著升高,梗死组(无斑块组、稳定斑块组和不稳定斑块组)和对照组比较,血清MMP-2和MMP-9水平均显著升高,稳定斑块组和无斑块组比较,血清MMP-2和MMP-9水平差异无统计学意义(表2)。
3. 血清ⅠCTP,MMP-2和MMP-9与颈动脉粥样硬化斑块的关系 双侧颈动脉均存在粥样硬化斑块患者血清ⅠCTP,MMP-2和MMP-9水平均显著高于仅单侧存在斑块患者。血清ⅠCTP,MMP-2水平随局部狭窄程度依次升高,重度/闭塞患者血清MMP-9高于轻、中度狭窄患者,轻度和中度狭窄患者血清MMP-9水平差异无统计学意义(表3)。
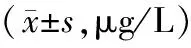
表2 各组血清ⅠCTP,MMP-2和MMP-9比较
注:与对照组比较,*P<0.05;与无斑块组比较,#P<0.05;与 稳定斑块组比较,△P<0.05
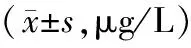
表3 血清ⅠCTP,MMP-2和MMP-9与颈动脉粥样硬化斑块的关系
注:与单侧,*P<0.05;,与 轻度,#P<0.05;与中度,△P<0.05
讨 论
正常人类动脉壁中的主要胶原亚型是I型(70%~75%)和Ⅲ型(20%~25%)。动脉粥样硬化形成时,I型胶原明显增加,构成脂纹和斑块的重要组成成分。MMPs家族是人体降解细胞外基质的一类重要蛋白酶,可参与包括I型胶原在内多种胶原蛋白和弹性蛋白的降解过程,与动脉粥样硬化斑块不稳定性密切相关[6]。本研究结果显示不稳定斑块组较稳定斑块组血清MMP-2和MMP-9均显著升高,再次证实血清MMPs与斑块易损性密切相关。另外,既往研究结果显示颈动脉粥样硬化性脑梗死患者血清MMP-2和MMP-9水平显著升高[7-8]。本研究结果也显示梗死组(无斑块组、稳定斑块组和不稳定斑块组)和对照组比较,血清MMP-2和MMP-9水平均显著升高,与既往研究结果相符,表明MMPs可能不仅与粥样硬化斑块稳定性相关,还可能直接参与脑梗死相关的病理生理过程。
长期以来,ⅠCTP仅作为转移性骨肿瘤的监测指标在临床中被应用[9]。近年来有研究以排除了骨肿瘤的冠心病患者为研究人群,发现血清ⅠCTP水平与冠状动脉粥样硬化斑块核心坏死体积呈正相关关系,提示血清ⅠCTP可作为评估冠状动脉粥样硬化斑块稳定性的指标[10-11]。本研究结果显示,不稳定斑块组和稳定斑块组比较,血清ⅠCTP水平显著升高;梗死组(无斑块组、稳定斑块组和不稳定斑块组)和对照组比较,血清ⅠCTP水平均显著升高,提示血清ⅠCTP与MMPs一致,均与颈动脉粥样硬化斑块稳定性和脑梗死密切相关。最后,本研究比较双侧和单侧颈动脉粥样硬化斑块形成患者,以及不同狭窄程度患者血清ⅠCTP,MMP-2和MMP-9水平,结果显示双侧组血清ⅠCTP,MMP-2和MMP-9水平均较单侧组显著升高,血清ⅠCTP,MMP-2和MMP-9水平也均与颈动脉粥样硬化斑块局部狭窄程度呈正相关关系。田祥全等[12]发现ⅠCTP与冠状动脉粥样硬化病变血管数量及狭窄程度均呈正相关关系。Kondo等[13]研究发现血清ⅠCTP浓度与颈动脉内膜厚度呈正相关关系,本研究该结果与之相符,再次证实血清ⅠCTP与MMP-2、MMP-9相似,与动脉粥样硬化斑块进展过程密切相关,可用于评价动脉粥样硬化严重程度。本研究还发现无斑块组与稳定斑块组比较时,血清MMP-2和MMP-9差异均无统计学意义,但两组间血清ⅠCTP差异具有统计学意义。笔者分析认为MMPs作为降解斑块胶原成分的始动因素,而血清ⅠCTP作为I型胶原的降解产物,在斑块形成早期MMPs表达尚未明显增加,但通过降解反应的级联扩增效应,血清中降解产物ⅠCTP已明显增加。提示血清ⅠCTP可更好反应颈动脉粥样硬化斑块状态,对预测斑块稳定可能更具优势。
综上所述,血清I CTP可用于评估斑块不稳定性,及颈动脉粥样硬化严重程度。当然,本研究也存在不足之处,首先,限于条件本研究关于颈动脉粥样硬化斑块性质及局部狭窄程度的评估均主要依据二维超声结果,与目前更精确的检查方式(包括斑块血管超声造影及脑血管造影等)比较,可能存在一定误差,对研究结果造成影响,期待未来采用更准确评估方法的研究进一步验证。其次,本研究纳入研究对象相对较少,期待进一步大样本及严格设计的临床试验结果验证。
