籼米中淀粉粒结合蛋白的分离鉴定及提取工艺优化
2018-10-31陈兰煊易翠平
陈兰煊,杨 阳,易翠平*
(长沙理工大学化学与生物工程学院,湖南 长沙 410114)
淀粉粒结合蛋白(starch granule-associated proteins,SGAPs)是指紧密结合于淀粉表面及内部、具有显著特征的一类蛋白质[1],占籼米质量分数的0.2%~0.5%;它不同于普通蛋白,多以酶的形式存在于淀粉颗粒中决定其结构及形态[2],并对淀粉的糊化特性[3]、颗粒性质及整个谷物体系的品质有着重要影响[4],以颗粒淀粉合成酶(granule-bound starch synthase,GBSS)最为典型[5-6]。但由于籼米SGAPs含量低、组分复杂,又与淀粉颗粒结合紧密[7-8],相关研究不易开展,关于籼米中SGAPs研究鲜有报道,国内外研究主要集中在小麦和玉米等谷物中。目前,谷物SGAPs的分离主要采用NaCl溶液、2-丙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和二硫苏糖醇等强极性溶液进行搅拌浸泡[9-12];但文献[13-15]指出,这种分离方法并不能将小麦SGAPs全部提取,Sargeant等[15]报道采用NaCl溶液仅能提取小麦总SGAPs的10%,Turnbull等[14]证明采用10% SDS溶液提取小麦SGAPs效率更高。因此,本研究拟采用SDS缓冲液提取籼米SGAPs,对所提取SGAPs进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离及高效液相色谱-串联质谱(high performance liquid chromatographtandem mass spectrometry,HPLC-MS/MS)鉴定;以响应面法优化SDS添加量、沸水浴时间、不同金属离子对籼米SGAPs分离纯化的工艺条件。为进一步分离及分析SGAPs组分对籼米基本品质的影响提供实验参考。
1 材料与方法
1.1 材料与试剂
籼米:浙富802;SDS、丙三醇(甘油)、2-巯基乙醇、乙醇、三(羟甲基)氨基甲烷、溴酚蓝、甘氨酸、考马斯亮蓝G250、N,N-亚甲基丙烯酰胺、丙烯酰胺(均为分析纯) 国药集团化学试剂有限公司;过硫酸铵(分析纯) 西陇科学股份有限公司;乙酸、甲醇、磷酸(均为分析纯) 广东省化学试剂工程技术研究开发中心。
1.2 仪器与设备
Triple TOF®5600 HPLC-MS/MS仪、Eksigent nanoLC-Ultra™ 2D纳升液相系统 美国AB SCIEX公司;5418R型高速冷冻离心机 德国Eppendorf公司;Savant DNA120离心浓缩仪 美国Thermo Fisher公司;UV-2800型分光光度计 尤尼柯(上海)仪器有限公司;AVY120型分析天平 北京赛多利斯天平有限公司;DK-2000-L型恒温水浴锅、FW100型万能粉碎机、HJ-1型磁力搅拌器 天津泰斯特仪器有限公司;DHG-9140A型鼓风干燥箱 上海一恒科学仪器有限公司;DYCZ型电泳仪 北京市六一仪器厂。
1.3 方法
1.3.1 籼米淀粉制备
取过100 目的脱脂籼米粉,以0.045 mol/L NaOH溶液洗去蛋白,重复5 次,3 500 r/min离心,得到上层黄淀粉糊、中层白淀粉、下层黄淀粉(以下简称上、中、下层),用0.1 mol/L HCl溶液调pH值中性,洗涤、离心、低温烘干,4 ℃贮藏备用[16-17]。
1.3.2 SDS-PAGE分析蛋白亚基
根据Laemmli[18]的方法:采用不连续缓冲系统,分离胶12%,浓缩胶4%,胶板厚度1.0 mm,进样量15 μL,在80 V稳流电压下电泳,样品条带至胶板底部1 cm左右停止,采用考马斯亮蓝G250染色约4 h,脱色至条带清晰。
1.3.3 HPLC-MS/MS鉴定
样品经SDS-PAGE得到60 kDa亚基条带,经胰蛋白酶充分酶解得到上清液,离心浓缩干燥后得到胰酶切多肽[19-21]。将胰酶切多肽溶解入Nano-RPLC流动相A(0.1%甲酸溶液,2%乙腈溶液),装瓶上样到C18预柱(100 μm×3 cm,3 μm,150 Å),进行在线HPLC-MS/MS分析:流动相流速2 μL/min、10 min,液相采用C18反相色谱柱(75 μm×15 cm,3 μm,120 Å,Chrom XP Eksigent)分离,梯度洗脱为60 min内流动相B(0.1%甲酸,95%乙腈溶液)由5%升高至40%。质谱采用Triple TOF®5600系统结合纳升喷雾III离子源,喷雾电压为2.3 kV,气帘气压为30 psi,雾化气压为5 psi,加热温度为150 ℃,质谱扫描方式为信息依赖的采集工作模式下,一级飞行时间质谱单张图谱扫描时间为250 ms,每次采集工作模式循环下最多采集35 个电荷为2+到5+且单秒计数大于200 cps的二级图谱,每张二级图谱的累积时间为60 ms。每次循环时间固定为2.5 s,碰撞室能量设定适用于所有前体离子碰撞诱导解离,动态排除设置为12 s,约等于色谱半峰宽。
1.3.4 SGAPs的分离纯化
1.3.4.1 SGAPs的提取及测定
分别取1.0 0 g样品,加入S D S提取液(3%~12% SDS,5%巯基乙醇,10%甘油,62.5 mmol/L Tris,pH 6.9),搅拌均匀,沸水浴加热,冷却至室温后15 000 r/min离心15 min,考马斯亮蓝G250染色法测定上清液的蛋白含量[22]。
1.3.4.2 单因素试验
以样品煮沸时间3 min、MgSO4浓度0.75 mmol/L、SDS添加量9%为基本条件,改变SDS添加量:3%、5%、7%、9%、10%、12%,样品煮沸时间:1、2、3、4、5 min,浓度均为0.75 mmol/L的金属离子缓冲液:NaCl、MgCl2、KCl、CaCl2、Na2SO4、K2SO4、CaSO4、MgSO4,MgSO4浓度:0.25、0.5、0.75、1.00、1.25、1.50、2.00、2.50 mmol/L进行单因素试验。
1.3.4.3 响应面试验
在单因素试验的基础上,以提取SGAPs含量为响应值,选取SDS添加量、煮沸时间、MgSO4浓度3 个因素,设计3因素3水平的响应面分析试验。各因素与水平设计见表1。
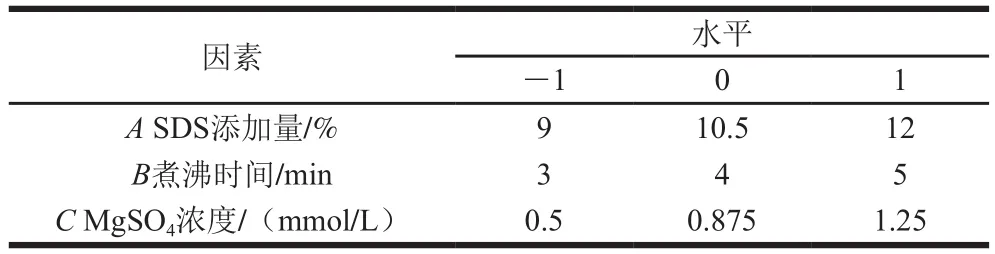
表1 响应面试验因素与水平Table 1 Coded levels for independent variables used in response surface analysis
1.4 数据统计与分析
实验数据采用Excel 2007、SPSS软件进行方差分析,Duncan新复极差法进行多重比较;HPLC-MS/MS鉴定采用Maxquant软件进行数据加工处理和检索分析,数据库为Uniprot的oryza sativa japonica物种蛋白数据库。
2 结果与分析
2.1 籼米淀粉蛋白含量
将籼米粉碱洗5 次后得到上、中、下层淀粉3 个样品,与籼米粉一起,分析其蛋白质量分数(表2)。结果表明,蛋白质量分数由低到高分别是中层、下层、上层、籼米粉,且经分离后的3层淀粉蛋白质量分数均低于0.5%,与Koziol等[23]报道SGAPs在籼米淀粉颗粒中质量分数为0.2%~0.5%一致,说明残留淀粉中的蛋白可能是SGAPs。

表2 碱处理籼米粉各组分的蛋白含量分析(n=3)Table 2 Protein content of starch layers of alkali-washed indica rice fl our (dry basis, n= 3)
2.2 蛋白亚基分析
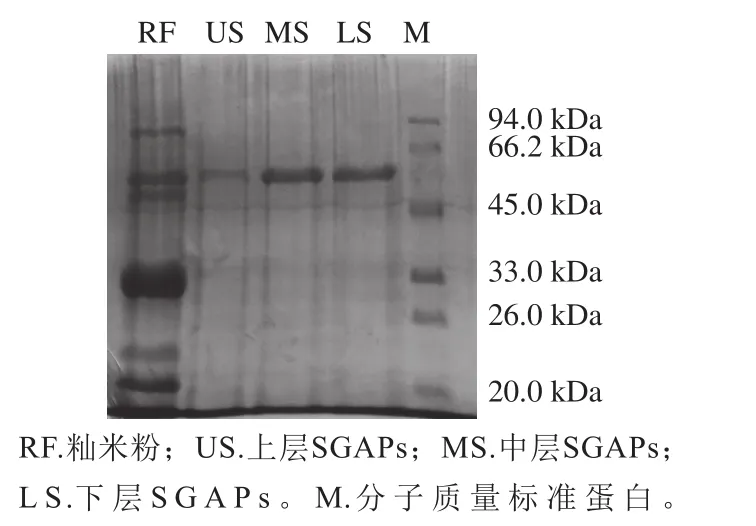
图1 籼米粉及不同籼米淀粉所提SGAPs的SDS-PAGE图Fig. 1 SDS-PAGE image of SGAPs from indica rice fl our and different rice starch layers
将各层淀粉提取的SGAPs及籼米粉蛋白质进行电泳(图1),结果表明,与籼米粉蛋白亚基对照,3 层淀粉所提的SGAPs基本一致,均只有60 kDa亚基条带,说明多次碱洗后以SDS缓冲液提取能有效去除其他杂蛋白,得到较纯的SGAPs。其中,中层亚基颜色最深,下层次之,上层最浅,与上、中、下3 层淀粉中的蛋白含量呈相反趋势,说明上层淀粉蛋白中残留更多的与淀粉分子结合紧密的储藏蛋白,如谷蛋白、醇溶蛋白;中层淀粉SGAPs含量最高且更纯。
2.3 SGAPs的HPLC-MS/MS鉴定结果
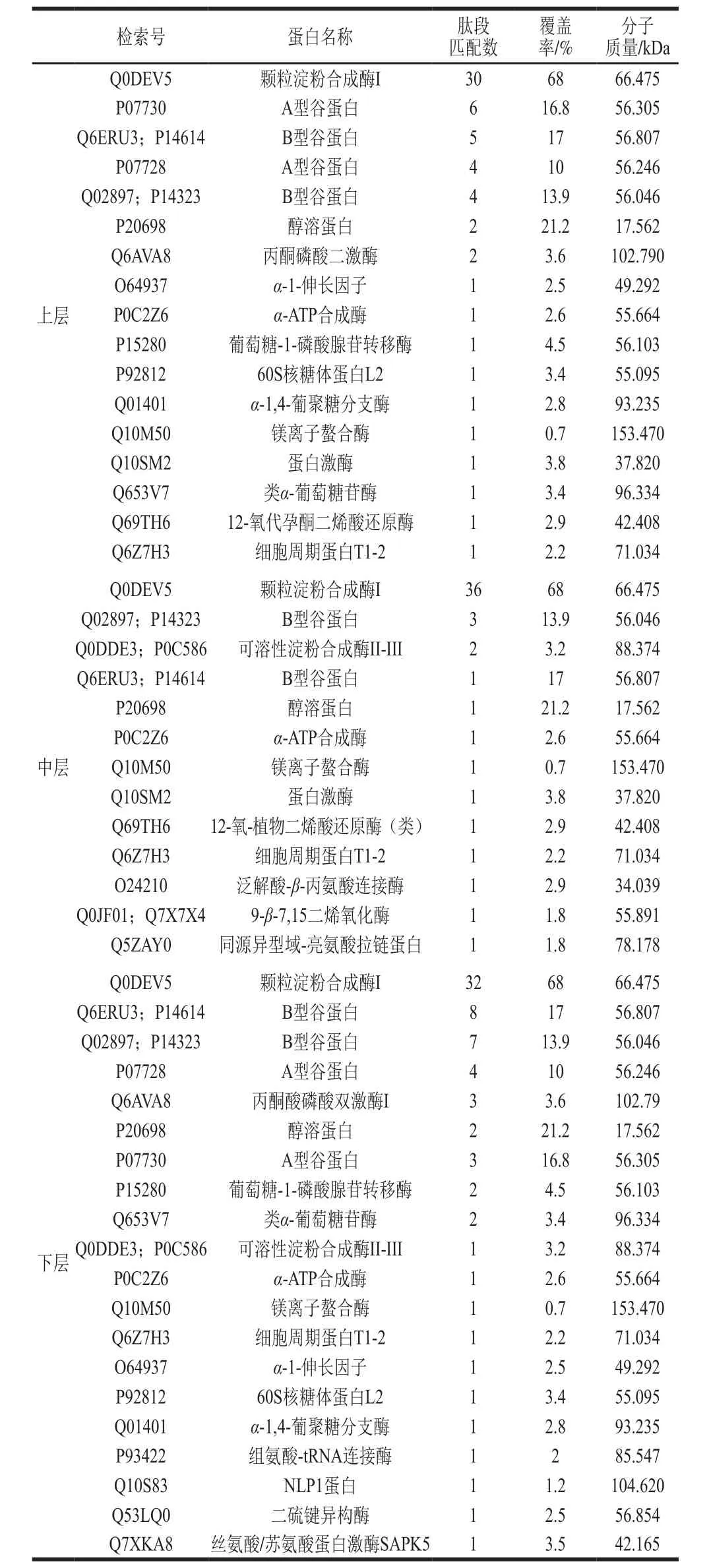
表3 SDS-PAGE条带HPLC-MS/MS鉴定结果Table 3 HPLC-MS/MS analysis of the bands from SDS-PAGE
对电泳分离的60 kDa蛋白条带通过HPLC-MS/MS法进行鉴定[24],结果见表3,3层淀粉中的60 kDa蛋白均是以GBSS I为主的SGAPs,其中上层含A型谷蛋白0.58%、B型谷蛋白1.94%、醇溶蛋白0.15%、GBSS I 97.33%;中层淀粉SGAPs含量较为单一,GBSS I 99.80%、B型谷蛋白仅0.11%,可见SDS缓冲液能有效分离出中层淀粉SGAPs;下层淀粉仍以97.51%的GBSS I为主,A型谷蛋白0.15%、B型谷蛋白0.97%、醇溶蛋白0.06%,除此之外还含0.75%的α-ATP合成酶以及参与细胞代谢、能量调控及DNA转录和翻译的酶类和蛋白,如α伸长因子、60核糖体蛋白L2、NLP1蛋白、丙酮酸磷酸二激酶等。
HPLC-MS/MS结果表明,以SDS缓冲液从籼米淀粉中分离SGAPs的方式可行,能有效提取出SGAPs,且籼米中的SGAPs以GBSS I为主并以主要生物酶的形式负责谷物中的淀粉合成,影响直链淀粉与支链淀粉的比例[25]。上、中、下3 层淀粉中以中层淀粉的SGAPs含量最高最纯,因此选取中层淀粉进行SGAPs提取的优化试验。
2.4 单因素试验结果
2.4.1 SDS添加量对SGAPs提取量的影响
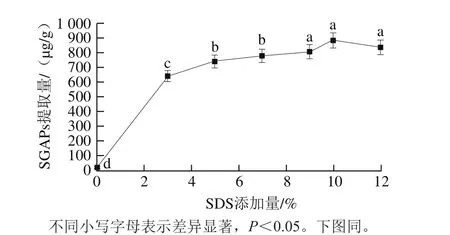
图2 SDS缓冲液添加量对SGAPs提取量的影响Fig. 2 Effect of SDS buffer concentration on the extraction efficiency of SGAPs
如图2所示,SDS添加量对SGAPs提取量有显著影响(P<0.05),随着SDS添加量加大,SGAPs提取量逐渐升高,当SDS添加量为10%时达到最大提取量,随着SDS添加量继续升高,样品的SGAPs提取量开始有所下降,是由于SDS分子中的长链疏水基团与蛋白质分子内部的非极性基团相互作用,打破其原来有序结构[26],使蛋白质构象发生变化,目标蛋白变性,从而导致SGAPs的提取量降低。因此,提取籼米中SGAPs的最佳SDS添加量为10%。
2.4.2 煮沸时间对SGAPs提取量的影响
由于SGAPs紧密结合于淀粉颗粒内部,即便是盐浓度很高的提取液或缓冲液在低温下都很难进入到淀粉分子的内部与其作用[27]。利用高温条件下淀粉颗粒的糊化作用[28],淀粉颗粒的内部SGAPs缓慢膨胀并慢慢暴露,与反应试剂发生作用,由此可以分离纯化得到SGAPs[29]。因此煮沸时间对SGAPs的提取有重要影响。由图3可知,当煮沸时间为4 min时SGAPs提取量显著高于其他条件下提取量(P<0.05)。而随着煮沸时间的延长,SGAPs提取量逐渐下降。可能是由于一般淀粉颗粒在温度达到50 ℃时开始膨胀,反应试剂开始逐渐进入淀粉颗粒内部,当温度达到90 ℃时淀粉完全糊化[30],提取试剂最大程度与SGAPs接触,此时所用时间为4 min,随着煮沸时间延长,所提SGAPs由于高温作用已经发生热变性,导致在测定SGAPs提取量时呈逐渐减少趋势。
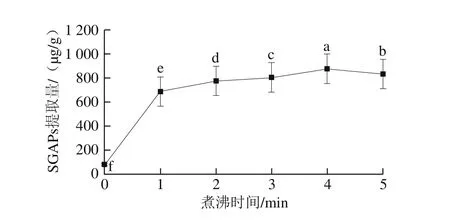
图3 煮沸时间对SGAPs提取量的影响Fig. 3 Effect of heating time in boiling water bath on the extraction efficiency of SGAPs
2.4.3 金属离子对SGAPs提取量的影响

图4 金属离子对SGAPs提取量的影响Fig. 4 Effect of metal ions on the extraction efficiency of SGAPs

图5 MgSO4浓度对SGAPs提取量的影响Fig. 5 Effect of magnesium ion concentration on the extraction efficiency of SGAPs
在SDS缓冲液中分别加入了Na+、K+、Mg2+和Ca2+等阳离子以及不同的阴离子Cl-和后,对淀粉颗粒上的SGAPs进行提取。如图4所示,不同金属离子对SGAPs的解离有显著影响(P<0.05),其中加入MgSO4后从淀粉颗粒上解离的SGAPs最多。由图5可知,随着MgSO4浓度的增大,SGAPs提取量呈先增大后减小的趋势。MgSO4浓度为0~0.75 mmol/L时,SGAPs提取量不断提高;浓度为0.75 mmol/L时,SGAPs提取量达到最大;当MgSO4浓度大于0.75 mmol/L后,SGAPs提取量逐渐下降。由于共价键不随离子类型与强度的变化而异[31],籼米SGAPs的解离随离子类型与强度的变化而变化,因此判断SGAPs结合力为非共价键。
2.5 响应面试验优化结果
采用Design-Expert 8.0.6.1软件中的Box-Behnken设计试验,结果见表4。

表4 响应面试验设计与结果Table 4 Experimental design and results for response surface analysis

表5 中层籼米淀粉提取SGAPs回归模型方差分析Table 5 Analysis of variance for the regression model describing the extraction efficiency of SGAPs
从表5可以看出,一次项A、B、C对SGAPs提取量的影响均达到极显著水平(P<0.01);交互项AB、BC达到极显著水平(P<0.01),交互项AC不显著(P>0.05),二次项A2、B2、C2、D2均达到极显著水平(P<0.01)。其中模型极显著(P<0.000 1),失拟项不显著(P=0.220 6>0.05),模型决定系数R2值为0.991 9,校正决定系数值为0.998 3,说明该模型能较好地反映SGAPs提取量与SDS添加量、煮沸时间、MgSO4浓度之间的关系,由此可见,这种试验方法是可靠的。
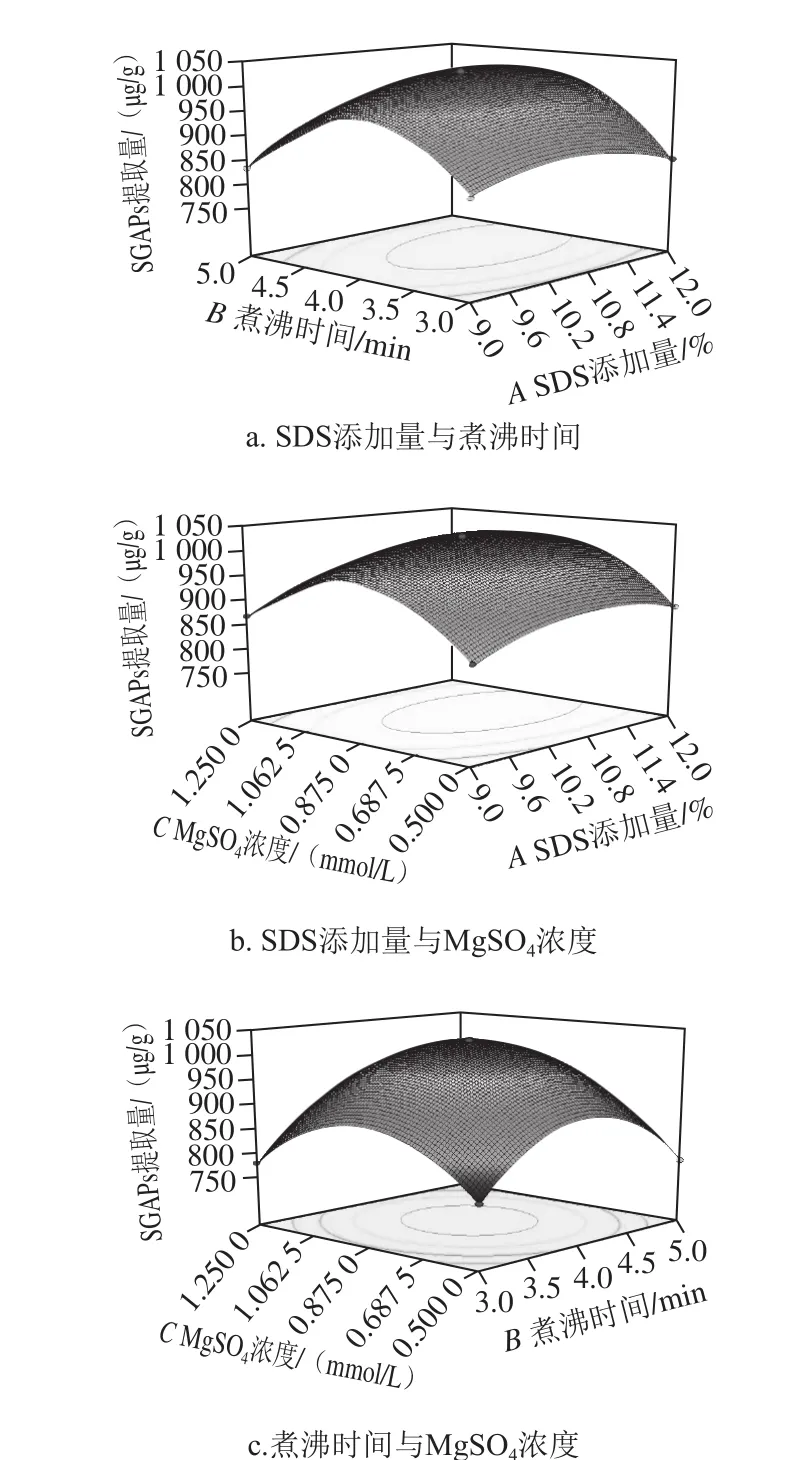
图6 因素交互作用对中层籼米淀粉SGAPs提取量的影响Fig. 6 Response surface plots showing interactive effects of various factors on the extraction efficiency of SGAPs
由表5可知,SDS添加量、煮沸时间与MgSO4浓度均为影响淀粉SGAPs提取量的主要因素,各因素间交互影响分别如图6所示。SDS添加量与MgSO4浓度交互作用不显著(图6b),其余2 组交互显著,与表5方差分析结果一致。等高线呈椭圆形,表明煮沸时间与SDS添加量、MgSO4浓度间交互作用对SGAPs提取量有显著影响,此与单因素试验结果一致。
利用Design-Expert 8.0.6.1软件对样品提取SGAPs的工艺条件进行优化,得到SGAPs最优提取条件:SDS添加量10.95%、煮沸时间4.14 min、MgSO4浓度0.92 mmol/L。为方便工艺操作,将SGAPs提取最佳条件均修正为SDS添加量10.90%、煮沸时间4.10 min、MgSO4浓度0.90 mmol/L。在该条件下进行验证实验,分别得到SGAPs提取量实测值为(1 028.61±0.05)μg/g,与预测值1 037.28 μg/g非常接近。
3 结 论
碱洗籼米粉可以得到上、中、下3 层淀粉,SDS缓冲液提取、HPLC-MS/MS鉴定表明,不同淀粉层中的SGAPs均以GBSS I为主,其中以中层淀粉SGAPs含量最高,达99.80%。至于籼米粉中的GBSS I是否具有生理活性、在籼米的加工过程中能否因为其生理活性而对产品产生影响尚不得而知。响应面优化中层淀粉SGAPs提取参数,结果表明SDS添加量10.90%、煮沸时间4.10 min、MgSO4浓度0.90 mmol/L,SGAPs的提取量最大,达(1 028.61±0.05)μg/g。当然,这种条件下提取的SGAPs显然不可能是具有活性的酶,但同样可以考虑这种SGAPs仅作为蛋白质对于籼米基本品质的影响,至于具有酶活性的SGAPs分离提取方法,则需要进一步研究。
