晚期氧化蛋白产物通过内质网应激调节人肾小管上皮细胞自噬的研究∗∗
2018-10-31李敏晖姜婷婷张雯英
李敏晖,汤 珣,姜婷婷,张雯英,谢 唯,章 俊△
(1.南方医科大学南海医院血液净化中心,广东佛山 528244;2.南方医科大学珠江医院肾内科,广州 510280)
晚期氧化蛋白产物(advanced oxidation protein products,AOPPs)是一类尿毒症毒素,近年来,大量证据表明其与肾脏疾病的发生、发展密切相关[1]。内质网应激(endoplasmic reticulum stress,ERS)是细胞损伤的早期应激事件。本课题组在新近的研究中发现,AOPPs可诱导肾小管上皮细胞(HK-2细胞)发生ERS[2]。但AOPPs是否可导致HK-2细胞出现代谢活性降低等其他损伤改变尚未十分明确。自噬是普遍存在于真核细胞中的一种溶酶体依赖的降解途径[3]。本课题组前期研究表明AOPPs能抑制HK-2细胞的自噬活性,而其具体机制仍有待阐述[4]。ERS和自噬之间的直接联系在近年被相继报道。但是AOPPs诱导的ERS与自噬活性降低之间是否存在联系及其具体关联机制尚不清楚。本文主要探讨AOPPs诱导的ERS是否介导了自噬活性降低的过程及其机制,旨在进一步阐明HK-2细胞在应对外界应激时内环境与代谢活性改变的机制。
1 材料与方法
1.1实验材料 HK-2细胞株[(美国模式培养物集存库(ATCC)];无内毒素牛血清清蛋白(BSA,美国Sigma公司);次氯酸(美国Gibco公司);ERS激活剂Thapsigargin(美国Sigma公司)、ERS抑制剂Salubrinal及腺苷酸活化蛋白激酶(AMPK)抑制剂Compoun C(美国MedChem Express公司)、AMPK激活剂AICAR(美国Selleck公司);磷酸化AMPK(p-AMPK)、AMPK、乳动物雷帕霉素靶蛋白(mTOR)、磷酸化mTOR(p-mTOR)、Beclin1、p62、LC3、CHOP兔抗人一抗(美国Cell Signaling Technology公司),葡萄糖调节蛋白78(GRP78)兔抗人一抗(中国Proteintech公司);电化学发光(ECL)检测试剂盒(美国Millipore公司)。
1.2 方法
1.2.1体外制备AOPPs 将不含游离氨基酸、碳水化合物、脂类成分的BSA与200 mmol/L次氯酸按1∶140混合,室温避光慢摇30 min,在磷酸盐缓冲液(PBS)中4 ℃透析24 h以除去游离的次氯酸,并用Detoxi-Gel柱去除内毒素。通过测定340 nm处的吸光度值估算AOPPs含量,以氯胺T为标准取得,内毒素含量低于0.025 EU/mL。
1.2.2HK-2细胞的培养 将HK-2细胞培养于含10%胎牛血清(FBS)的DMEM/F12培养基中,胰酶消化后接种于培养皿或6孔板,待细胞贴壁12 h后换为含2% FBS的DMEM/F12培养基使细胞同步生长。
1.2.3实验分组 (1)为明确AOPPs对HK-2细胞AMPK/mTOR信号通路的影响,将细胞分为3组:①正常组;②BSA组:200 μg/mL BSA作用48 h;③AOPPs组:200 μg/mL AOPPs作用48 h。(2)为明确AMPK/mTOR信号通路在AOPPs影响自噬活性中的作用,将细胞分为5组:①正常组;②BSA组:200 μg/mL BSA作用48 h;③AOPPs组:200 μg/mL AOPPs作用48 h;④Compoun C(AMPK阻断剂)组:1 mmol/L Compoun C处理细胞48 h;⑤AICAR(AMPK激活剂)组:AICAR 5 mmol/L预处理1 h后,给予200 μg/mL AOPPs作用48 h。(3)为明确ERS介导AOPPs对细胞自噬水平的影响及其机制,将细胞分为5组:①正常组;②BSA组:200 μg/mL BSA作用48 h;③AOPPs组:200 μg/mL AOPPs作用48 h;④Thapsigargin(ERS激活剂)组(Tag组):0.25 μmol/L Thapsigargin处理细胞48 h;⑤Salubrinal(ERS阻断剂)组(Sal组):50 μmol/L Salubrinal预处理1 h后,给予200 μg/mL AOPPs作用48 h。
1.2.4蛋白质印迹法(Western blot) 细胞培养及干预方法同1.2.3,作用48 h后,RIPA裂解细胞后提取细胞总蛋白,随后采用二喹啉甲酸(BCA)法测定蛋白浓度。聚丙烯酰胺凝胶电泳后转膜至聚偏氟乙烯(PVDF)膜。用5%脱脂奶粉或BSA封闭1 h后,在一抗中4 ℃孵育过夜。吸弃一抗,TBST洗膜,每次10 min,共3次,然后在二抗中室温孵育1 h。TBST洗膜,每次10 min,共3次,随后室温下ECL显色。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参。

2 结 果
2.1AOPPs对AMPK/mTOR信号通路的影响 根据前期研究,将未经修饰的BSA(200 μg/mL)和AOPPs(200 μg/mL)分别刺激HK-2细胞48 h。Western blot结果显示,与正常组及BSA组相比,AOPPs可抑制AMPK的磷酸化和诱导mTOR的磷酸化,激活AMPK/mTOR信号通路(P<0.05),见图1。
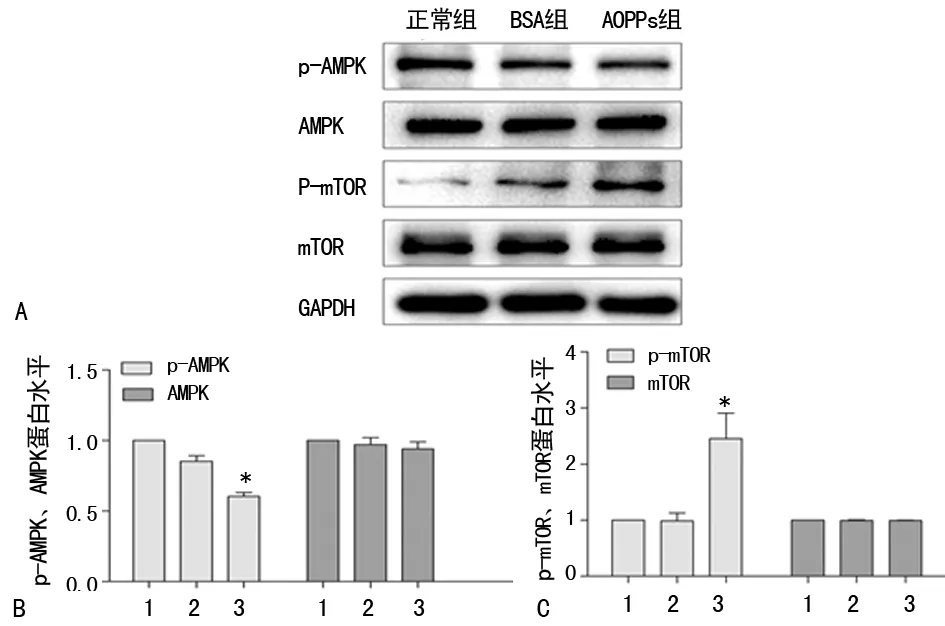
A:p-AMPK、AMPK、p-mTOR、mTOR蛋白Western blot条带;B:p-AMPK与AMPK蛋白表达分析图;C:p-mTOR与mTOR蛋白表达分析图;*:P<0.05,与正常组比较;1:正常组;2:BSA组;3:AOPPs组图1 AOPPs激活HK-2细胞的AMPK/mTOR信号通路
2.2AMPK/mTOR信号通路在AOPPs对HK-2细胞自噬活性影响中的作用 分别加入AMPK的特异性阻断剂Compoun C和激活剂AICAR处理HK-2细胞,用Western blot检测自噬标志物LC3、Beclin1和p62,以及AMPK、mTOR的磷酸化水平。结果显示:Compoun C单独处理细胞后,表现出与AOPPs相似的效应,表现为LC3Ⅰ向LC3Ⅱ转换减少,Beclin1表达下降,p62表达上升,同时抑制AMPK的磷酸化,增加mTOR的磷酸化;而AMPK激活剂AICAR与AOPPs共同作用于HK-2细胞后,可部分逆转AOPPs的作用,表现为激活AOPPs抑制的AMPK的磷酸化及抑制AOPPs诱导的mTOR的磷酸化,同时能使自噬活性升高,即LC3Ⅰ向LC3Ⅱ转换增加,Beclin1上调,而p62表达下降(P<0.05),见图2、3。
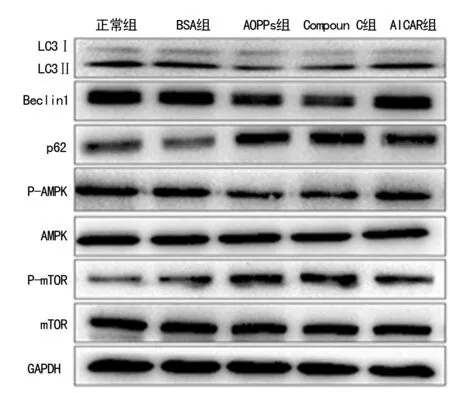
图2 自噬标志物蛋白Western blot条带
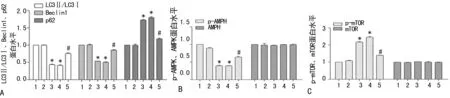
A:LC3Ⅱ/LC3Ⅰ、Beclin1、p62蛋白表达分析图;B:p-AMPK与AMPK蛋白表达分析图;C:p-mTOR与mTOR蛋白表达分析图;*:P<0.05,与正常组比较;#:P<0.05,与AOPPs组比较;1:正常组;2:BSA组;3:AOPPs组;4:Compoun C组;5:AICAR组图3 AMPK/mTOR信号通路介导AOPPs抑制HK-2细胞的自噬活性
2.3ERS对AMPK/mTOR信号通路的影响 为了明确ERS在AOPPs调节AMPK/mTOR信号通路中的作用,本研究予ERS激动剂Thapsigargin及抑制剂Salubrinal分别处理HK-2细胞48 h,检测ERS激活的标志性蛋白GRP78、p-AMPK、AMPK、p-mTOR、mTOR的蛋白表达水平。Western blot结果显示,加入Salubrinal后,AOPPs抑制AMPK的磷酸化和诱导mTOR的磷酸化效应可被部分逆转,表现为AMPK磷酸化增加,mTOR磷酸化降低,而Thapsigargin能抑制AMPK的磷酸化,同时诱导mTOR的磷酸化,激活AMPK/mTOR信号通路,与AOPPs作用相似(P<0.05),见图4、5。
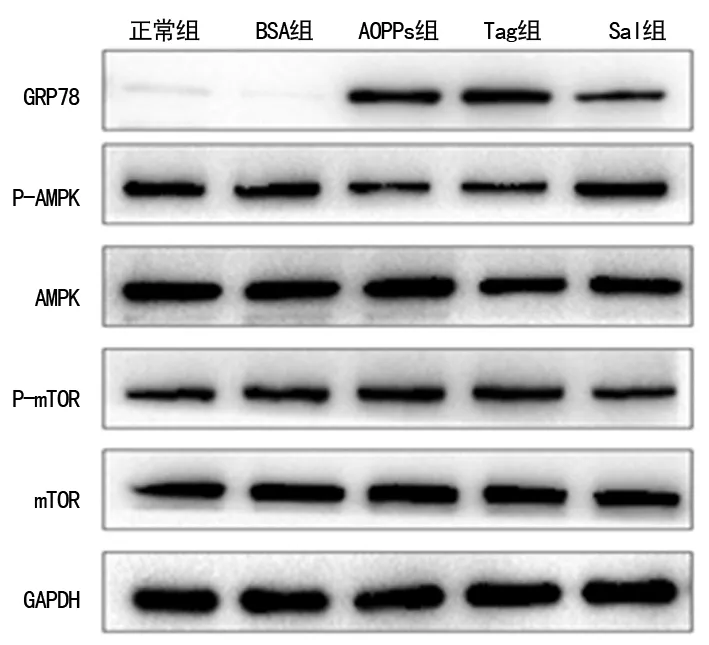
图4 ERS激活的标志性蛋白Western blot条带
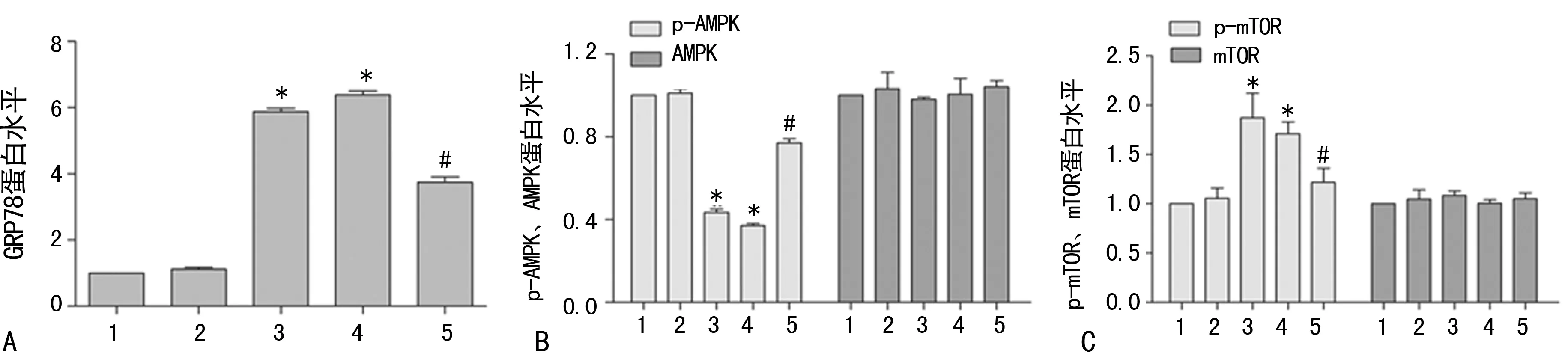
A:GRP78蛋白表达分析图;B:p-AMPK与AMPK蛋白表达分析图;C:p-mTOR与mTOR蛋白表达分析图;*:P<0.05,与正常组比较;#:P<0.05,与AOPPs组比较;1:正常组;2:BSA组;3:AOPPs组;4:Tag组;5:Sal组图5 ERS参与AOPPs激活HK-2细胞AMPK/mTOR信号通路的过程
2.4ERS、AMPK/mTOR信号通路与自噬活性的关系 分别采用ERS抑制剂Salubrinal和激活剂Thapsigargin处理HK-2细胞,检测自噬标志物的蛋白水平。结果显示:加入ERS激活剂后,LC3Ⅱ及Beclin1降低,p62升高,即自噬活性降低。而AOPPs与ERS抑制剂共同作用于细胞后,AOPPs抑制的自噬被部分逆转,表现为LC3Ⅱ和Beclin1升高,p62降低,即自噬水平上升(P<0.05),见图6。
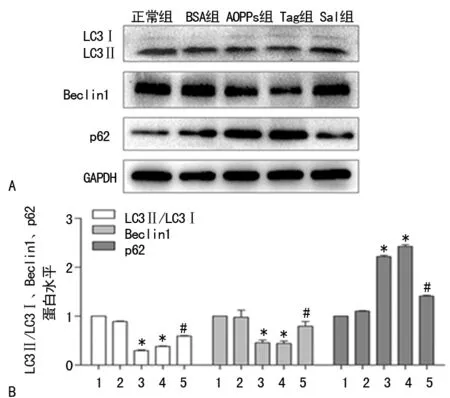
A:LC3Ⅱ/LC3Ⅰ、Beclin1、p62蛋白Western blot条带;LC3Ⅱ/LC3Ⅰ、Beclin1、p62蛋白表达分析图;*:P<0.05,与正常组比较;#:P<0.05,与AOPPs组比较;1:正常组;2:BSA组;3:AOPPs组;4:Tag组;5:Sall组图6 ERS通过激活AMPK/mTOR信号通路介导AOPPs诱导的自噬抑制
3 讨 论
肾脏纤维化是慢性肾脏病(CKD)进展至终末期肾脏病的共同通路,近年来研究表明,肾小管间质病变程度与肾功能关系较肾小球病变更为密切[5]。大量研究表明,自噬与多种肾脏疾病的发生、发展有着密切的关系,如足细胞病[6]、糖尿病肾病[7]、急性肾缺血-再灌注损伤[8]等。有研究表明,糖尿病肾病中肾小管上皮细胞自噬活性降低[9],而自噬活性上调可抵抗多种物质对肾小管上皮细胞的损伤作用,如尿蛋白[10]和糖基化终产物(AGEs)[11]等。本课题组前期研究发现AOPPs可降低HK-2细胞的自噬活性[4],但是其诱导机制尚未明确。
近年来,大量证据表明AOPPs与肾脏疾病的发生、发展密切相关[1]。本课题组前期已经证明了AOPPs可通过调节p38 MAPK信号通路抑制HK-2细胞的自噬活性[4]。在此,本研究证明了AMPK/mTOR信号途径可能参与了AOPPs诱导肾小管上皮细胞发生自噬抑制的过程。主要依据如下:(1)本实验显示,AOPPs可抑制AMPK的磷酸化和诱导mTOR的磷酸化,提示AOPPs可激活AMPK/mTOR信号通路。(2)AOPPs和AMPK蛋白抑制剂Compoun C均能抑制HK-2细胞的自噬活性,而AMPK激活剂AICAR能增加HK-2细胞的自噬活性。既往研究表明,AGEs能抑制HK-2细胞的自噬活性[11],本课题组前期研究也表明,与AGEs同属代谢产物的AOPPs也能抑制HK-2细胞的自噬活性[4],本研究更是首次提出了AMPK/mTOR信号通路的激活介导了AOPPs诱导肾小管上皮细胞自噬活性降低的过程。
在氧化应激的病理条件下,AMPK激活能增加ATP生成并减少ATP消耗,维持机体能量平衡[12],而氧化应激与ERS又密切相关[13]。故本研究继续探讨在AOPPs诱导HK-2细胞发生自噬活性抑制的过程中,AMPK/mTOR信号通路与ERS在其中的关系。本研究结果提示,在AOPPs抑制HK-2细胞的自噬活性过程中,AMPK/mTOR信号通路与ERS密切相关。主要依据如下:(1)ERS能调节AMPK/mTOR信号通路的蛋白活性。结果显示,加入ERS激活剂Thapsigargin之后, AMPK/mTOR信号通路激活,相反,ERS抑制剂Salubrinal增加AMPK的磷酸化和抑制mTOR的磷酸化,提示ERS能激活AMPK/mTOR信号通路。(2)加入Thapsigargin之后,HK-2细胞的自噬活性受到抑制,而加入Salubrinal之后AOPPs的效应部分被逆转,表现为自噬水平有所上升。结合前述AMPK/mTOR介导了AOPPs引发的自噬抑制,可以推测ERS可能通过激活AMPK/mTOR信号通路来诱导AOPPs对HK-2细胞自噬活性的抑制作用。此前,大量研究均提示ERS的发生能诱发自噬水平的上调[14],而在本研究中,ERS的存在对自噬水平的调控发挥了抑制作用,这可能与ERS与自噬所处的环境及作用的时间差异有关。在细胞受到外界刺激的初始阶段,ERS的发生与自噬水平的上调都是对细胞具有应对外界刺激的保护及适应作用,有助于恢复内环境的稳态,而持续存在的ERS会产生警戒信号,最终使内质网损伤变为不可逆,此时可能抑制自噬水平,对细胞造成级联式的损伤。
综上所述,本研究首次提出ERS通过激活AMPK/mTOR信号通路参与了AOPPs诱导HK-2细胞自噬活性的抑制过程。本研究提出了HK-2细胞自噬活性调节的新机制,抑制或阻断ERS及AMPK/mTOR信号通路,对增加肾小管上皮细胞自噬活性、防治肾间质纤维化具有重要意义,为研究肾间质纤维化提供了新的方向。
