风湿性瓣膜病合并嗜麦芽窄食单胞菌感染性心内膜炎1例
2018-10-31赵鹏英宋兵
赵鹏英 宋兵
临床资料患者,男性,59岁,因“胸闷、气短3个月余加重10d”入院。3月前无明显诱因出现胸闷、气短,症状逐渐加重,出现夜间阵发性呼吸困难及端坐呼吸。患者既往高血压2年,规律服用降压药,血压控制尚可。入院查体:T37.8℃,BP142/56mmHg(1mmHg=0.133kPa),P112 次/min。神志清,精神差。贫血貌,皮肤无黄染,未见皮疹及出血点,口唇无发绀,关节无红肿,浅表淋巴结无肿大。双肺呼吸音清,未闻及干湿性啰音。心前区无隆起,心尖搏动弥散,心界向两侧扩大,心率112次/min,律齐,心音正常,主动脉瓣听诊区可闻及4/6级舒张期叹息样杂音。双下肢无水肿。实验室检查:血常规:RBC 3.16×1012/L,HGB 86g/L,WBC 5.04×109/L,N 79%。 甲状腺功能:TSH 6.19uIu/mL。 血清铁3.3μmol/L,总铁结合力 35.1μmol/L,铁饱和度 0.09。BNP 2505ng/L。降钙素原PCT 0.211μg/mL。胸X线片示:①双肺纹理增粗;②心影增大,主动脉弓增宽。心脏超声心动图:①主动脉瓣脱垂并关闭不全,二尖瓣关闭不全;②全心扩大;③肺动脉压增高。入院初步诊断“主动脉瓣关闭不全;升主动脉瘤样扩张;高血压1级;贫血;亚临床甲减”。入院后给予“五水头孢唑林钠 2g,2次/d”抗感染,给予强心、利尿、营养心肌、改善心功能对症支持治疗,待临床症状改善后欲行手术治疗。患者于入院后第四日出现高热、寒战、盗汗,体温最高达39.8℃,原方案抗感染治疗后症状无明显改善,遂立即行血培养检查,两次血培养结果均提示嗜麦芽窄食单胞菌(stenotrophomonasmaltophilia,SMA)感染,入院第十日复查心脏超声心动图(图1)提示:①细菌性心内膜炎,主动脉瓣及二尖瓣赘生物(主动脉瓣右、无冠瓣可见赘生物附着,其中一条约21mm×3mm,二尖瓣前叶可见赘生物附着,大小约8mm×16mm);②主动脉瓣轻度狭窄并重度关闭不全。临床诊断为“①嗜麦芽窄食单胞菌感染性心内膜炎;②主动脉瓣狭窄并关闭不全、二尖瓣狭窄并关闭不全”。根据药敏结果该细菌对左氧氟沙星、米诺环素、复方新诺明敏感,对除替卡西林/棒酸外所有的β-内酰胺类、氨基糖苷类抗生素、亚胺培南天然耐药,遂给予“左氧氟沙星0.2g,2次/d”+“复方新诺明2片(甲氧苄啶160mg和磺胺甲噁唑800mg)/d”联合抗感染治疗2周后,体温趋于正常,复查血常规:RBC 3.43×1012/L,HGB 92g/L,WBC 4.91 ×109/L,N 73.1%。 降钙素原 PCT 0.045μg/L。BNP 535.9ng/L。复查血培养结果未见细菌生长。患者一般状况良好,于入院后1个月在全麻低温体外循环下行“二尖瓣、主动脉瓣置换+心内赘生物清除术”,术中见二尖瓣瓣叶、乳头肌赘生物附着,二尖瓣前叶有穿孔,主动脉瓣三叶上均有赘生物附着,瓣叶毁损,瓣膜关闭不全,术中取出赘生物送病理和培养。手术顺利,术后继续给予“五水头孢唑林钠 2g,3次/d”+“左氧氟沙星 0.2g,2次/d”+“复方新诺明2片(甲氧苄啶160mg和磺胺甲噁唑800mg)/d”联合抗感染治疗。瓣膜组织病检(图2)结果示:慢性心内膜炎伴囊肿形成。赘生物病理及培养结果为嗜麦芽窄食单胞菌感染性心内膜炎。术后继续抗感染治疗两周余后复查血培养结果未见细菌生长,复查心脏超声心动图结果未见明显异常后出院。出院后随访1个月患者体温正常,复查心脏彩超结果未见异常。
讨论 感染性心内膜炎是由微生物引起的心内膜感染,与多种因素有关,主要包括:①细胞或组织完整性丧失;②血流动力学存在湍流及菌血症;③可能伴有免疫功能的受损。动物实验中已多次证实仅静脉内注入细菌难以产生心内膜炎,除非瓣膜结构出现变化。心瓣膜受损后一般引起无菌性纤维素和血小板沉积于表面为病原体的粘附浸入和繁殖创造有利条件。同时赘生物底下的心内膜炎症反应导致瓣叶破损、穿孔、腱索断裂等,这样反复形成恶性循环进一步造成损害。因此感染性心内膜炎多发生于有心脏瓣膜病、先天性心脏病、人造瓣膜置换术后的患者,此类患者伴有不明原因的发热达1周以上、不能解释的贫血、顽固性心力衰竭时,应提高警惕,高度怀疑本病。
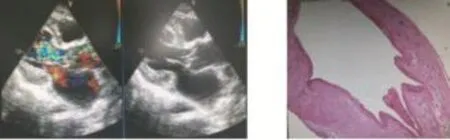
图1 超声心动图图像 图2 瓣膜组织病理图片
感染性心内膜炎致病菌中最常见的是草绿色链球菌,其次为金黄色葡萄球菌。SMA于1960年被首次发现[1],该菌为专性需氧的非发酵型革兰阴性杆菌,广泛分布于水、土壤、动物体内,常寄居在人体呼吸道、泌尿生殖道及皮肤等,为条件致病菌[2]。根据对SMA分布研究的相关报道,SMACABG感染的标本主要来自50岁以上患者,多数感染者患有慢性疾病,以痰液中分离菌株比例最高,其次为分泌物,尿、血液、胸腹水等标本分离率最低[3]。近年来由于医院内广谱抗菌药物尤其是亚胺培南及第三代头孢菌素的广泛使用,免疫抑制剂的广泛大剂量使用以及侵入性操作(如各种有创性穿刺、气管插管、机械通气等)的普及使得该菌已逐渐成为医院感染的重要病原菌之一,尤其成为重症监护病房感染的重要致病菌[4]。SMACABG感染性心内膜炎病例虽然临床少见,但其临床表现亦为发热、心脏杂音、瘀点、贫血、栓塞现象以及发展为心内膜上赘生物形成,从而可能导致心瓣膜关闭不全或阻塞、心肌脓肿、瓣环旁脓肿、动脉瘤形成以及心脏传导阻滞。其临床病程可呈急性、亚急性,表现可因年龄、易感性,以及有无其他合并症和致病菌的毒力而有差异。该病早期心脏超声多普勒可无明显异常声像表现,需多次复查。对于早期有发热寒战、体温异常变化等征象的患者,应提高警惕,及时行血培养和药敏试验。有关对该菌的耐药性研究显示该菌对多种抗生素天然耐药(包括对β-内酰胺类、氨基糖苷类、喹诺酮类、碳青霉烯类耐药)且该菌在接触一些药物后很快会产生耐药性。目前认为SMACABG对多种抗生素耐药机制如下[5-6]:①该菌具有天然的低渗透性外膜,而且这种生物膜具有多种调节机制,会随着一些抗生素的作用而自我调节;②该菌能产生多种抑制抗生素活性的酶类,如β-内酰胺酶、氨基糖苷类钝化酶等;③该菌具有独特的多药外排系统-“外排泵(multidrug efflux pump)”,这些基因片段可影响其正常的核苷酸排列序列,产生耐药蛋白。目前已被发现的外排泵主要有 Stenotrophomonas multiple efflux ABC(Sme-ABC)、Stenotrophomonas multiple efflux JKL(SmeJKL)、Stenotrophomonasmultiple efflux YZ(SmeYZ)等;④染色体编码的SmQnr能诱导喹诺酮作用的旋转酶和拓扑异构酶Ⅳ突变,从而使菌体耐受喹诺酮类药物,且SmQnr的表达水平可以通过抗生素的选择压力上调。由于该菌的特殊耐药性以及上述耐药机制的存在,SMACABG感染性心内膜炎在临床治疗方面具有一定的困难,早期的经验性抗生素抗感染治疗往往无效,耽误了治疗时机。
本例患者本身患有心脏瓣膜病,是感染性心内膜炎的高发人群,早期并无明显临床表现,心脏彩超亦无赘生物形成,仅表现为不明原因的贫血。此后逐渐出现发热、寒战,早期使用一般抗生素无效,立刻多次复查血培养及超声心动图,快速确诊为SMACABG感染性心内膜炎,根据药敏结果及时给予敏感性抗生素治疗。待病情平稳,血培养结果阴性后果断行外科手术治疗,既使得心脏瓣膜病得到了根治,而且通过外科手段使得位于心内大赘生物深处的,抗生素不易达到的微生物得以有效清除,术后继续使用敏感性抗生素巩固治疗后患者恢复良好,随访并无复发。目前在SMACABG感染性心内膜炎的治疗方面,多数学者主张联合2种或2种以上的敏感性抗生素联合抗感染治疗,推荐复方新诺明+替卡西林/克拉维酸为首选治疗方案[7](具体根据药敏结果调整),时间为4~6周。此外近年来随着外科手术的发展,手术治疗感染性心内膜炎亦有其相应的优势,尤其是类似于本例患者具有基础器质性心脏病变的患者,或有心脏并发症以及抗生素治疗无效的患者应尽早实施外科手术治疗,而不必等感染完全控制或待完成抗生素疗程后再决定手术,否则延误手术治疗时机,增加患者病死率[8]。在上述治疗的同时我们更要积极治疗原发病,增强机体免疫力,加强营养支持,预防复发。
