体外循环心脏手术后急性呼吸窘迫综合征的临床特点及预后分析
2018-10-31黄立学宋曼裴振业刘妍尙蔚曹向戎来永强朱光发
黄立学 宋曼 裴振业 刘妍 尙蔚 曹向戎 来永强 朱光发
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的发生与严重感染、脓毒血症、外伤、休克等因素有关[1]。迄今,ARDS缺乏特效治疗手段,临床主要采用小潮气量机械通气、俯卧位通气和和体外膜氧合(extracorporeal membrane oxygenation,ECMO)等生命支持技术,病死率高达40%以上[2-3]。心脏手术是ARDS的一项重要危险因素,其发生率和病死率分别为0.17%~2.5%和15%~80%[4-6],严重影响心脏病患者的预后。本研究以CPB心脏手术后的ARDS患者为研究对象,分析CPB心脏术后ARDS患者的临床特点,对比分析影响患者预后的危险因素,为临床诊治该类患者提供一定依据。
资料与方法
1.研究对象 连续收集2005年1月至2015年12月,于首都医科大学附属北京安贞医院接受CPB心脏手术,并于术后发生ARDS的患者。ARDS诊断标准依据2012年发表的柏林诊断标准[7]。排除标准:①年龄<18岁;②术前已经进行机械通气;③术前接受主动脉球囊反搏(intra-aortic balloon pump,IABP)治疗;④术前接受持续肾脏替代治疗(continuous renal replacement therapy,CRRT);⑤术前接受ECMO治疗;⑥术前已经存在肺部影像学表现为双肺弥漫性渗出的间质性肺炎,肺部感染或呼吸衰竭;⑦术前发生了重大的创伤,脓毒血症,误吸,休克,急性心力衰竭;⑧术前已确诊为恶性肿瘤;⑨资料不全。本研究获得医院医学伦理委员会批准。
2.资料收集 收集内容包括:①一般情况:性别、年龄、BMI;②术前情况:吸烟状况、基础疾病、手术史、胺碘酮和他汀用药史、HGB水平、白蛋白水平;③术中情况:急诊/择期手术、手术类型、手术时间、CPB时间、主动脉阻断时间、术中输血情况等;④术后情况:氧合指数、是否使用IABP、CRRT、ECMO、用药情况、是否二次插管、是否再次行开胸手术以及发生ARDS的时间等。研究终点为院内死亡。
3.统计学方法 采用SPSS24.0统计软件进行数据分析。正态分布的计量资料采用均数±标准差描述,组间比较采用t检验;非正态分布的计量资料采用中位数和四分位数间距M(Q25,Q75)描述,组间比较采用Mann-WhitneyU检验;计数资料采用例(率)描述,组间比较采用χ2检验;应用二元Logistic回归分析影响患者预后的独立危险因素。以P<0.05为差异有统计学意义。
结 果
1.体外循环心脏手术后ARDS患者一般情况
纳入本研究的144例CPB心脏外科术后ARDS患者,年龄(55.3±13.7)岁,男性98例(68.1%),其中轻度、中度和重度ARDS分别为10例(6.9%)、78例(54.2%)和56例(38.9%)。截止至出院时,死亡40例,占27.8%。轻度、中度和重度ARDS患者的病死率分别为30.0%(3/10),28.2%(22/78),26.8%(15/56),差异无统计学意义(χ2=0.059,P=0.971)。CPB心脏手术后发生ARDS的主要手术类型是大血管手术,占28.5%,其次是CABG联合瓣膜手术,占18.8%。在术后ARDS死亡的手术类型中,单纯瓣膜手术最高,占75%。不同手术类型对CPB心脏术后ARDS患者气管插管时间和住ICU时间的影响差异无统计学意义(P均>0.05),这表明不同心脏手术方式对患者的拔管时间和住ICU时间无影响。详见表1。
2.预后危险因素分析 将144例ARDS患者根据出院情况分为死亡组(40例)和存活组(104例)。单因素分析显示,BMI、术后应用CRRT、术后应用ECMO在死亡组及存活组中有显著差异。详见表2。将上述因素与年龄、性别纳入Logistic回归方程,结果显示 BMI(OR=0.885,P=0.020)、术后应用CRRT(OR=2.986,P=0.009)、术后应用 ECMO(OR=3.208,P=0.025)是该类患者院内死亡的独立危险因素。详见表3。

表1 不同手术方式对死亡、ICU停留时间和插管时间的影响[M(QR),n(%)]
表2 体外循环下心脏外科术后ARDS围术期临床特征比较[±s,n(%),M(QR)]
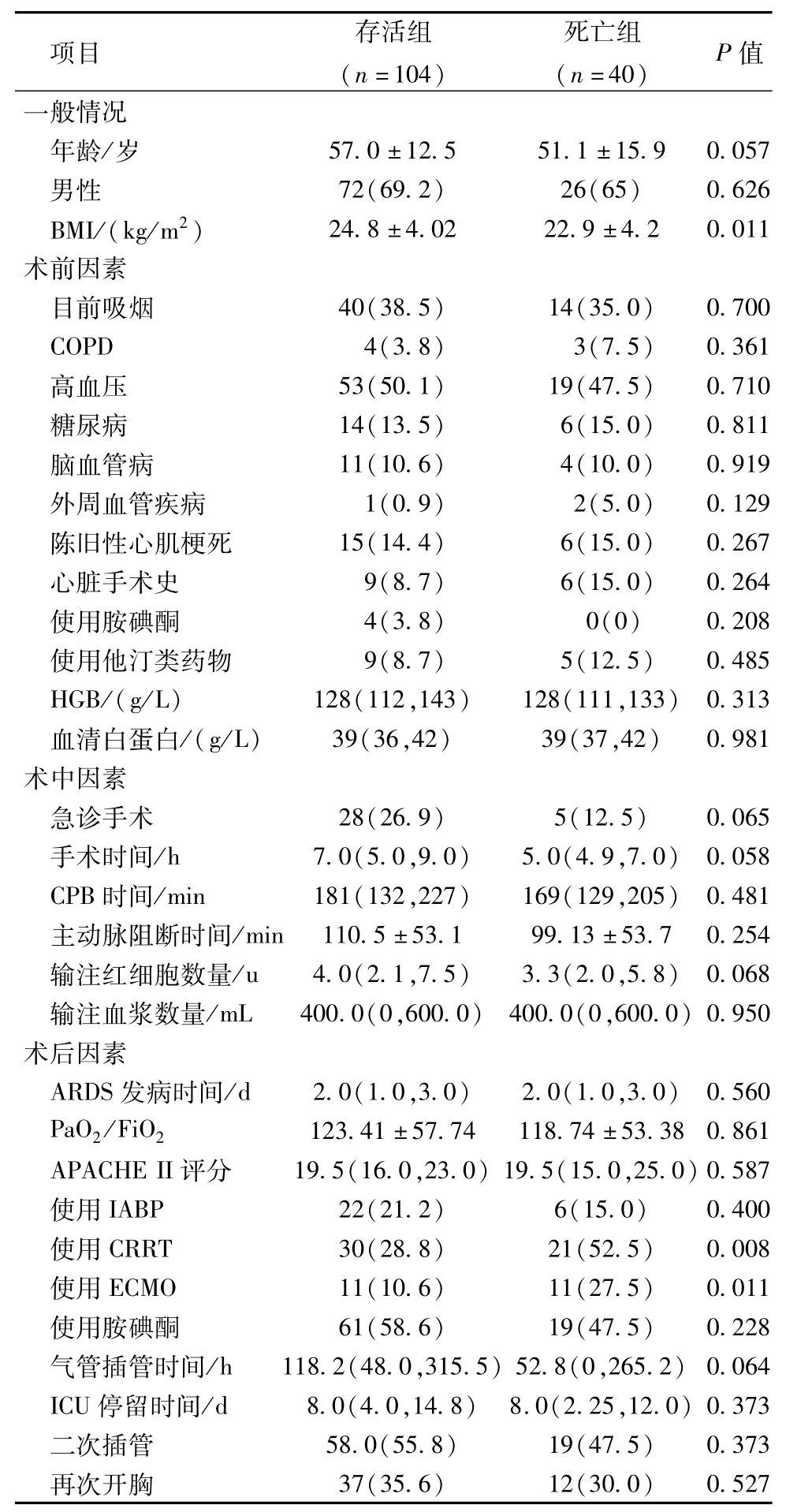
表2 体外循环下心脏外科术后ARDS围术期临床特征比较[±s,n(%),M(QR)]
注:APACHE:急性生理与慢性健康评分
项目 存活组(n=104)死亡组(n=40) P值情况年龄/岁 57.0±12.5 51.1±15.9 0.057男性 72(69.2) 26(65) 0.626 BMI/(kg/m2) 24.8 ±4.02 22.9 ±4.2 0.011术前因素目前吸烟 40(38.5) 14(35.0) 0.700 COPD 4(3.8) 3(7.5) 0.361高血压 53(50.1) 19(47.5) 0.710糖尿病 14(13.5) 6(15.0) 0.811脑血管病 11(10.6) 4(10.0) 0.919外周血管疾病 1(0.9) 2(5.0) 0.129陈旧性心肌梗死 15(14.4) 6(15.0) 0.267心脏手术史 9(8.7) 6(15.0) 0.264使用胺碘酮 4(3.8) 0(0) 0.208使用他汀类药物 9(8.7) 5(12.5) 0.485 HGB/(g/L) 128(112,143) 128(111,133) 0.313血清白蛋白/(g/L) 39(36,42) 39(37,42) 0.981术中因素急诊手术 28(26.9) 5(12.5) 0.065手术时间/h 7.0(5.0,9.0) 5.0(4.9,7.0) 0.058 CPB时间/min 181(132,227) 169(129,205) 0.481主动脉阻断时间/min 110.5±53.1 99.13±53.7 0.254输注红细胞数量/u 4.0(2.1,7.5) 3.3(2.0,5.8) 0.068输注血浆数量/mL 400.0(0,600.0) 400.0(0,600.0) 0.950术后因素ARDS 发病时间/d 2.0(1.0,3.0) 2.0(1.0,3.0) 0.560 PaO2/FiO2 123.41±57.74 118.74±53.38 0.861 APACHE II评分 19.5(16.0,23.0) 19.5(15.0,25.0) 0.587使用IABP 22(21.2) 6(15.0) 0.400使用CRRT 30(28.8) 21(52.5) 0.008使用ECMO 11(10.6) 11(27.5) 0.011使用胺碘酮 61(58.6) 19(47.5) 0.228气管插管时间/h 118.2(48.0,315.5) 52.8(0,265.2) 0.064 ICU停留时间/d 8.0(4.0,14.8) 8.0(2.25,12.0) 0.373二次插管 58.0(55.8) 19(47.5) 0.373再次开胸 37(35.6) 12(30.0)一般0.527

表3 危险因素的Logistic回归分析结果
讨 论
CPB是心脏外科手术中常用的生命支持技术,CPB过程中产生系统性炎症反应和肺部缺血再灌注损伤均与ARDS的发生相关[8]。文献报道,心脏外科手术后ARDS患者的住ICU时间和住院时间显著延长,严重影响患者预后[9]。本研究发现,发生ARDS时的氧合指数与患者的预后无统计学差异,且轻度、中度和重度ARDS的病死率之间亦无显著性差异。心脏手术后的ARDS患者病死率为15%~80%[4-6],病死率区间跨度大,考虑与不同时期ARDS诊断标准、研究机构、研究对象入选和排除标准及管理方式等不同有关。本研究CPB心脏外科术后ARDS患者的病死率为27.8%。
本研究显示,不同手术类型对于ARDS患者的术后拔管时间和住ICU时间,差异无统计学意义。CPB心脏手术后发生ARDS的患者中,接受CABG联合瓣膜手术的患者住ICU时间最长,接受大血管手术的患者术后气管插管时间最长。单因素分析显示,住ICU时间、术后气管插管时间、术后再次气管插管和术后开胸探查与CPB心脏外科术后ARDS患者的死亡没有统计学差异(P均>0.05)。与死亡组比较,存活组的手术时间、CPB时间、主动脉阻断时间均延长。我们分析这与本研究中发生ARDS患者的主要人群是接受大血管手术和CABG联合瓣膜手术,而这两类患者的病死率明显低于整体ARDS患者的病死率相关。
二元Logistic回归分析发现,低BMI、术后应用CRRT、ECMO是CPB术后ARDS患者院内死亡的危险因素。提示术后ARDS患者的BMI越低,死亡风险越高,高BMI是ARDS患者预后的有利因素。与存活组相比,死亡组BMI明显偏低。在既往研究中,BMI≥25kg/m2作为ARDS预后的保护因素,这可能与ARDS患者多处于高分解代谢状态,而肥胖患者有足够脂肪组织,在高分解代谢时作为营养和支持相关[10]。急性肾损伤是心脏术后常见的并发症,CRRT已经成为重症监护病房抢救危重症患者的重要手段。CRRT主要通过对流、吸附和弥散的原理将患者体内多余的水分和代谢产物清除,同时也有效的清除了炎症介质。既往研究发现CRRT治疗ARDS时有效降低气道峰压、改善肺顺应性等呼吸力学指标和提高动脉血氧分压[11]。在这项研究中,CRRT改善了ARDS患者急性期的病情,但接受常规治疗和接受常规治疗联合CRRT治疗的两组患者ICU病死率差异无统计学意义。本组体外循环心脏术后ARDS患者中,35.4%的患者为纠正液体负荷或治疗术后急性肾损伤应用了CRRT技术。死亡组中,超过50%(21/40)的 ARDS患者接受了CRRT治疗。在两组之间比较,CRRT治疗与患者预后差异有统计学意义(OR=2.986,P=0.008),即术后应用CRRT的ARDS患者病死率是未应用ECMO患者的2.986倍。ECMO能够纠正顽固性低氧血症、清除二氧化碳,已经成为重症ARDS患者的重要治疗措施[12]。ECMO能不依赖肺泡进行气体交换,迅速改善全身缺氧状态,让肺得到部分休息,为临床治疗赢得时间与机会。在本研究中,15.3%的ARDS患者使用了ECMO,死亡组中27.5%的ARDS患者使用了ECMO,Logistic回归显示ECMO是影响术后ARDS患者预后的危险因素,OR=3.208,即术后应用ECMO的ARDS患者死亡的概率为未应用ECMO患者的3.208倍。本研究结果显示接受CRRT和ECMO治疗的ARDS患者有多器官功能障碍,病情重,因而预后较差。提示在临床工作中,需要动态观察患者病情变化,掌握好CRRT和ECMO应用时机,是决定其能否取得成功的关键[2,12]。
本研究有一定局限性,ARDS的诊断标准是非特异性的,建立诊断时须排除大面积肺不张、心源性肺水肿、弥漫性肺泡出血等[1]。本研究为回顾性研究,纳入患者均为进行心脏外科手术患者,患者术后发生心源性肺水肿的可能性增加,这增加了临床ARDS筛选的难度。由于术后进行肺动脉漂浮导管监测血流动力学的患者较少,本研究参照2012年柏林标准[7],通过对患者临床症状、体征、BNP、胸X线平片、超声心动图以及患者对强心利尿治疗效果等方面进行鉴别诊断,筛选出ARDS患者。
综上所述,CPB心脏外科术后ARDS患者的术后气管插管时间、住ICU时间和住院时间较长,患者的院内病死率较高。低BMI、术后应用CRRT或ECMO是CPB心脏外科术后ARDS患者死亡的独立危险因素。本研究结果有待需要进一步前瞻性研究验证。
