主动脉夹层手术前后患者肠道菌群结构特征变化的研究
2018-10-31余英高峰张杰陈雪
余英 高峰 张杰 陈雪
宏基因组高通量DNA测序技术突破了过去依靠细菌培养不能准确获得菌群结构特征的技术瓶颈;能够准确获得门、纲、目、科、属、种水平菌群结构特征;使得肠道菌群结构与疾病之间关系的研究成为目前临床研究的热点[1-4];主动脉夹层是最常见的主动脉疾病之一;目前外科手术治疗仍是其最主要的治疗方法;有研究[5-7]发现心脏或主动脉夹层手术患者在术后常出现腹胀、腹泻、排便困难、消化道出血等胃肠道症状;但目前缺乏胃肠道症状的发生是否与肠道菌群结构改变有关的研究;因此;我们通过宏基因组高通量DNA测序技术研究行主动脉夹层手术患者手术前后肠道菌群结构特征;初步探讨胃肠道症状与肠道菌群结构特征之间的关系
资料与方法
1.临床资料 纳入2015年5月到2016年1月,于首都医科大学附属北京安贞医院心脏外科中心,行主动脉夹层手术治疗患者,均行胸腹部CT检查提示存在主动脉夹层,同时排除患有精神心理疾病、基础消化道疾病(如炎症性肠病、肠易激综合征、消化道溃疡、消化道肿瘤等)、肝炎、肝硬化、糖尿病、肥胖、冠心病及1个月内曾使用过抗生素的患者。
收集患者胃肠道症状评分(gastrointestinal symptom rating scale,GSRS)结果,GSRS 症状包括:腹胀、排气增多、恶心和呕吐、排便不尽感、嗳气、硬粪、腹鸣、稀便、排便减少、排便增多、排便紧迫感、反流、烧心、腹痛、上腹部紧抽感,共15个症状;每个症状分为无症状、稍微严重、比较严重、非常严重,共4个级别(分别计 1 到 4 分)[8]。
2.粪便样本的采集与处理 所有入组患者入院后采集新鲜粪便样本2~5g立即置于无菌采样盒内,并于-80℃低温冷冻保存。每一例取300mg粪便样本,采用康为公司的粪便DNA快速提取试剂盒快速提取和纯化DNA,使用Nanodrop测定DNA浓度和260/280值,以浓度 >15ng/μL,且260/280值在1.8~2.0之间的DNA作为符合质量要求的样本,另外使用1%琼脂糖凝胶电泳检测确定DNA样本无降解,合格DNA保存于-20℃冰箱待用。
3.DNA文库的建立、测序及归类 从粪便样本中提取的DNA进行PCR扩增和建库,PCR引物使用针对细菌16S rDNA的V3-V5区的通用引物,上机测序前进行二次PCR建库,对第一次PCR产物的5'端加上Roche/454特异性接头和多重标签(MID)修饰(标签序列为10个核苷酸序列),不同样本的标签序列不同。使用Illumina Hiseq2500系统(中国科学院微生物所)进行测序,及微生物生态学定量研究(Quantitative Insights Into Microbial Ecology,QIIME)系统进行归类分析。
4.统计学方法 所有数据均用SPSS 20.0统计分析。正态分布的计量资料用平均值±标准差表示,两组间比较采用独立样本t检验;计数资料采用χ2检验;非正态分布的计量资料用中位数(M)及四分位距间(P25,P75)表示,两组间比较采用 Mann-Whitney U检验,并进一步进行Spearman相关性分析。以P<0.05为差异有统计学意义。
结 果
1.一般资料 共收集术前组标本17例,术后组标本11例,其中5例患者同时收集到术前、术后标本,12例患者仅收集到术前标本,6例患者仅收集到术后标本。两组患者在性别、年龄和住院时间上无明显差别(表1)。术前组和术后组GSRS分别为(35.5±2.2)分和(40.6±3.5)分,P<0.001。
表1 不同组间一般资料和肠道菌群结构结果[±s,n,M(QR)]
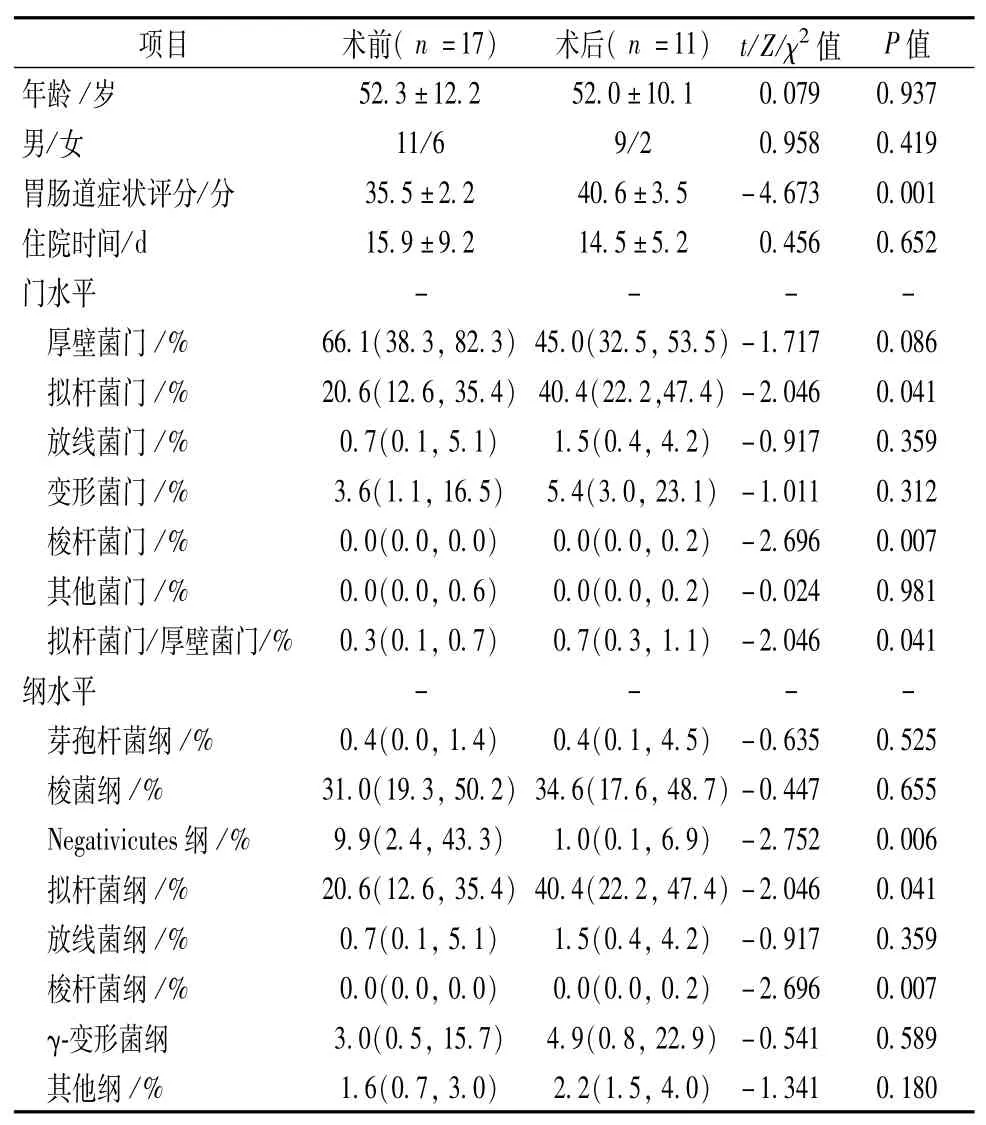
表1 不同组间一般资料和肠道菌群结构结果[±s,n,M(QR)]
注:其他:包括平均值百分比例<1%和组间比较P>0.05的所有细菌
项目 术前(n=17) 术后(n=11) t/Z/χ2值 P值年龄 /岁52.3±12.2 52.0±10.1 0.079 0.937男/女 11/6 9/2 0.958 0.419胃肠道症状评分/分 35.5±2.2 40.6±3.5 -4.673 0.001住院时间/d 15.9±9.2 14.5±5.2 0.456 0.652门水平 - - - -厚壁菌门 /% 66.1(38.3,82.3)45.0(32.5,53.5)-1.717 0.086拟杆菌门 /% 20.6(12.6,35.4) 40.4(22.2,47.4)-2.046 0.041放线菌门 /% 0.7(0.1,5.1) 1.5(0.4,4.2) -0.917 0.359变形菌门 /% 3.6(1.1,16.5) 5.4(3.0,23.1) -1.011 0.312梭杆菌门 /% 0.0(0.0,0.0) 0.0(0.0,0.2) -2.696 0.007其他菌门 /% 0.0(0.0,0.6) 0.0(0.0,0.2) -0.024 0.981拟杆菌门/厚壁菌门/% 0.3(0.1,0.7) 0.7(0.3,1.1) -2.046 0.041纲水平 - - - -芽孢杆菌纲 /% 0.4(0.0,1.4) 0.4(0.1,4.5) -0.635 0.525梭菌纲 /% 31.0(19.3,50.2)34.6(17.6,48.7)-0.447 0.655 Negativicutes纲 /% 9.9(2.4,43.3) 1.0(0.1,6.9) -2.752 0.006拟杆菌纲 /% 20.6(12.6,35.4)40.4(22.2,47.4)-2.046 0.041放线菌纲 /% 0.7(0.1,5.1) 1.5(0.4,4.2) -0.917 0.359梭杆菌纲 /% 0.0(0.0,0.0) 0.0(0.0,0.2) -2.696 0.007 γ-变形菌纲 3.0(0.5,15.7) 4.9(0.8,22.9) -0.541 0.589其他纲 /% 1.6(0.7,3.0) 2.2(1.5,4.0)-1.341 0.180
2.门、纲、目、科水平肠道菌群结构比较 术前组和术后组在门水平肠道菌群结构(表1,图1)百分比分别为:厚壁菌门[66.1(38.3,82.3)vs.45.0(32.5,53.5)%,P=0.086)];拟杆菌门 [20.6(12.6,35.4)vs.40.4(22.2,47.4) %,P=0.041)];放线菌门[0.7(0.1,5.1)vs.1.5(0.4,4.2) %,P=0.359)];变形菌门[3.6(1.1,16.5)vs.5.4(3.0,23.1) %,P=0.312)];梭杆菌门[0(0,0)vs.0(0,0.2) %,P=0.007)];其他菌门[0(0,0.6)vs.0(0,0.2) %,P=0.981)]。

图1 门水平肠道主要菌群结构结果
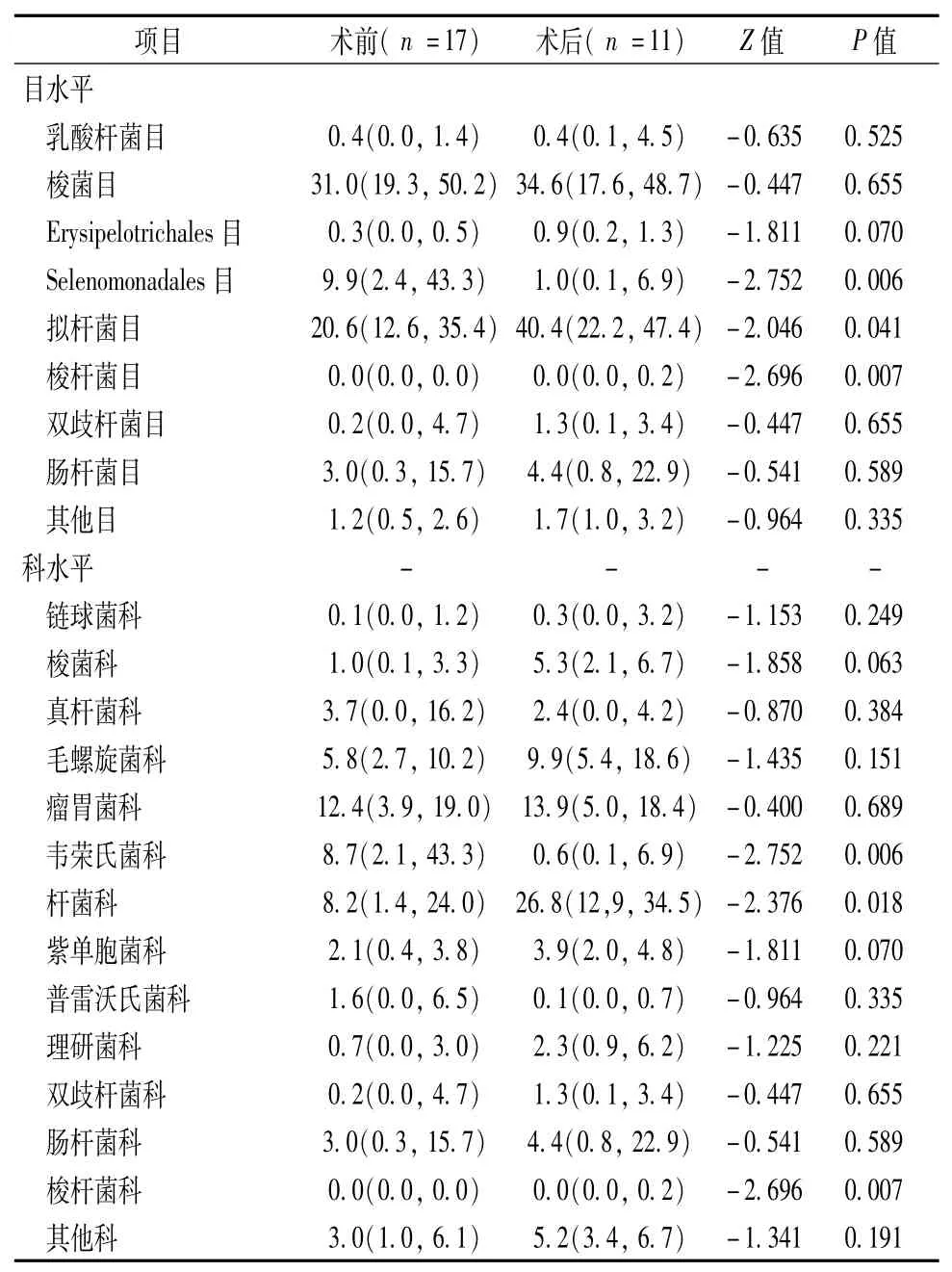
表2 不同组间目和科水平肠道菌群结构结果[M(QR),%]
术前组和术后组在纲、目、科水平肠道菌群结构(表1~2)有明显差别的菌群包括:Negativicutes纲[9.9 (2.4,43.3)%vs.1.0(0.1,6.9)%,P=0.006],拟杆菌纲[20.6(12.6,35.4)%vs.40.4(22.2,47.4)%,P=0.041],梭杆菌纲[0.0(0.0,0.0)%vs.0.0(0.0,0.2),P=0.007]; Selenomonadales目[9.9(2.4,43.3)%vs.1.0(0.1,6.9)%,P=0.006)];拟杆菌目[20.6(12.6,35.4)%vs.40.4(22.2,47.4) %,P=0.041)],韦荣氏菌科[8.7(2.1,43.3)%vs.0.6(0.1,6.9) %,P=0.006],杆菌科[8.2(1.4,24.0)%vs.26.8(12.9,34.5) %,P=0.018],梭杆菌科[0.0(0.0,0.0)%vs.0.0(0.0,0.2) %,P=0.007]。
门、纲、目、科水平肠道菌群结构在不同性别组间差异无统计学意义(P>0.05),在不同年龄组(>50岁组和≤50岁组)间差异无统计学意义(P>0.05)。
3.胃肠道症状评分与门水平肠道菌群结构间的相关性研究 Spearman相关性分析结果显示,GSRS除与拟杆菌门r=0.386(P=0.042)有相关性外,与厚壁菌门、放线菌门、变形菌门、梭杆菌门、其他菌门无相关性,分别为:r=-0.263(P=0.177),r=-0.136(P=0.489),r=0.013(P=0.947),r=0.262(P=0.178),r=-0.081(P=0.681)。 性别、年龄与门水平肠道菌群结构也无相关(P>0.05,表3)。
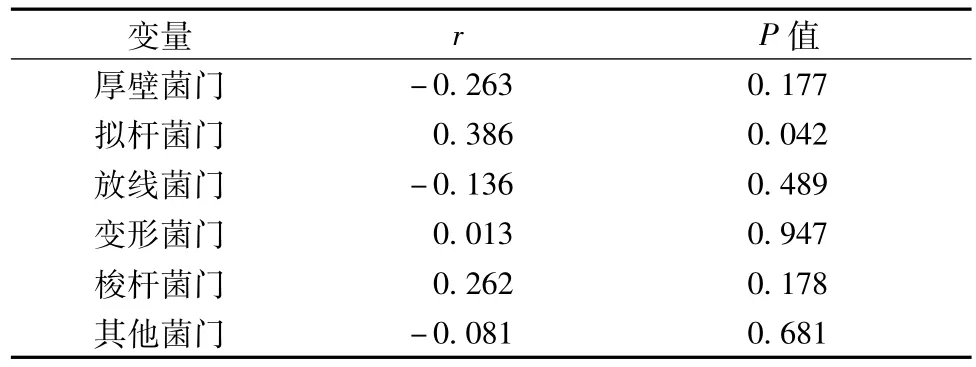
表3 胃肠道症状评分与门水平肠道菌群结构间相关性分析结果
讨 论
胃肠功能紊乱是体外循环心脏手术的主要并发症之一,体外循环转流期间,患者全身的血液将发生再分布,胃肠道的血液供应明显减少,导致其缺血、缺氧,而在心脏复跳、部分转流期间及血液回输之后,会出现新的缺血-再灌注损伤,此过程将造成胃肠道黏膜的损害,进而影响胃肠道的蠕动和排空功能,最终导致胃肠道症状的发生;在手术后应激的状态下,也可以出现胃肠道黏膜屏障受损、胃黏膜内脂质过氧化物含量升高和氧自由基产生增加等多方面改变,术后如出现低心排或者循环不稳定,也将导致大剂量儿茶酚胺药物的使用,从而引起内脏血管收缩,组织灌注降低,加上术后应用镇静、镇痛及肌松等药物,更抑制胃肠道的蠕动和排空功能,最终导致胃肠道症状的发生[6-7]。既往有研究显示手术应激后患者肠道菌群结构发生显著改变,而给予粪便移植、微生态制剂等改变肠道微环境以后患者感染及腹部症状均明显缓解[9]。因此,我们考虑主动脉夹层手术后胃肠道症状的发生与肠道菌群结构的变化具有内在的联系,本研究旨在初步探讨行主动脉夹层手术患者胃肠道症状与肠道菌群结构特征之间的关系。
我们的研究发现性别、年龄对主动脉夹层手术患者肠道菌群结构无影响。主动脉夹层患者肠道主要菌群包括厚壁菌门、拟杆菌门、放线菌门和变形菌门,其中厚壁菌门和拟杆菌门是占比最多的菌门。主动脉夹层术后拟杆菌门比例明显增加,其所属拟杆菌纲、拟杆菌目、杆菌科水平明显增加,厚壁菌门所属Negativicutes纲、Selenomonadales目、韦荣氏菌科比例下降,梭杆菌门及其所属梭杆菌纲、梭杆菌目、梭杆菌科比例增加。拟杆菌门/厚壁菌门比值明显增加。肠道菌群是影响人体微环境稳态的重要因素[4],正常肠道菌群参与宿主的营养代谢,外源物和药物代谢,维持肠黏膜屏障的结构完整性,参与免疫调节和对病原体的拮抗。当人体受到的刺激超过自身调节能力时,肠道细菌的平衡状态被打破,引起菌群失调,严重时会导致疾病的发生[10-12]。有研究发现肠道菌群影响肠道蠕动和传输功能,拟杆菌门所属菌群可以抑制肠道传输,而厚壁菌群所属菌群可以促进肠道传输,拟杆菌门/厚壁菌门比值降低可以促进肠道蠕动和传输[13-14]。我们考虑主动脉夹层手术导致患者术后拟杆菌门比例增加、拟杆菌门/厚壁菌门比值增加,抑制肠道蠕动和传输功能,进而产生胃肠道症状。2018年欧洲基础治疗胃肠病学会发布的益生菌在下消化道症状管理中的应用共识认为特定的益生菌有助于减轻下消化道症状,症状的改善会促进患者健康相关生活质量的改善,益生菌对有一系列下消化道症状的患者具有良好的安全性[15]。
我们的研究有一定的局限性。所有受试者来自于单中心,其中存在潜在的选择偏倚。此外,患者例数较少限制了研究的统计力。但我们首次对主动脉夹层手术患者的肠道菌群结构特点进行了研究。在今后的研究中有待增加样本量以及开展多中心研究以进一步确认。
综上所述,主动脉夹层手术后患者肠道菌群结构较术前发生明显变化,主动脉夹层手术治疗前后患者胃肠道症状的发生与肠道菌群结构改变有一定相关性,这可能为术后患者益生菌治疗胃肠道症状提供了依据。
