机器人辅助全胰腺切除术的疗效分析
2018-10-30陈梦闽孙长杰施昱晟翁原驰金佳斌彭承宏
陈梦闽,王 越,孙长杰,施昱晟,秦 凯,翁原驰,金佳斌,彭承宏
(上海交通大学医学院附属瑞金医院,上海,200025)
胰腺的特殊解剖结构,使得胰腺切除术成为腹部外科较复杂且极具挑战性的手术,随着微创外科技术的发展,自2003年Giulianotti等[1]首次报道机器人辅助胰腺手术至今,机器人胰腺外科不断发展,日渐成熟,而全胰切除术是其中最具挑战性的手术方式之一[2]。由于部分胰腺切除术后可能带来胰瘘及相关并发症、切缘阳性、原位复发等问题,全胰腺切除术被越来越多的应用于胰腺恶性肿瘤、导管内乳头状黏液瘤伴恶变倾向、广泛浸润的胰腺神经内分泌肿瘤及慢性胰腺炎疼痛难以忍受的患者[3],相应地扩大淋巴清扫也可获益。全胰腺切除术手术范围大、难度高、风险大,相较传统开腹手术,本研究旨在探讨机器人全胰腺切除的安全性及可行性。
1 资料与方法
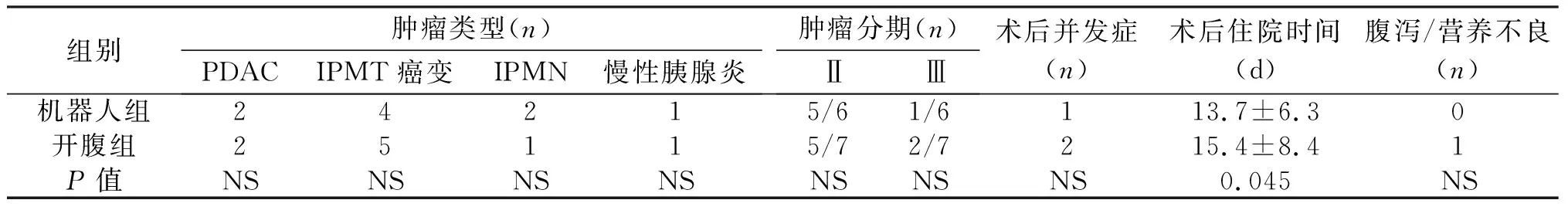
1.1 临床资料 回顾分析2016年3月1日至2018年1月31日我院施行的35例全胰腺切除患者的临床资料,其中9例行机器人全胰腺切除术,26例行开腹全胰腺切除术。随访时间至2018年7月31日。术前评估患者全身情况,常规行上腹部增强CT或增强MRI等检查,评估胰腺肿瘤大小、位置与性质,明确肿瘤与周围大血管的关系及浸润范围。记录两组患者基础信息、既往史、美国麻醉师协会(American Society of Anesthesiologists,ASA)评分、BMI、术前生化指标(血清胆红素、白蛋白、CA19-9等)、肿瘤相关指标(病理学诊断、大小、切缘、淋巴结清扫情况)、术中情况(手术方式、手术时间、术中出血量、联合血管切除重建等)及术后恢复情况(术后并发症发生率、术后住院时间、血糖控制情况、营养状况等)。根据性别、年龄、BMI、ASA评分、术前生化、肿瘤性质、是否联合血管切除等对9例机器人辅助全胰腺切除及开腹全胰腺切除进行1∶1配对分析。开腹及机器人组中9例患者主要病理诊断包括胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)、胰腺导管内乳头状黏液瘤/癌(intraductal papillary mucinous neoplasm/tumor,IPMN/IPMT)及慢性胰腺炎。两组患者年龄、性别、ASA评分等基本临床资料差异无统计学意义,见表1。

表1 两组患者术前临床资料的比较
1.2 手术方法
1.2.1 机器人组 全身麻醉后患者取头高足低分腿位,头侧约抬高45度,常规消毒铺巾。左侧肋弓下穿刺建立气腹,压力维持在15 mmHg。脐上穿刺12 mm Trocar作为观察孔,探查腹腔,无肿瘤转移。穿刺3枚机器人专用Trocar,镜头孔与R1孔之间穿刺12 mm Trocar助手孔,见图1。由左向右离断胃结肠韧带,进一步延伸游离显露结肠肝曲,至十二指肠水平段。沿胰腺下缘解剖肠系膜上静脉(superior mesenteric vein,SMV),进一步向右上方游离十二指肠,做Kocher切口,探查肠系膜上动脉(superior mesenteric artery,SMA)。于门静脉右侧沿十二指肠及近端空肠切除肠系膜、Treitz韧带,完整游离近端空肠,并拖出至足够吻合长度,离断空肠(白钉)。进一步向左侧游离脾胃韧带及脾结肠韧带,处理胃短动脉,游离脾脏上下缘。于肠系膜上静脉水平建立胰后隧道,向左游离胰体尾下缘,进一步游离胰腺后缘并行淋巴结清扫,离断后缝扎脾静脉。打开小网膜囊,沿胰腺上缘解剖腹腔干及其分支,注意保护肝总动脉(common hepatic artery,CHA)及胃左动脉(left gastric artery,LGA),离断后缝扎脾动脉(splenic artery,SpA)。向右上清扫肝十二指肠韧带淋巴脂肪组织。离断后缝扎胃十二指肠动脉(gastroduodenal artery,GDA)、胃右动脉、胆囊动脉。顺行切除胆囊,胆囊管水平离断胆总管。用腔镜直线型切割吻合器(蓝钉)离断半胃。游离胰体尾及脾脏后,沿胰后隧道向右解剖分离至胰腺钩突,牵拉标本离断钩突并清扫肠系膜上动脉旁淋巴结。完整移除标本及清扫的淋巴结,置入标本袋,暂存于右下腹。将远端空肠上提行胆肠吻合,用5-0 PDS-Ⅱ线连续缝合。距胆肠吻合口40 cm处以3-0 Vicryl标记胃肠吻合部位,原屈氏韧带下拖出空肠,上提行胃肠吻合。门静脉或肠系膜上静脉如侵犯,在肿瘤根治的情况下仍可行全胰腺切除联合血管切除重建,于肿瘤受累部位远、近端用腔镜Bulldog阻断受累血管。节段切除受累静脉后行残端修剪,用6-0 Prolene线由后壁向前壁连续外翻缝合,至最后两针处暂不拉紧缝线,由远向近松开Bulldog,待血管充盈后拉紧缝线并打结。缝合中血管腔内喷注肝素,防止血栓形成。见图2、图3。
1.2.2 开腹组 全身麻醉后患者取平卧位,常规消毒铺巾。做上腹部正中切口或“反L形”切口。解剖游离全胰腺步骤与机器人手术大体相同。如肿瘤侵犯重要血管或难以分离胰腺钩突时,可于肠系膜上静脉水平离断胰腺,充分暴露后行胰腺钩突分离。

图1 机器人组Trocar位置(C:镜头孔;R1~R3:机器人操作孔;A:助手孔)
1.3 统计学处理 采用SPSS 24.0软件进行数据分析。计数资料以百分比表示。计量资料采用Kolmogorov-Smirnov法进行正态分布检测,符合正态分布的数据以均数±标准差表示;非正态分布数据以中位数(上、下四分位数)表示。对各组数据进行方差齐性检测,方差相齐的数据,采用t检验递交两组间的差异;对计数数据、方差不齐的计量资料,采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
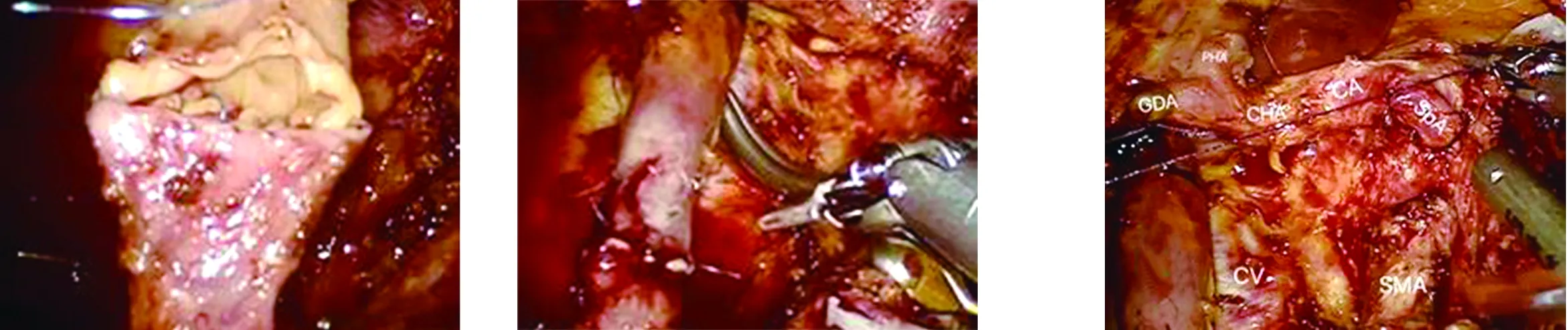
图2 SMV-PV切除重建图3 术中解剖
2 结 果
两组肿瘤病理分型及分期差异无统计学意义。机器人组全胰腺切除术手术时间[(311.1±62.5)min vs. (348.9±160.3)min]短于开腹组,差异有统计学意义(P=0.025);术中出血量[(301.3±173.2)mL vs. (688.9±596.7)mL]少于开腹组,差异有统计学意义(P=0.002);机器人组4例(44.4%)患者术中输血,开腹组6例(66.7%)输血,两组相比差异无统计学意义。术后机器人组仅1例(11.1%)出现围手术期并发症(肺部感染),开腹组2例(22.2%)发生并发症,其中1例结肠瘘,1例腹腔感染。两组均无再次手术及围术期死亡病例。机器人组术后住院时间[(13.7±6.3)d vs.(15.4±8.4)d]短于开腹组,差异有统计学意义(P=0.045)。见表2。
机器人中1例患者因合并右肾透明细胞癌行右肾联合切除,开腹组1例患者联合行全胃切除。两组中均有3例患者行联合肠系膜上静脉-门静脉切除重建,两组R0切除率均为100%。机器人组淋巴结清扫数量[(18.9±6.2)枚vs.(21.3±16.1)枚]少于开腹组(P=0.009),差异有统计学意义。
术后患者至少随访6个月,慢性胰腺炎及胰腺肿瘤患者术后未再出现慢性疼痛。缓慢恢复普食后全胰腺切除术患者均长期使用胰岛素(三餐前短效+睡前中-长效)控制血糖,血糖控制水平为4~13 mmol/L。同时饮食辅以胰酶制剂,开腹组中1例(11.1%)患者出现恶性腹泻、营养不良表现。由于随访时间较短,无法对全胰腺切除术后远期疗效进行评估。

表2 两组患者术中及术后恢复情况的比较
续表2
3 讨 论
全胰腺切除术由Billroth等于1884年首次实施,在外科技术发展早期,由于胰腺缺失状态从而导致消化功能障碍、血糖调节失衡,严重影响患者的术后生活质量,甚至死亡,一度被视为手术禁忌[3]。此后,随着胰岛素的应用、内分泌调控血糖水平的提高及消化酶制剂的研发,全胰腺切除术后血糖控制不佳、营养不良等主要问题得到解决,使得全胰腺切除术在治疗胰腺相关疾病中的价值及意义得到重新认可[4-5]。对于累及全胰腺恶性程度较低的病变,更可施行全胰腺切除联合胰岛细胞自体移植术[5-6]。全胰腺切除术由1998年的9.3%上升至2004年的14.3%[7]。本研究通过至少6个月的随访,不论是机器人辅助抑或开腹全胰腺切除术,术后在良好控制血糖及辅助消化等方面均取得较好疗效,仅1例患者出现恶性腹泻,进一步验证了全胰腺切除对患者术后生存质量的影响是可控的,患者的术后生活质量明显改善。
全胰腺切除术的主要手术指征包括:慢性胰腺炎、PDAC、IPMN及多发的胰腺神经内分泌瘤(胰岛细胞瘤)[3,8-9]。对于慢性胰腺炎的全胰腺切除,其治疗意义在于改善患者的慢性疼痛表现。研究发现[5,10],全胰腺切除的慢性胰腺炎患者术后疼痛症状较术前明显改善。对于胰腺恶性肿瘤、IPMN、胰腺神经内分泌瘤等胰腺肿瘤,约80%位于胰头,其治疗常规术式为胰十二指肠切除术,然而术后并发胰瘘的风险较高,多项研究显示[11-13],胰腺部分切除术后胰瘘并发症发生率为3%~45%,部分学者认为,胰腺肿瘤患者行全胰腺切除术优于部分胰腺切除术。而Müller等[14]的研究发现,胰十二指肠切除术与全胰腺切除术在手术时间、术中出血量、住院时间等方面差异无统计学意义,但全胰腺切除术后患者生存质量优于胰十二指肠切除术。本研究中,两组患者R0切除率均达100%,淋巴结清扫数量约为20枚,术后并发症发生率低,无术后死亡病例,进一步验证了全胰腺切除术在扩大淋巴清扫范围、提高R0切除率、降低术后并发症发生率等方面存有优势。
近年随着微创外科的不断发展[15],2010年Giulianotti等[16]首次总结报道了机器人胰腺手术,此后,2011年首次报道机器人系统在全胰腺切除术、联合血管切除重建的胰腺肿瘤扩大根治术中的应用[17-18]。机器人辅助腹腔镜手术系统应用于临床,为这些高难度微创手术提供了新的选择。相较传统腹腔镜技术,机器人手术系统有其独特优势:(1)高清立体的三维成像系统、20倍的放大视野,可清晰显示小血管、淋巴结等细微的解剖结构;(2)如腕关节般灵活、可360°旋转的机械钳,为小空间内的精细操作提供了基础;(3)术者坐姿操作,降低了疲劳程度;(4)机械臂的稳定性,可更充分暴露术区解剖结构[2,15]。机器人辅助全胰腺切除术手术难度大,需要外科医生具备扎实的微创外科技术,本胰腺中心是在微创胰腺手术施行5年后才开展机器人全胰腺切除术。Boggi等[2]、de Mesquita Neto等[19]报道并总结了往年机器人全胰腺切除术,论证了其安全性、可行性,与开腹组相比,机器人全胰腺切除术具有出血少、术后住院时间短等优势。
本研究结果表明,机器人组较开腹组手术时间短、术中出血量少,差异有统计学意义,这得益于微创条件下机器人手术的精细操作,对创面出血的敏感性、精确性更高,止血操作更严密、及时,从而提高了手术质量。相较开腹组,机器人组术后住院时间短,微创术后快速康复的优势得到体现。机器人的微创路径,大大降低了腹腔感染的风险[20],机器人组中未出现术后腹腔感染病例。
目前普遍认为[2,17],当累及全胰的肿瘤浸润SMV-PV时需行全胰腺切除术联合SMV-PV切除重建,以达到R0切除。本研究中两组各有3例患者行全胰腺切除联合SMV-PV切除重建。根据国际胰腺外科研究组(international study group of pancreatic surgery,ISGPS)[21]对修补重建方式的定义,共分为4种,Ⅰ型:部分静脉壁切除后直接修补;Ⅱ型:部分静脉壁切除后通过补片修补;Ⅲ型:部分静脉段切除后直接行端端重建;Ⅳ型:部分静脉段切除后通过移植血管重建,至少需2个以上吻合口。在3例联合SMV-PV切除重建的机器人全胰腺切除术中,1例为Ⅰ型修补、2例为Ⅲ型切除后重建,吻合时间约为45 min,术后患者恢复良好,进一步证实了联合血管切除重建的机器人全胰腺切除术的安全性、可行性。
由于本研究中9例机器人手术多于近两年施行,因此尚未取得长期生存随访结果。但在机器人系统条件下更注重对微解剖结构的良好辨识,缺少开腹条件下的全局观。在淋巴结清扫方面,机器人组淋巴结清扫数量[(18.9±6.2)枚 vs.(21.3±16.1)枚]少于开腹组。然而根据目前国内外学者的共识[22-25],在提倡行标准范围淋巴清扫的背景下,避免盲目及无益扩大切除的同时保障必要的根治性,因此行胰腺癌根治术时,至少清扫15枚以上的淋巴结。这也初步证实机器人对胰腺肿瘤的治疗效果符合国际标准,能实现胰腺恶性肿瘤的根治性及治疗安全性。同时,本研究仍存在不足:(1)本研究方法为回顾性研究,实验观察结果所受影响因素较多,结论的可靠性低于前瞻性对照研究;(2)本研究样本量小,两组配对分析仅有9例病例,代表性较差;(3)本研究随访时间较短,无法对机器人辅助全胰腺切除术的远期疗效进行评估。因此机器人辅助全胰腺切除术的疗效评估,仍需多中心大样本的前瞻性研究,并由经验丰富的胰腺专科医生施行。
综上所述,总结本院近2年来9例机器人辅助全胰腺切除术的初步经验,证实了机器人全胰腺切除术、甚至联合血管切除重建的可行性、安全性及根治性。
