阿坝藏猪蒲江种群SLA-DRB基因片段SNP检测 及其与生长发育性状关联分析
2018-10-29朱未朱磊何凡付磊帅素蓉江建平
朱未, 朱磊, 何凡, 付磊, 帅素蓉, 江建平*
(1. 中国科学院成都生物研究所,成都610041; 2. 四川中测环境技术有限公司,成都611731; 3.四川农业大学动物科技学院,成都611130)
猪Susscrofadomesticus在解剖学、生理学、疾病发生机理方面和人Homosapiens极其相似(任丽华,2006),是人类疾病研究的潜力模型。小型猪的一般生物学特征与普通家猪基本相同,但其具有养殖成本低、便于实验操作、节约试剂与受试物等突出优势,目前已被广泛用于人类疾病模型构建、药理毒理学研究以及新药与化妆品评价等方面(Bronneretal.,2002;Garthoffetal.,2002;Ryskaetal.,2004;Sebertetal.,2005;Turketal.,2005;Imaietal.,2006;袁进,顾为望,2011)。目前,我国小型猪资源和品种主要有版纳微型猪、五指山猪、广西巴马小型猪、贵州香猪、滇南小耳猪、藏猪等(李群,2008)。其中,藏猪是我国唯一的高原高寒型放牧猪种,环境适应力强、抗病性高、饲养成本低,6月龄体质量约20 kg(何凡等,2013),适用于药物代谢实验,因而具有重要的经济价值和科研价值。在此基础上,进一步选育抗病能力强、生长发育稳定、小型化的品系具有良好的应用前景,而筛选可以作为标记辅助选择(marker-assisted selection,MAS)的遗传标记无疑是实现这一目标的重要手段。
研究表明,猪的白细胞抗原复合体(swine leukocyte antigen,SLA)基因多态性不仅影响猪对疾病的抵抗能力,还与个体生长发育、繁殖性能、胴体品质以及肉质等性状有关(Gautschi & Gaillard,1990;Mallardetal.,1991;彭勇波等,2005)。SLA基因主要分为Ⅰ、Ⅱ和Ⅲ三大类,其中,SLAⅡ类基因位于SLA-D区,控制机体的免疫应答与调控,在调节机体抗病能力方面起到非常重要的作用。SLAⅡ类基因包括DPA、DPB、DMA、DMB、DOA、DOB、DQA、DQB、DRA和DRB等,但仅SLA-DQ及SLA-DR基因能编码蛋白质(Shiaetal.,1991,1995)。SLA-DRB基因包含6个外显子和5个内含子,其产物由237个氨基酸残基组成(Gustafssonetal.,1990a,1990b)。吴圣龙等(2007)对苏太猪SLA-DQB和SLA-DRB基因外显子多态性及其与繁殖性能的关联分析发现,组合基因型BBDF的第3胎繁殖性能(总产仔数、产活仔数、初生窝重和断奶仔猪数)显著高于组合基因型AADD、AADF、ABDD和CCDF。张冬杰(2010)对黑龙江野猪与北京黑猪杂交的F1代个体的研究发现,SLA-DRB基因经BcnⅠ和MboⅠ酶切后产生BB型和AB型的个体,其仔猪的初生质量更大。这些研究结果表明,SLA-DRB基因的多态性在猪种的选育方面具有重要参考价值。
本文检测了近亲选配的阿坝藏猪SLA-DRB基因部分内含子3、外显子4、内含子4、外显子5共1 220 bp序列,分析了其单核苷酸多态性(single nucleotide polymorphism,SNP)位点多态性及其与生长发育性状的相关性,以筛选可以用于藏猪早期筛选的MAS遗传标记。这将为藏猪的选育、资源评价、利用及保护提供理论依据,促进藏猪实验动物化的研发工作。
1 材料和方法
1.1 实验动物
本实验的藏猪是引自四川省阿坝藏族羌族自治州红原县的1雄2雌全同胞藏猪的后代(F4~F6),饲养于四川省蒲江县复兴镇。雌雄藏猪分圈饲养,每圈2头,按日龄供料,每日09∶00和17∶00各饲喂1次,自动饮水器喂水。
1.2 性状测定
共测定89头藏猪(45雄44雌)不同月龄的体高、体长、头长、最大额宽、头深、尻高(荐部最高点至地面的垂直距离)、尻长(腰角前缘到臀端后缘的直线距离)、腰角宽、胸深、胸宽、胸围、腹围、管围(左前肢前臂骨上三分之一处的水平周径)和体质量共14项指标,具体测量标准参考何凡(2013)。体质量精确到0.05 kg,其他指标精确到0.2 cm。所有被测猪体尺均在喂食2 h后实地测定,体质量在早上饲喂前称量。管围率为管围除以其他体尺指标后所得的衍生指标。
1.3 SLA-DRB基因序列获取
取约25 mg耳组织样品,切碎后置于无菌的1.5 mL离心管中,细胞组织DNA提取试剂盒(TransGen Biotech,北京)提取DNA,通用型DNA纯化回收试剂盒(天根生化科技,北京)纯化组织DNA。
参照SLA-DRB基因序列(GenBank登录号:AY303991),利用Primer Premier 5.0设计PCR扩增引物,主要扩增区域为该基因的部分内含子3、外显子4、内含子4、外显子5,扩增片段长度为1 220 bp。上游引物序列为SLA-DRBF:5’-ACCCACTGAGCG-AGGGAAGGGATTG-3’,下游引物序列为SLA-DRBR:5’-GGAGGACGCAGAGCATAGCAGGAGC-3’。
PCR反应体系为25 μL,包括2×Mix 12 μL,上、下游引物各0.7 μL(10 pmol·μL-1),DNA模板1.6 μL(50 ng·μL-1),ddH2O 10 μL。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性35 s,68 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min,最后4 ℃保存。PCR产物用1.5%琼脂糖凝胶电泳检测,切胶后用试剂盒纯化,纯化产物送生工生物工程(上海)股份有限公司和北京六合华大基因科技有限公司测序。
1.4 数据分析
使用DNAStar中的MegAlign对测序获得的所有SLA-DRB基因序列进行比对,检测SNP位点。基于所有SLA-DRB基因序列计算其基因频率、基因型频率,并进行Hardy-Weinberg平衡卡方适合性检验(王铁岗,2009),计算位点纯合度(Ho)、位点杂合度(He)、有效等位基因(Ne)和多态信息含量(PIC)(Nei,1978)。参照Shi和He(2005)的方法,利用SHEsis(http://analysis2.bio-x.cn/myAnalysis.php)对SLA-DRB基因的SNP位点进行连锁不平衡分析,并根据连锁强度将各SNP位点分组,每组含1到多个SNP位点。对于仅含1个SNP的位点组(即独立SNP),利用Matlab的多因素方差分析评价该位点的单体型组合和日龄与各体尺指标的关联;对于含有2个及以上的SNP位点组,参照黄萌和蔡琳(2009)的方法,利用PHASE 2.1分析其在该藏猪群体中存在的单体型、单体型组合及各自频率,然后利用Matlab的多因素方差分析评价该位点组的单体型组合和日龄与各体尺指标的关联;合并两部分的分析结果,并用BHFDR对P值进行矫正。
2 结果
2.1 SNP位点的识别
共获得89头个体的SLA-DRB基因序列,通过序列比对发现存在14个SNP位点(图1),其中,6个突变位于内含子3,分别为g.11369 C>G、g.11387 A>G、g.11440 C>T、g.11468 C>T、g.11470 A>G、g.11478 C>T;1个突变位于外显子4(g.11532 A>G);7个突变位于内含子4,分别为g.11708 C>T、g.11829 A>G、g.11838 C>T、g.11911 T>G、g.11944 C>G、g.11945 A>G、g.11997 C>T;外显子5无突变。
2.2 SLA-DRB基因遗传结构分析
遗传结构分析结果(表1)表明,位点g.11369、g.11387、g.11470、g.11478、g.11532、g.11829、g.11838、g.11944、g.11945、g.11997处于中度多态(0.25
2.3 SLA-DRB基因位点连锁分析及单体型分析
根据连锁不平衡分析的定义,2个位点间的r2≥0.33,即2个位点处于强连锁状态。对SLA-DRB基因的14个SNP位点进行连锁不平衡分析,发现所有位点均存在直接或间接的强连锁关系(图2)。以14个SNP位点识别单体型,发现89头猪共有27种单体型,30种单体型组合。

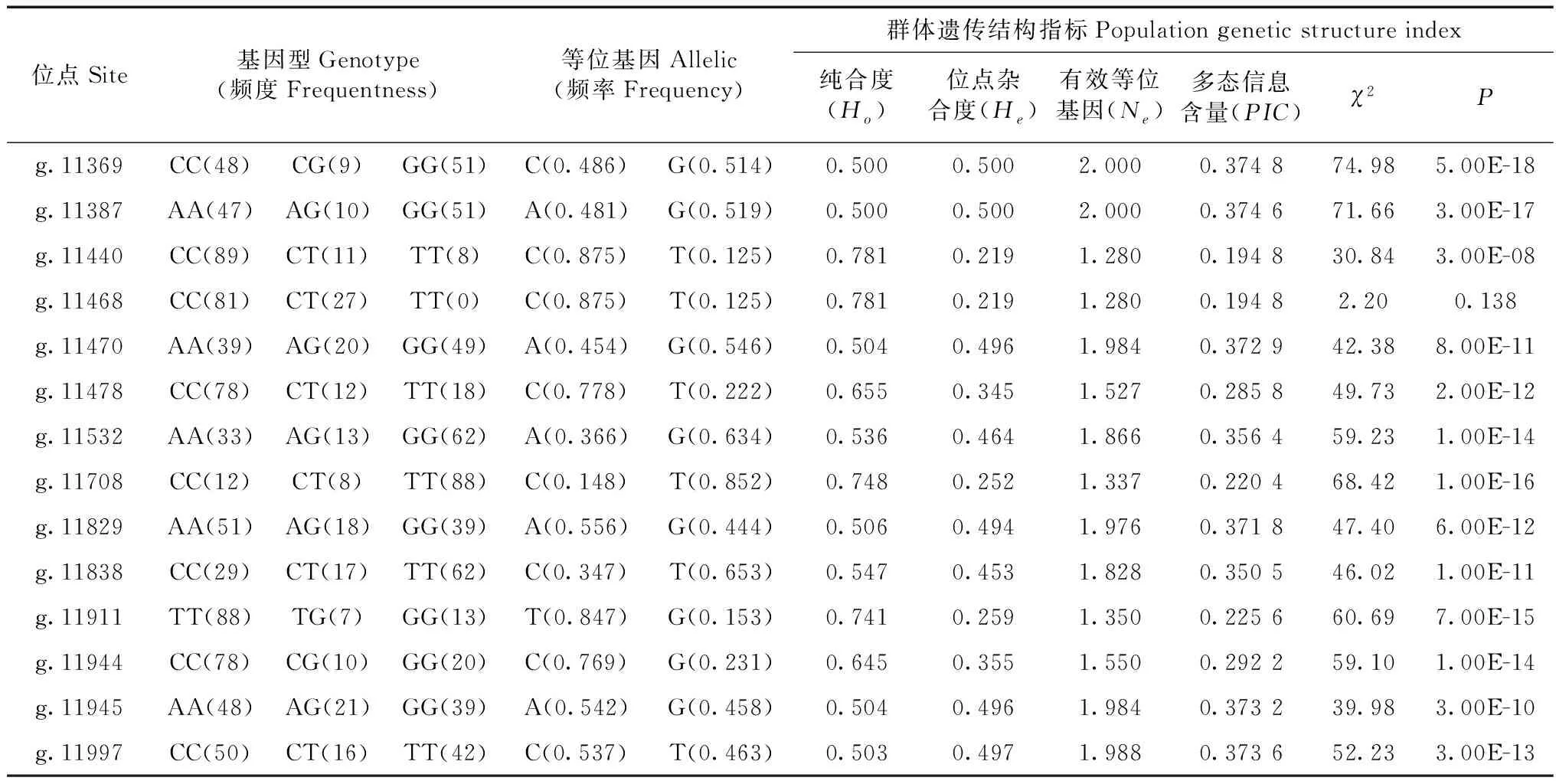
图1 藏猪SLA-DRB 基因14个单核苷酸多态性位点(箭头所指)Fig. 1 14 loci of single nucleotide polymorphisms of SLA-DRB gene in Tibetan pigs (arrows)
通过提高强连锁的标准(r2),发现g.11468、g.11440、g.11478与g.11944各自与其他位点的关联性相对较低;g.11911与g.11708间的关联性高,而与其他位点的关联性低;g.11470、g.11945、g.11997、g.11387、g.11369与g.11829两两间的关联性高;g.11532与g.11838两者间的关联性高(图2)。因此,将g.11470、g.11945、g.11997、g.11387、g.11369与g.11829归为紧密相关的SNP位点,定义为组合1;g.11532与g.11838归为紧密相关的SNP位点,定义为组合2;g.11911与g.11708归为紧密相关的SNP位点,定义为组合3。在此基础上,将所有样本的序列重新划分单体型(表2):组合1共有11种单体型(H11~H111)和12种单体型组合(H11H11=35、H111H111=37、H11H111=4、H11H51=3、H11H41=3、H31H51=1、H91H111=1、H71H111=1、H61H101=1,H71H81=1、H11H61=1、H21H111=1);组合2共有4种单体型(H12~H42)和5种单体型组合(H42H42=48、H12H12=26、H12H42=9、H12H22=5、H12H32=1);组合3共有2种单体型(H13、H23)和3种单体型组合(H13H13=73、H23H23=12、H13H23=4)。
2.4 SLA-DRB基因单体型与生长发育性状的关联分析
性别、各位点频次大于3的单体型组合与生长发育性状的关系分析结果(图3)表明:性别与腹围、体质量、胸宽、胸深、胸围和腰角宽的相关性显著,雌性较雄性大。g.11944和g.11440的位点多态性与所有体尺指标的相关性均不显著;g.11478的位点多态性与管围、尻高、体长和头长的相关性显著,单体型组合为C/T的个体具有较小的管围、尻高、体长和头长;g.11468的位点多态性与管围显著相关。组合3的位点多态性与除尻高、体质量和头长以外的所有体尺指标显著相关,这些体尺指标在单体型组合为TT/CG(H13H23)的个体中均偏小。组合2的位点多态性与管围、尻长和胸围的相关性显著,其中,单体型组合为AC/AT(H12H22)的个体有较小的尻长和胸围。组合1的位点多态性与管围、尻长、体高和胸深显著相关,其中,单体型组合为CAAGGT/CAGAAT(H11H41)的个体有较小的管围、尻长、体高和胸深。

图2 单核苷酸多态性位点间的相关性网络(基于r2值的连锁不平衡分析)Fig. 2 Network between the loci of single nucleotide polymorphisms (linkage disequilibrium analysis based on r2 value)

编号ID单体型Haplotype位点Locusg.11369g.11387g.11470g.11532g.11708g.11829g.11838g.11911g.11945g.11997频次FrequencyH11CAAGGTCAA——G——GT81H21CAAAGTCAA——A——GT1H31CAGGGTCAG——G——GT1H41CAGAATCAG——A——AT3H51CAGAACCAG——A——AC4H61CGGAACCGG——A——AC2H71GAAGGTGAA——G——GT2H81GAGAACGAG——A——AC1H91GGAAGTGGA——A——GT1H101GGAAGCGGA——A——GC1H111GGGAACGGG——A——AC81H12AC———A——C———67H22AT———A——T———5H32GC———G——C———1H42GT———G——T———105H13TT————T——T——150H23CG————C——G——28
管围受SLA-DRB基因单体型的影响最突出,共与5个位点存在关联(图3),且g.11478、g.11468、组合1和组合2与管围存在极显著的关联(FDR<0.001)。g.11478的单体型组合为C/C、g.11468的单体型组合为C/C、组合1的单体型组合为GGGAAC/GGGAAC(H111H111)和组合2的单体型组合为GT/GT(H42H42)的个体具有更大的管围(图4)。
2.5 SLA-DRB基因单体型与管围率的关联分析
单体型组合与管围率间关系的分析结果(图5)表明:g.11478、g.11468、组合1和组合2的位点多态性与基于额宽、腹围、尻高、体长、体高、头长、头深、胸宽、胸深、胸围和腰角宽的管围率均存在极显著的关联(FDR<0.001),提示这些位点多态性与藏猪的管围密切相关。与这些位点多态性关联最紧密的是基于体高的管围率,其中,g.11478的单体型组合为C/C、g.11468的单体型组合为C/C、组合1的单体型组合为GGGAAC/GGGAAC(H111H111)和组合2的单体型组合为GT/GT(H42H42)的个体有更大的管围率(图6),与管围的结果一致,提示其可以有效反映个体的体型、健康状况。基于其他长度指标的管围率大致具有相同的趋势。与基于长度指标的管围率不同,基于体质量的管围率与g.11478、g.11468、组合1和组合2的位点多态性无显著相关性。
3 讨论
为了推进藏猪实验动物化的培育工作,本课题组从四川省阿坝藏族羌族自治州引入全同胞藏猪,在四川省蒲江县进行近亲繁育,早期的研究工作探讨了垂体特异性转录因子(pituitary specific transcription factor-1,POU1F1)第4内含子SNP位点多态性对该藏猪种群生长状况的影响,发现POU1F1基因的g.13952A、g.14192T、g.14384G、g.14464T位点分别为A/A、T/T、G/G和T/T的个体在所测个体中生长最缓慢,提示POU1F1基因对该藏猪群体的小型化筛选具有指导价值(何凡等,2013)。
本文进一步研究了该群体中SLA-DRB基因部分序列(部分内含子3、外显子4、内含子4、外显子5)的多态性,共发现了14个SNP位点。根据这些位点的连锁相关性,共识别出3个组合和4个单一位点。分析表明,不同位点组合/单一位点与藏猪个体生长发育性状间相关的程度不同。

图3 单体型组合与各体尺指标的关联分析Fig. 3 Association analysis between haplotype combination and growth traits
每一方格的颜色代表-log10转换的P值, 颜色越深代表该值越大, 即FDR值越小, 该组合与该体尺指标的关联越显著; *** FDR<0.001, ** FDR<0.01, * FDR<0.05; 方格中标注的单体型组合的含义为在这一多态性位点上拥有该单体型组合的个体, 其对应的体尺指标最小; 下同
The color of tiles stands for -log10transformedPvalue, the darker, the bigger, then FDR value is smaller; *** FDR<0.001, ** FDR<0.01, * FDR<0.05; individuals with haplotype combinations labelled on a certain tile tend to have smaller corresponding growth trait; the same below

图5 单体型组合与管围率的关联分析Fig. 5 Association analysis between haplotype combination and the ratio of cannon bone circumference (CBC) to other growth traits
方格中标注了2种单体型组合, 具有上排单体型组合的个体的管围率偏大, 具有下排单体型组合的个体的管围率偏小; M. 雄性, F. 雌性
Two types of haplotype combinations were labelled in tiles, individuals with the upper haplotype combinations tend to have larger ratio of CBC to corresponding growth trait, while those with lower haplotype combinations tend to have smaller ratio of CBC to corresponding growth trait; M. male, F. female

图6 单体型组合与基于体高的管围率的关联Fig. 6 Association between haplotype combination and the ratio of cannon bone circumference to the body height
3.1 SLA-DRB基因SNP位点多态性与个体生长发育的关系
已有研究表明,SLA-DRB基因SNP位点多态性与猪的繁殖性能(总产仔数、产活仔数、初生窝重、断奶仔猪数等)密切相关(吴圣龙等,2007;张冬杰,2010)。本研究结果表明,SLA-DRB基因与藏猪个体的生长发育速率亦存在关联。其中,组合3与藏猪的发育速率最相关,影响个体的额宽、腹围、管围、尻长、体长、体高、头深、胸宽、胸深、胸围、腰角宽等体尺指标。值得注意的是,具有H13H23(TT/CG)单体型组合个体的上述所有指标均最小,意味着该基因型的个体生长较为缓慢,整体体型偏小。组合H13H13与H23H23个体间的体尺指标差异不大,对小型化藏猪个体的筛选意义有限。除组合3以外,组合1和g.11478分别与体高和体长相关联,具有单体型组合H11H41(CAAGGT/CAGAAT)的个体具有较小的体高,而g.11478的单体型组合为C/T的个体具有较小的体长。表明SLA-DRB基因SNP位点多态性与藏猪个体生长趋势存在显著关联,提示其可作为潜在的MAS遗传标记候选基因应用于特定生长趋势藏猪品系的筛选。
3.2 SLA-DRB基因SNP位点与管围的关系
本研究发现,与SLA-DRB基因SNP位点多态性最为相关的藏猪体尺指标为管围。管围与管骨的粗细密切相关,而管骨为长骨,其内具有丰富的骨髓。脊椎动物骨髓内含有丰富的间充质干细胞,属于多能干细胞,可以分化为成骨细胞、软骨细胞、心肌细胞、骨髓脂肪细胞和beta-胰岛细胞等(Ankrumetal.,2014)。管围和管围率较大的藏猪个体理应具有较多的管骨骨髓,因而可能在骨发育、心肌功能等方面更具优越性。除此以外,骨髓更是淋巴系统的重要组成部分,是造血组织细胞分裂分化为淋巴细胞的重要场所,与胸腺共同完成淋巴细胞的产生和早期选择(Yoffey,1975)。SLA基因作为猪的主要组织相容性复合体基因,在淋巴细胞的产生和选择过程中发挥着重要作用(Nakayama,2015)。研究结果表明,管围与SLA-DRB基因多态性之间存在极显著的关联,这与SLA-DRB基因在免疫系统中所扮演的角色相符合。因此,下一步的研究应着力于证实管围与管骨骨髓含量、淋巴血细胞造血能力以及个体免疫能力之间的关联性,为基于SLA-DRB基因的MAS遗传标记开发提供完善的理论依据。
除潜在的免疫力指示作用以外,管围及管围率直接影响藏猪的体型。研究表明,马的管围率(管围/体高)与其速度、步态特征具有显著关联,管围率大的个体奔跑速率较低(李敏等,2014a,2014b),藏猪可能存在类似的关联。另外,猪的管围是肉猪市场的重要选择指标,因为管围可能与生长速率、性成熟时间等因素相关(Myersetal.,2012)。因此,管围在培育实验动物猪、宠物猪、娱乐猪和食用猪等方面均具有重要参考价值。而SLA-DRB基因与管围之间的显著关联则为早期遗传辅助筛选提供了潜在途径。
根据本研究结果,g.11468、g.11478、组合1和组合2的单体型组合分别为C/C、C/C、GGGAAC/GGGAAC和GT/GT时,个体趋向于有较大的管围率,而这些单体型组合均为纯合性。这意味着一旦证实了管围与免疫能力之间的关联,这些单体型组合可以作为实验用藏猪的筛选标准。
综上所述,本研究测定了89头人工藏猪种群的部分SLA-DRB基因序列,并从中鉴定出了14个SNP位点,根据这些SNP位点的连锁紧密程度识别出3个组合和4个位点。经过与体尺指标的关联性分析,发现组合1的多态性与藏猪个体的体型存在关联,而g.11468、g.11478、组合1和组合2的位点多态性则与个体的管围、管围率显著相关。本研究结果为SLA-DRB基因作为MAS遗传标记候选基因提供了理论依据,为藏猪的定向遗传筛选提供了基础数据和参考资料。
