陕西市售国产头孢克洛口服制剂质量评价
2018-10-25赵玉绒郝武常
赵玉绒 ,杜 珊 ,郝武常
(1.陕西省新药审评中心,陕西 西安 710065; 2.陕西省榆林市食品药品稽查大队,陕西 榆林 719000)
头孢克洛(cefaclor),化学名为(6R,7R)-7- [(R)-2-氨基-2-苯乙酰氨基]-3-氯-8-氧代-5-硫杂 -1-氮杂双环[4.2.0]辛 -2- 烯 -2-甲酸一水合物,为第2代半合成头孢菌素类抗生素,1976年由美国礼来公司研制成功,1979年获美国食品药物管理局(FDA)批准,1982年在美国、日本等国上市,1985年取代头孢氨苄成为当年世界最畅销抗生素[1-3]。1994年2月,头孢克洛在我国首次研发成功,并由山东淄博新达制药有限公司首次推向市场,商品名为新达罗。到2006年,国内头孢克洛制剂生产企业已达45家。头孢克洛抗菌谱广、抗菌活性强、不易产生耐药性,安全有效[1-11],临床主要用于治疗敏感菌所致呼吸系统、泌尿系统、耳鼻喉科及皮肤、软组织感染等。目前,头孢克洛胶囊、颗粒剂型已收入《国家基本医疗保险和工伤保险用药目录》,2004年修订医保目录时又将缓释片剂型纳入其中。2007年,头孢克洛在国内市场增长率达35%,在抗生素中居前10位,而排在其前面的品种都是近几年才上市的小头孢品种,上市时间晚、原料产量少,故其制剂价格较高。
经查询原国家食品药品监督管理总局网站,全国头孢克洛原料的批准文号共有10个;口服制剂的批准文号共有115个,含10种剂型,其中胶囊40个,颗粒22个,干混悬剂17个,片剂13个,分散片12个,缓释片5个,泡腾片2个,缓释胶囊2个,咀嚼片1个,缓释片(Ⅱ)1个。
陕西有多家企业在售该品种。本研究中对取样自陕西省各医疗机构及经营企业的头孢克洛口服制剂进行了质量考察。现报道如下。
1 研究样本选择
选取陕西省生产的头孢克洛口服制剂共69批次(包括胶囊剂15批、片剂6批,分散片6批、颗粒22批、干混悬剂20批),其中颗粒和干混悬剂占比较大,分别为抽样的 31.88%和 28.99%,其次为胶囊剂(占21.74%)。按照现行质量标准对上述批次样品进行了全项检验,对检验数据进行统计与分析。特别对有关物质重点项目进行探索性研究,对头孢克洛口服制剂的内在质量进行评价。为消费者及临床医师选择、生产企业质控、监管部门监管提供参考。
头孢克洛口服制剂除分散片外,均被《中国药典(二部)》收载。分散片设置项目与检验方法基本与《中国药典》相同。比较而言,头孢克洛干混悬剂的杂质数目和量均略高于胶囊剂和片剂。
自Lilly公司在1975年合成头孢克洛以来,能制备出C3-氯代头孢母核的合成路线基本有2条:青霉素扩环和7-氨基头孢烷酸7-(ACA)的改造。合成头孢克洛的关键是合成[4]。
2 国内外标准对比分析[5-11]
头孢克洛分散片国内相关标准有执行标准(YBH05012009)及国家药品标准 [WS1-(X-072)-2003Z]。其胶囊剂、颗粒剂、片剂、干混悬剂均执行2010年版《中国药典》或2015年版《中国药典》标准(两版药典内容一致)。美国药典(USP)、英国药典(BP)、欧洲药典(EP)、日本药典(JP)现行版均收载了头孢克洛原料及其相关制剂。其中,USP收载了原料、咀嚼片、缓释片、口服混悬剂及胶囊剂;BP收载了原料药、缓释片、口服混悬剂及胶囊剂;EP仅收载了原料药;JP收载了原料药、颗粒及胶囊。目前,国内头孢克洛主要有胶囊剂、片剂、分散片、颗粒剂、干混悬剂等。对于相同品种,USP、BP及JP的质量标准均略高于《中国药典》,主要在有关物质、含量均匀度及溶出度方面,杂质的控制、溶出行为、剂量均一性的要求均高于《中国药典》。
3 分项检验结果与分析[6-15]
本研究中抽取样品69批,包括5种剂型,其中颗粒22批、干混悬剂20批、胶囊剂15批、片剂6批、分散片6批。
颗粒剂[5,14]:对抽取的 20 批头孢克洛颗粒性状、鉴别(薄层色谱法和液相色谱法二选一,本研究中采用液相色谱法),以及检查项下的酸度、水分、溶出度、粒度、含量测定进行评价,结果均符合标准规定。其中溶出度项下现行标准的限度为标示量的80%,与现行版JP溶出方法比较(85%),标准限度较低。
干混悬剂[12-13]:对抽取的20批头孢克洛干混悬剂的性状、鉴别(采用液相色谱法),以及检查项下的酸度、有关物质、水分、溶出度、装量差异、含量测定进行评价,结果均符合标准规定。但有关物质检查项下发现,大部分样品的单个杂质在0.3%以下,杂质总量在1.0%以下;有4批样品的单个杂质在0.3% ~0.5%之间,有1批样品的杂质总量接近限度,为2.97%。由检测数据可知,相同厂家的杂质基本控制在相同水平,不同厂家杂质检出量不同。陕西市场上,礼来公司的5批样品杂质检出量基本一致,也体现了较好的原料及生产工艺;海南三叶制药有限公司杂质水平与礼来公司基本一致;昆明贝克诺顿制药有限公司、广州白云山医药集团股份有限公司及珠海金鸿药业有限公司杂质检出量相对较大,且不同批次间差异较大。大部分样品杂质控制较好,杂质含量较少,且远低于限度。但如果按照国外药典限度要求来考察,部分厂家的头孢克洛干混悬剂杂质含量相对较大[14]。
胶囊剂[5]:对抽取的15批头孢克洛胶囊(来自9个生产企业)的性状、鉴别(采用液相色谱法),以及检查项下的有关物质、水分、溶出度、装量差异、含量测定进行评价,结果均符合标准规定。15批有关物质单个杂质在0.10% ~0.25% 之间,杂质总量在 0.10% ~ 0.62% 之间,均远低于标准规定,且各厂家各批次之间差异不大。按照国外药典限度要求,各厂家的头孢克洛胶囊有关物质也均符合规定。同时发现,头孢克洛胶囊溶出度测定在现行版《中国药典》标准中,采用了通则0931“溶出度与释放度测定法”中第一法(篮法),转速为100 r/min,30 min取样,以900 mL水为介质,采用紫外-分光光度法在264 nm波长处测定,限度为标示量的80%。USP、BP及 JP均采用 50 r/min;取样时间,USP为 30 min,BP为 45 min,JP为 15 min。限度要求 USP为标示量的80%,BP为标示量的75%,JP为标示量的80%。综合比较,《中国药典》对头孢克洛胶囊溶出度的要求比国外药典低。
片剂[5]:对抽取的6批头孢克洛片剂(来自5个生产企业的薄膜衣片)的性状、鉴别(采用液相色谱法),以及检查项下的有关物质、水分、溶出度、重量差异、含量测定进行评价,结果均符合标准规定。现行版《中国药典》规定,头孢克洛片剂有关物质限度为:单个杂质不超过1.0%,杂质总量不超过2.0%。国外药典未收载普通片剂,仅有咀嚼片。6批头孢克洛片剂按照标准检验,均符合规定。样品的单个杂质在0.10% ~0.41%之间,杂质总量在0.31% ~1.1%之间,均低于标准规定限度要求,且各厂家各批次之间差异不大。
分散片[5,10]:对抽取的 6 批头孢克洛分散片(来自3个生产企业)的性状、鉴别(采用液相色谱法),以及检查项下的有关物质、溶出度、重量差异、含量测定进行评价,结果均符合标准规定。头孢克洛分散片样品执行不同标准,新药转正标准未设定有关物质项目,YBH05012009标准规定头孢克洛分散片有关物质限度为单个杂质不得超过1.0%,杂质总量未作规定。国外药典未收载普通片剂,仅有咀嚼片。
4 探索性研究结果与分析[5-15]
头孢克洛口服制剂临床应用广泛,特别是其颗粒剂和干混悬剂在儿科应用甚广。故不仅需要对样品的检测数据作出评价,更需对质量标准进行全面和合理评价。
2010年版《中国药典》已经有了很大提高,已与国际标准接轨,2015年版《中国药典》与之相比则更加完善。通过与国外药典比较,头孢克洛制剂控制比较严格,但在溶出度条件及限度方面均略低于国外药典,同时在剂量均一性、杂质限度要求上也稍逊于欧美药典和《日本药局方》。
头孢克洛颗粒剂的有关物质[5,14]:尝试建立头孢克洛颗粒剂的检查方法,并对20批头孢克洛颗粒有关物质进行测定。参考2015年版《中国药典》头孢克洛干混悬剂有关物质测定方法测定头孢克洛颗粒有关物质,结果见表1。可见,样品中单个最大杂质均未超出限度要求的2.0%,杂质总量未超出限度要求的3.0%。按照现行版《中国药典》颗粒剂的限度要求,虽然所检颗粒样品均符合规定,但头孢克洛颗粒杂质检出量远大于其他口服制剂,且不同企业差异较大。《日本药局方》收载的头孢克洛细颗粒剂质量标准中设定有有关物质项目,且杂质的限度控制比较严格,单个杂质不得超过0.5%,杂质总量不得超过3.0%。按此要求,我国制剂约50%不符合规定。因在省评中并未得到生产企业提供的辅料,无法确认检出杂质的来源和归属,但作为儿科“热门药”,其质量控制应进一步提高。故颗粒剂增设有关物质检查很有必要,并应制订更严谨、合理的质量标准。
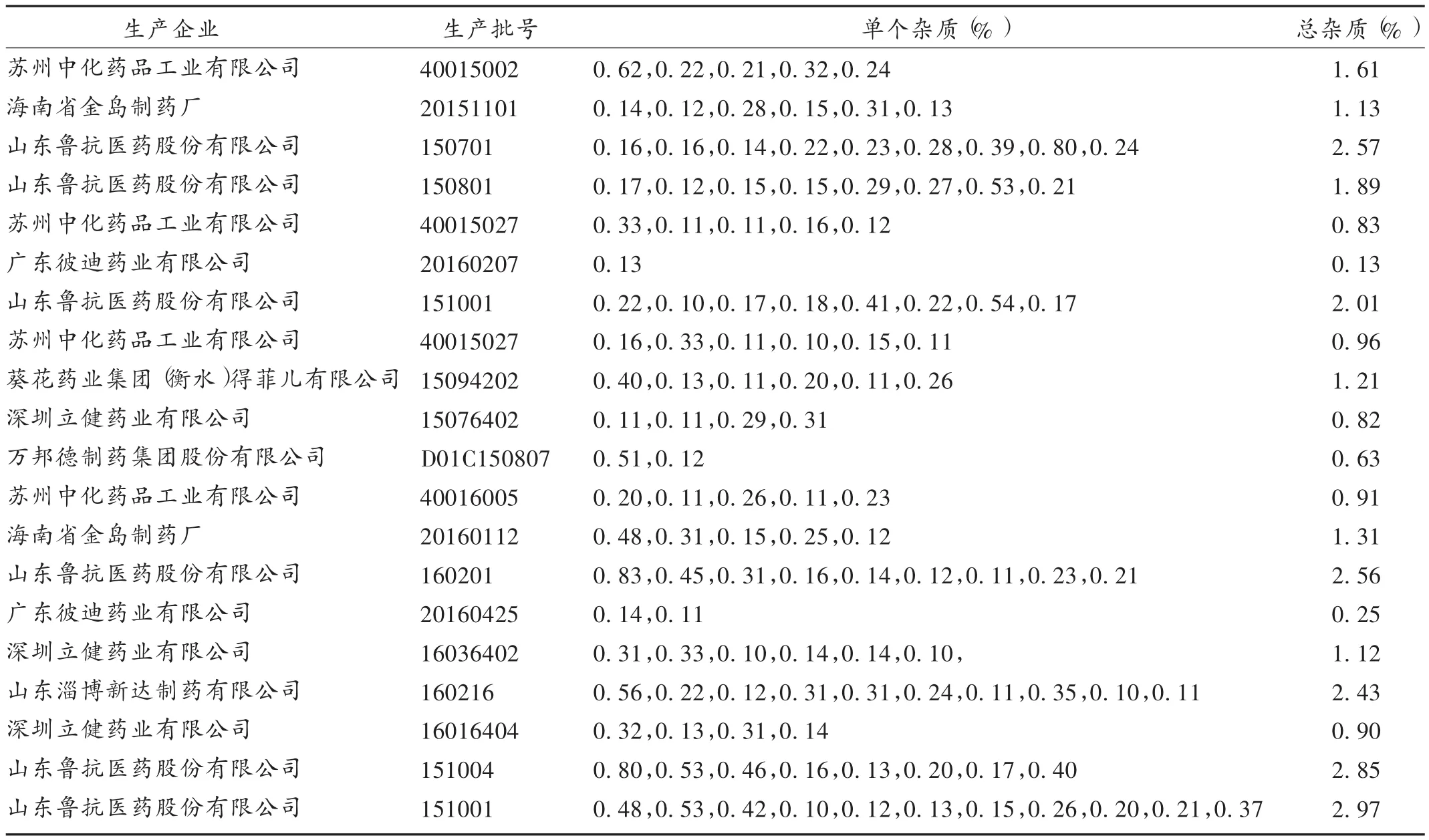
表1 头孢克洛颗粒有关物质检查结果
头孢克洛分散片的有关物质[5,14]:此次评价共选取6批头孢克洛分散片、6批头孢克洛片。《中国药典(二部)》仅收载了片剂,未收载分散片。本研究中参考YBH05012009标准,对执行新药转正标准的头孢克洛分散片也进行了有关物质测定。结果所有分散片的有关物质均符合规定(单个杂质含量介于0.1% ~0.30%),且各厂家之间差异较小。详见表2。故建议分散片标准均设定有关物质项目。
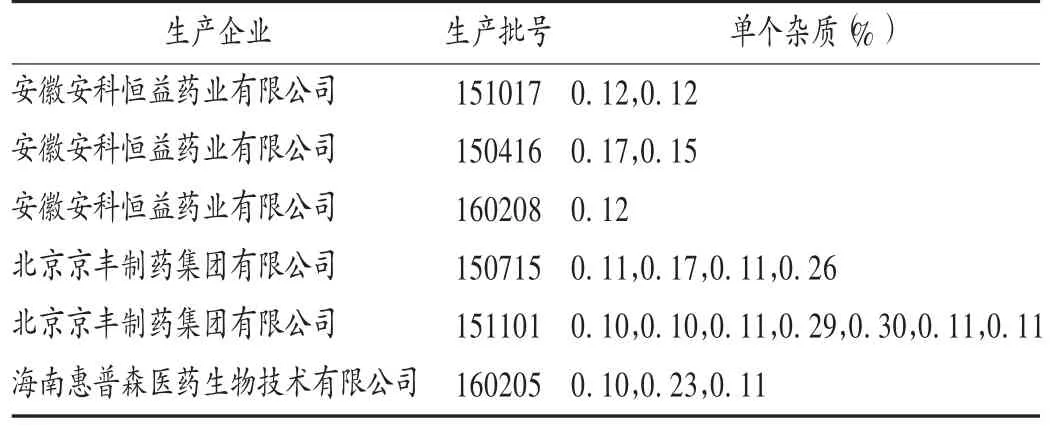
表2 头孢克洛分散片有关物质检测结果
5 讨论
5.1 现行版质量标准中存在的问题
溶出度检查:《中国药典》溶出度检查条件与限度要求均低于收载相应品种的国外药典。颗粒剂采用了通则0931 的第二法(桨法),转速 50 r/min,30 min 取样,以900 mL水为介质,限度为标示量的80%;现行版JP同样用了桨法,转速50 r/min,15 min取样,以 900 mL水为介质,限度为标示量的85%。胶囊剂采用了薄层色谱法,转速 100 r/min,30 min 取样,以 900 mL 水为介质,限度为标示量的80%;转速USP、BP及JP均采用50r/min;取样时间,USP 为 30 min,BP 为 45 min,JP 为 15 min;限度要求,USP为标示量的80%,BP为标示量的75%,JP为标示量的80%。综合比较,《中国药典》对头孢克洛胶囊溶出度的要求相较于国外药典偏低。
有关物质检查:《中国药典》虽然在检测方法上与国外药典保持一致,但限度要求低于国外药典。
剂量均一性检查:国外药典均执行“>25 mg或>25%:剂量均一性;<25 mg或<25%:含量均一性”。均较《中国药典》的重(装)量差异更严格。
目前,我国现行头孢克洛口服制剂质量标准中检测方法、项目设置合理、科学,符合我国国情,但在药品杂质控制、生物等效性检测方面跟国外仍有差距。
5.2 头孢克洛口服制剂质量状况的总体评价
本研究中选取的头孢克洛口服制剂共69批,5种剂型。所有批次均符合标准规定,质量良好。各生产企业产品虽有差异,但质量基本保持在良好水平。现行质量标准基本可行,但个别剂型(如颗粒)的质量控制标准仍需进一步完善。
