阿尔茨海默病β淀粉样蛋白水平监测: 11C-PIB PET/CT显像沉积量与血浆水平的相关性研究
2018-10-24王治国战莹武晓丹张宗鹏吴锐先张国旭
王治国,战莹,武晓丹,张宗鹏,吴锐先,张国旭
(沈阳军区总医院核医学科,沈阳 110016)
β淀粉样蛋白(β-amyloid protein,Aβ)是阿尔茨海默病(Alzheimer′s disease,AD)常见的生物标志物,是一种跨膜蛋白,由淀粉样蛋白前体蛋白(amyloid precursor protein,APP)剪切而来,是AD患者脑内老年斑的主要成分。研究表明,Aβ过度沉积可导致AD,所以对于Aβ的研究有利于了解AD的发病机制,为AD的临床诊断提供帮助。脑脊液(cerebrospinal fluid,CSF)由于直接与脑和脊髓接触,可提供脑内准确信息,因此被看作是非常有价值的AD生物标志物。但CSF的采集需要通过腰椎穿刺获得,对于患者具有侵入性并且成本较高,不利于临床上大规模筛查和纵向随访评估。研究发现,每天约有500 ml的CSF被吸收到循环血液中,因此血浆Aβ或可作为降低检查成本且无创的AD生物标志物。但迄今为止,血浆Aβ水平与AD发病间的相关性尚未明确。
近年来,正电子发射型计算机断层显像(positron emission Computed Tomography,PET)已被开发用于诊断AD。匹兹堡化合物B (Pittsburg compound-B,11C-PIB)能与细胞外和血管内纤维状的Aβ特异性结合,可作为Aβ特异性的分子探针评估不同脑区的Aβ斑块沉积情况,并且可作为无创性的检验手段,有助于动态监测蛋白沉积量,在AD患者早期诊断中发挥重要作用[1]。然而,11C-PIB沉积量与血浆Aβ水平的相关性尚未阐明。本研究拟将血浆Aβ水平与11C-PIB PET显示的Aβ沉积量相关联,确定其相关性,并探讨血浆Aβ是否可用作AD生物标志物。
1 对象与方法
1.1 研究对象
选取2014~2017年在沈阳军区总医院治疗的AD患者23例,其中男性12例,女性11例,年龄(68.3±7.6)岁,受教育年限(8.57±2.48)年,简易精神状态检查量表(mini-mental state examination,MMSE)评分(20.74±2.77)分,Hachinski缺血指数量表(Hachinski ischemic scale,HIS)评分<4分,AD的诊断依据美国国立神经病学、语言功能障碍和中风研究所(National Institute of Neurological and Communicative Diseases and Stroke/Alzheimer′s Disease and Related Disorders Association,NINCDS-ADRDA)标准[2],符合美国精神障碍诊断与统计手册第4次修订版(Diagnostic and Statistical Manual of Mental Disorders, 4th Edition-Revised,DSM-IV-R)有关AD的规定[3]。轻度认知障碍(mild cognitive impairment,MCI)患者29例,男性16例,女性13例,年龄(69.3±6.4)岁,受教育年限(8.38±3.19)年,MMSE评分(25.38±1.08)分,HIS评分<4分,MCI的诊断根据Petersen标准[4],其需要主诉认知障碍,连续反应时间>标准差(SD)1.50,保持日常生活能力。正常老年人17例,男性8例,女性9例,年龄(69.8±7.4)岁,受教育年限(9.18±2.48)年,MMSE评分(30.71±1.96)分,无认知功能及日常生活能力障碍(表1)。结合其他影像学检查,排除精神、代谢、免疫、肝肾功能异常、脑血管疾病、其他神经病症如帕金森病及可能患有其他类型痴呆的患者,如额颞叶痴呆或血管性痴呆。本研究经医院伦理委员会批准,所有研究对象或其家属均签署知情同意书。
1.2 研究方法
1.2.1 血浆Aβ检测 3组受试者取静脉血5 ml置聚丙烯 EDTA 抗凝管中,4℃下3000转/min离心后立即取血清置于-80℃冰箱保存。血浆Aβ42和Aβ40的测定采用双抗体夹心酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA),严格按照试剂盒要求操作。
1.2.211C-PIB PET/CT成像 采用美国 GE 公司生产的 Discovery VCT PET/CT扫描仪。患者于检查前禁食6 h以上,血糖控制在11.1 mmol/L以下。11C-PIB按照我科之前的标准生产程序在本院PET中心合成[5]。肘静脉注射PIB 3.7 MBq/kg,而后行动态PET发射断层扫描。PET/CT数据采集为3D模式,采集层数47层,采集层厚3.75 mm。图像重建采用128×128图像重建采集矩阵,PIB PET扫描采用60 min的动态扫描模式。PET数据经衰减校正、迭代法重建后和CT图像一同传送到Xeleris工作站进行同机图像融合。
1.3 图像处理
以颅脑计算机断层扫描(computed tomography,CT)为解剖指导,勾画出大脑和小脑皮质各种感兴趣区域(region of interest,ROI),形成额叶、外侧颞叶、顶叶皮层、楔前叶/后扣带回和前扣带回5个ROI,对每个ROI的最大摄取值进行测量,计算3个最大标准摄取值(maximal standard uptake value,SUVmax)的平均值。研究显示,小脑皮层在AD病变中无明显纤维斑块状Aβ沉积,故以小脑皮层作为参考区域,来计算各ROI平均标准化摄取值比(standardized uptake value ratio,SUVR)[6]。
1.4 统计学处理
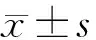
2 结 果
2.1 血浆Aβ蛋白水平和11C-PIB SUVR比较
NC、MCI和AD 3组血浆Aβ42、Aβ40蛋白水平差异无统计学意义(P>0.05),但Aβ42组间两两比较,AD组显著低于NC组,差异均有统计学意义(P<0.05)。NC、MCI和AD组Aβ42/Aβ40比值逐渐下降,11C-PIB SUVR值逐渐上升,组内比较和组间两两比较差异均有统计学意义(P<0.05;表1)。
2.2 血浆Aβ水平与全脑11C-PIB SUVR相关性分析
在控制了各组性别、年龄和教育程度后,血浆Aβ42水平、Aβ42/Aβ40与11C-PIB PET显像SUVR值呈负相关(r=-0.461,P<0.05;r=-0.633,P<0.05);血浆Aβ40与11C-PIB PET显像SUVR值呈正相关(r=0.430,P<0.05;图1)。
2.3 3组研究对象各脑区11C-PIB SUVR水平
NC、MCI和AD组各脑区11C-PIB SUVR值逐渐升高,组内和组间两两比较差异均有统计学意义(P<0.05;图2)。
2.4 血浆Aβ42/Aβ40水平与各脑区11C-PIB SUVR回归分析
由于血浆Aβ42/Aβ40在3组间的差异均具有统计学意义,且与全脑11C-PIB SUVR相关性较强,故只分析血浆Aβ42/Aβ40水平预测各脑区SUVR的意义。回归分析表明,额叶、外侧颞叶和后扣带回11C-PIB SUVR由血浆Aβ42/Aβ40比值预测,差异具有统计学意义(P<0.05),而顶叶皮层和前扣带回的PIB结合与Aβ42/Aβ40比值关系不具有统计学意义(P>0.05;表2)。

表1 3组患者血浆Aβ和11C-PIB SUVR水平比较
NC: normal control; MCI: mild cognitive impairment; AD: Alzheimer′s disease; Aβ: β-amyloid protein;11C-PIB: Pittsburg compound-B; SUVR: standardized uptake value ratio. Compared with NC group,*P<0.05; compared with MCI group,#P<0.05
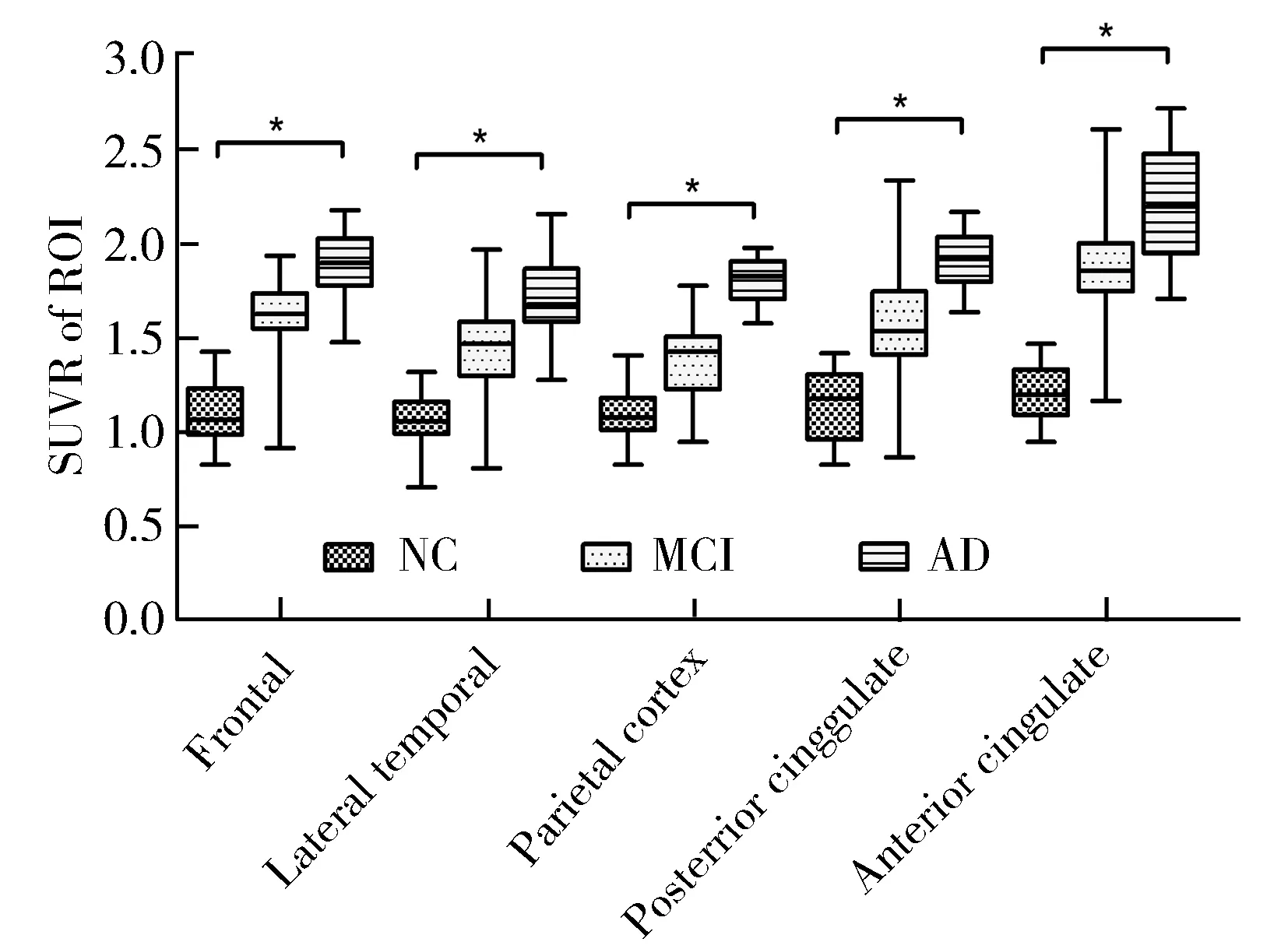
图2 各脑区11C-PIB SUVR水平
NC: normal control; MCI: mild cognitive impairment; AD: Alzheimer′s disease; SUVR: standardized uptake value ratio; ROI: region of interest;11C-PIB: Pittsburg compound-B

表2 血浆Aβ42/Aβ40水平与各脑区11C-PIB SUVR回归分析
Aβ: β-amyloid protein;11C-PIB: Pittsburg compound-B; SUVR: stan-dardized uptake value ratio
3 讨 论
老年斑中Aβ和过磷酸化tau蛋白形成的神经原纤维缠结被认为是AD的主要病理学特征[7]。Aβ是存在于血浆和CSF中的分泌肽,其通过β分泌酶和γ分泌酶两种蛋白酶从前体蛋白中剪切得到。Aβ40和Aβ42是AD患者脑中Aβ的两种主要形式,大部分为含有40个氨基酸的Aβ40,有一小部分是Aβ42,包含42个氨基酸。大量文献报道[8],CSF中的Aβ对于诊断AD非常有效,可作为预测AD发生发展的生物标志物,但由于血浆Aβ水平受年龄、性别、肾功能、肥胖、血小板数量等多种混杂因素的影响,因此,血浆Aβ对于AD的诊断价值还存在争议[9]。
本试验结果显示,NC、MCI和AD组Aβ42/Aβ40 比值逐渐下降,组内比较和组间两两比较差异均有统计学意义(P<0.05),这一结果与课题组先前的研究一致。而NC、MCI和AD组血浆Aβ42、Aβ40蛋白水平差异无统计学意义(P>0.05),但Aβ42组间两两比较AD组显著低于NC组,而Aβ40组间比较无差异,与先前的研究结果(3组血浆Aβ42水平有差异)相矛盾,这可能是由于样本量较少导致,也印证了各种文献中报道的血浆水平不一致的结果。Kim等[10]的研究发现,AD患者血浆Aβ42水平显著降低,Aβ40/Aβ42比值显著高于对照组。血浆Aβ40/Aβ42比值对年龄匹配的对照组的早发性AD患者的判别具有中度有效性。Koyama等[11]通过meta分析也指出,相较个体血浆的Aβ水平,A40/A42比值作为AD的生物标志物更有价值。
11C-PIB是一种与Aβ结合的正电子发射断层扫描放射性示踪剂。脑中Aβ沉积量的增加可能在出现临床症状前的数年至数十年之前发生,因此,检测Aβ的沉积对AD早期诊断具有重要意义。目前已有研究发现,与健康对照组相比,AD患者的皮质区域PIB结合增加[12],MCI患者也已经检测到11C-PIB结合增加,特别是在后来转为AD的MCI患者中[13]。Shi等[14]发现AD组患者11C-PIB标准化摄取比值在下顶叶、颞叶外侧、额叶、后扣带回皮质和楔前叶、枕叶和纹状体均高于正常对照组;其他关于PIB的研究[15]也报道Aβ沉积在前额叶、顶叶和楔前叶摄取增加,表明早期AD中的Aβ沉积在额叶和顶叶皮质中比在海马中多,并且皮质部分PIB沉积的增加与较低的血浆Aβ42和Aβ42/40水平相关[16]。
本文采用小脑为参考区域,通过手动勾画与AD相关各ROIs,计算目标区域与参考区域的SUVR,为目前常用的评价AD的PET图像定量方法之一。此方法较繁琐,且具有一定的主观性,对医师要求较高,需由经验丰富的影像医师进行操作。另一种是基于统计参数映射(statistical parametric mapping, SPM)或FreeSurfer分割[17]的自动化方法,重复性高,但此方法需进行手动排除非特异性摄取区域,并且依赖高质量的MRI扫描图像,有时在分割和配准的过程中可能发生错误。Rosario等[18]通过比较手动和自动ROI评估发现,两者具有较高的一致性(相关系数为0.934~0.999)。本研究发现,血浆Aβ42水平、Aβ42/Aβ40与11C-PIB PET显像SUVR 值呈负相关,血浆Aβ40与11C-PIB PET显像SUVR值呈正相关。MCI和AD患者11C-PIB在额叶、外侧颞叶、顶叶皮层、后扣带回/楔前叶和前扣带回摄取均高于正常组,与文献报道一致[13,14]。回归分析表明,Aβ42/Aβ40 的差异与额叶、外侧颞叶和后扣带回PIB沉积关系密切,而顶叶皮层和前扣带回的PIB沉积与Aβ42/Aβ40比值关系不具有统计学意义。Janelidze等[19]使用18F-flutemetamol进行Aβ的PET显像,结果发现18F-flutemetamol SUVR与较低的血浆Aβ42和Aβ42/Aβ40比率显著相关,同样印证血浆Aβ42和Aβ42/Aβ40比率与Aβ沉积负相关。但此类文献报道也存在着不一致,如Fagan等[20]的研究表明,11C-PIB PET反映的皮质Aβ沉积和CSF Aβ42成反比,但与血浆Aβ水平不相关。
综上所述,AD患者血浆Aβ水平降低,尤其是Aβ42/Aβ40比值与脑内PET PIB沉积增加,二者呈负相关。这种关联性表明,通过血浆Aβ42/40的比例可预测脑Aβ沉积水平。PIB PET沉积和血浆Aβ42/Aβ40比率作为生物标志物具有潜在临床意义。
