外周血MCP-1、α2-MG水平与老年脑梗死病情及颈动脉粥样硬化的关系
2018-10-23吴文波王超牛德旺胡超胜
吴文波,王超,牛德旺,胡超胜
(安阳地区医院神经内科,河南 安阳 455000)
脑梗死的发生可以导致患者病死率的显著上升,增加中枢神经系统功能障碍的发生风险。流行病学研究显示,现阶段临床上脑梗塞的发病率可达233~452/10万人左右,且在具有动脉粥样硬化的人群中,脑梗死的发病率可进一步上升[1,2]。在探讨影响脑梗塞发病因素的过程中可以发现,细胞生物学因子的改变可以通过影响动脉血管内皮细胞的氧化应激损伤,促进血管内皮的脂质沉积,增加脑血管的狭窄风险。单核细胞趋化蛋白1(MCP-1)作为趋化因子家族成员,其可以通过对下游单核细胞或者巨噬细胞的激活作用,促进炎症细胞对于血管内皮的损伤[3,4];血浆 α2 巨球蛋白(α2-MG)作为蛋白酶激活剂,其能够促进体内多种生物活性蛋白酶的激活,加剧炎症因子如IL-6或者IL-10等激活导致的脑血管的痉挛,增加脑梗塞的发生风险[5]。为了进一步探讨相关因子在促进脑梗塞病情进展过程中的作用,本次研究分析我院在2016年1月至2017年7月期间收治的脑梗塞患者,探讨了相关指标的表达及其与患者脑血管病变的关系,报告如下。
1 资料与方法
1.1 研究对象 选取河南安阳地区医院在2016年1月至2017年7月期间收治的、符合纳入标准的老年脑梗死患者(脑梗死组)及健康体检者(对照组)各120例。脑梗死组男性67例,女性53例;年龄 61~85 岁,平均年龄(68.25±7.01)岁。 脑梗死组中进展性脑梗死42例,其中男性29例,女性13例;年龄 62~84 岁,平均年龄(68.31±7.06)岁;非进展性脑梗死78例,其中男性38例,女性40例;年龄 61~85 岁,平均年龄(68.20±6.97)岁;劲动脉内膜中层厚度(IMT)正常19例,IMT增厚15例,斑块86例。入选标准:符合全国第四届脑血管病会议制定的诊断标准;发病在72h以内且症状持续1d以上;我院CT或MRI初次或复查脑梗死灶与其功能定位相对应。对照组男性65例,女性55例;年龄 61~82 岁,平均年龄(68.37±7.15)岁。 排除标准:合并肿瘤者;脑出血者;合并周围血管病变者;脑血管病史者;糖尿病者;心肌梗死者;心绞痛史者;合并上呼吸道感染、肺部感染者;肝肾功能不全者;合并免疫性疾病者。本研究获我院伦理委员会批准;患者及其家属知情同意。
1.2 方法
1.2.1 MCP-1、α2-MG测定方法 采用酶联免疫吸附法测定血清中MCP-1:采集空腹静脉血约5ml并分作两份,一份自然凝固后以3000r/min离心10min,取血清采用酶联免疫吸附法测定血清中MCP-1水平,检测试剂盒购自北京中杉金桥生物有限公司,具体检测步骤严格按照试剂盒说明书进行操作。采用全自动生化法检测α2-MG的表达:另一份置于枸橼酸钠抗凝管内,加入α2-MG检测试剂后,利用胶体金法检测α2-MG水平,试剂盒购自上海奥普生物医药有限公司,具体检测步骤严格按照试剂盒说明书进行。
1.2.2 颈部血管超声检查 采用美国GE公司生产的IU-900系列超声诊断仪器进行诊断,检查者取仰卧位,充分暴露颈部,超声探头频率设置为4.5MHZ-5.5MHZ。检查者头仰向另一侧,探头从颈部根部开始探讨颈动脉主干,并向上移行观察颈动脉膨大以及分支处,典型的动脉外膜、肌层、内膜呈现出明显的两亮一暗的表现,在颈动脉膨大处内1cm以内检测内膜内层至中膜外层的厚度,重复检测两次,取平均值。
1.2.3 进展性脑梗死判定标准 患者入院1w内,根据神经功能缺损程度评分情况,将发病6h~1w的评分与发病6h以内比较,若增加≥1分,则为进展性脑梗死;若增加<1分,则为非进展性脑梗死。
1.2.4 IMT判断标准 IMT正常:颈总动脉IMT<1mm,且颈总动脉分叉处IMT<1.2mm;IMT增厚:颈总动脉IMT在1~1.5mm之间,且颈总动脉分叉处IMT 在 1~1.5mm 之间;斑块:IMT≥1.5mm。
2 结果
2.1 不同IMT患者血清MCP-1、α2-MG结果 不同IMT患者血清MCP-1、α2-MG水平差异具有统计学意义(F=38.55、4.45,P<0.05);组间比较发现:IMT正常与IMT增厚MCP-1、α2-MG水平差异无统计学意义(t=0.13、0.35,P>0.05);斑块组 MCP-1、α2-MG水平均高于IMT正常及IMT增厚,差异具有统计学意义(t=5.32、1.83、3.24、2.06,P<0.05),见表1。
2.2 各组血清 MCP-1、α2-MG结果 各组血清MCP-1、α2-MG水平差异具有统计学意义 (F=255.40、28.00,P<0.01);组间比较发现, 脑梗死组MCP-1、α2-MG水平均高于对照组,差异具有统计学意义 (t=1.33、3.64,P<0.05); 进展性脑梗死组MCP-1、α2-MG水平均高于非进展性脑梗死组,差异具有统计学意义(t=1.52、1.07,P<0.05);非进展性脑梗死组MCP-1、α2-MG水平均高于对照组,差异具有统计学意义(t=3.74、3.28,P<0.05),见表2。
表1 不同IMT患者血清MCP-1、α2-MG结果(±s)
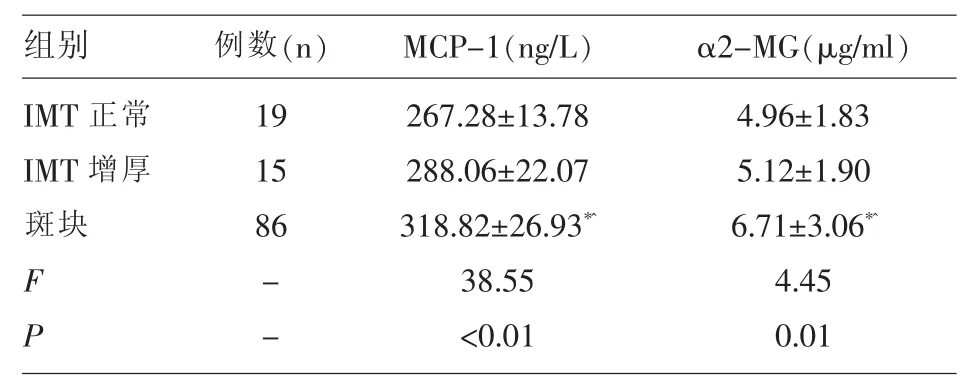
表1 不同IMT患者血清MCP-1、α2-MG结果(±s)
注:与 IMT 正常相比,*P<0.05;与 IMT 增厚相比,^P<0.05。
组别IMT正常IMT增厚斑块4.96±1.83 5.12±1.90 6.71±3.06*^4.45 0.01例数(n) MCP-1(ng/L) α2-MG(μg/ml)19 15 86 F P--267.28±13.78 288.06±22.07 318.82±26.93*^38.55<0.01
表2 各组血清MCP-1、α2-MG结果(±s)

表2 各组血清MCP-1、α2-MG结果(±s)
注:与对照组相比,aP<0.05;与非进展性脑梗死相比,bP<0.05。
组别脑梗死组进展性脑梗死非进展性脑梗死对照组6.22±1.72a 6.63±1.50ab 5.85±1.81a 4.51±1.62 28.00<0.01例数(n) MCP-1(ng/L) α2-MG(μg/ml)120 42 78 120 F P--306.11±31.06a 317.52±29.71ab 299.06±31.92a 216.90±24.03 255.40<0.01
2.3 进展性与非进展性脑梗死超声特点 进展性脑梗死超声IMT正常及强回声斑块检出率与非进展性脑梗死差异无统计学意义 (χ2=1.40、2.07,P>0.05);进展性脑梗死超声IMT增厚检出率低于非进展性脑梗死,差异具有统计学意义(χ2=5.34,P=0.02);进展性脑梗死超声混合回声、低回声斑块检出率高于非进展性脑梗死,差异具有统计学意义(χ2=10.62、6.47,P<0.05),见表 3。

表3 进展性与非进展性脑梗死超声特点[n(%)]
3 讨论
脑梗塞患者病情的的持续性进展,考虑主要与脑血管病变导致的神经元的局部修复障碍、应激反应或者缺血性损伤的发生等有关。长期的临床随访研究发现,脑梗塞的发生,可以导致患者远期脑血管发病几率的明显上升,同时患者的认知、空间定向能力等功能可能会受到明显的影响[6]。一项汇集了145例样本量的重度脑梗塞的临床治疗随访研究发现,其疾病治疗总体有效率较低,不足38%,治疗后的复发率较高,病情缓解率较低[7,8]。而通过对于脑梗塞患者血清学指标的表达研究,能够为揭示脑梗死的发病机制提供基础理论方面的参考,从而为临床治疗或者预后评估提供可靠指标。
MCP-1其表达浓度的上升可以诱导单核细胞或者巨噬细胞等对于损伤神经元细胞的浸润,加剧患者病情的进展,MCP-1可以导致的局部氧化应激障碍,可以导致患者神经元细胞完整性的损害,引起中枢神经递质释放或者传递的异常[9,10];α2-MG能够激活神经肽酶,不仅能够影响神经元间质细胞胶原酶的稳定性,同时还可以在激活体内氧化自由基,降低还原型谷胱甘肽的浓度等方面发挥作用,增加氧化应激损伤或者氧化性电子传递导致的脑组织的损伤[11]。血清学相关水平的研究揭示了MCP-1或者α2-MG在影响到脑梗塞患者神经元损伤或者脑功能衰退中的作用,认为高表达的MPC-1等相关指标能够导致患者NIHSS评分等中枢神经功能的下降,并影响到远期临床脑功能的转归,但缺乏对于相关血清学指标与患者脑血管狭窄病变的关系研究。
本次研究发现,斑块组MCP-1、α2-MG水平均高于IMT正常及IMT增厚,差异具有统计学意义,提示MCP-1、α2-MG二者均可能参与到了脑梗塞患者血管病变过程中,MCP-1、α2-MG的高表达能够通过影响到下列几个方面的因素,进而促进患者脑梗塞病情的进展[12]:⑴MCP-1的高表达,能够通过激活体内的炎症信号通路,促进脂质过氧化损伤,增加泡沫细胞在脑血管血管内皮下层的沉积,促进粥样硬化病情的进展;⑵α2-MG能够通过激活体内的多种金属基质蛋白酶,影响神经元胶质成分的分解代谢,增加血管内皮下胆固醇或者低密度脂蛋白的沉积。何丹等[13,14]研究者在探讨了73例脑梗塞患者的血清学因子谱的改变后发现,MCP-1的阳性表达率可达65%以上,同时在发生了严重的脑血管病变或者脑组织缺血性坏死的人群中,MCP-1等因子的表达率更高。而在脑梗塞病例组患者血清中,MCP-1、α2-MG的表达升高的趋势进一步提示了二者对于脑梗塞病情发生的影响。进展期脑梗塞患者的脑血管损伤程度较高,中枢神经系统的远期并发症较多,而在进展期患者血清中,MCP-1、α2-MG的表达进一步上升,这主要考虑与MCP-1、α2-MG对于缺血再灌注损伤的促进作用,或者对于脑组织神经元细胞膜完整性的破坏等有关[15],但也有研究认为高表达的相关指标对于脑梗塞患者进展期病情的影响,可能主要与其对于患者神经元突触末梢神经元递质的代谢影响具有一定的关系。最后本次研究发现进展性脑梗死超声混合回声、低回声斑块检出率高于非进展性脑梗,这提示在进展期患者脑血管病变中,主要考虑与MCP-1、α2-MG的异常表达对于粥样硬化斑块的形成、斑块面积的增加及脂质斑块的出血或者机化等病理改变的促进作用有关,但并未发现IMT增厚检出率的上升,这主要与本次研究纳入的相关脑梗塞患者其血管病变的不典型及粥样斑块的不稳定有关。
综上所述,脑梗死患者的MCP-1、α2-MG处于高水平状态,再结合颈动脉斑块的结果,对脑梗死的病情程度有一定的提示作用。
