微小RNA-182-5p调控焦亡参与肝缺血再灌注损伤
2018-10-19杜晨阳宋虎王星星王振张建军
杜晨阳,宋虎,王星星,王振,张建军△
肝缺血再灌注损伤(liver ischemia reperfusion injury,LIRI)是肝脏手术和肝移植中常见的病理过程,对患者的预后和生存具有相当大的影响[1]。焦亡(Pyroptosis)是一种促炎性程序性细胞死亡,具有坏死和凋亡的生化和形态学特征,但与凋亡或坏死不同是其主要依赖于半胱天冬酶1(Caspase1)产生炎症级联反应,引起细胞因子释放,激活促炎性免疫细胞介质,最终产生组织细胞损伤[2]。焦亡使组织细胞对缺血再灌注更加敏感,再灌注后损伤加重,在缺血再灌注损伤病理过程中发挥重要作用[3]。微小RNA(miRNA)是长度约为19~22个核苷酸的内源性微小非编码RNA,能够参与多种生物学过程,包括细胞增殖、分化、转移、凋亡和免疫应答[4-5]。miRNA的异常表达可发生于多种疾病,参与多种疾病(包括缺血再灌注损伤)的发病机制[6]。本研究旨在探索miR-182-5p介导叉形头转录因子O亚型3a(FoxO3a)调控的焦亡对肝细胞缺血再灌注损伤的影响。
1 材料与方法
1.1 材料及分组
1.1.1 主要试剂及材料 40只健康雄性SPF级C57小鼠,鼠龄7~8周,体质量20~24 g,购于天津医科大学实验动物中心。小鼠肝细胞系AML12购于中科院上海细胞库。胎牛血清购于美国Gbico公司。CCK-8试剂盒购于日本同仁公司。qRT-PCR试剂盒购于日本TAKARA公司。ELISA检测试剂盒购于德国ORGETEC公司。兔抗鼠FoxO3a、Caspase1、白细胞介素(IL)-1β、IL-18和GAPDH抗体,以及辣根过氧化物酶标记的羊抗兔二抗和FITC荧光标记兔抗小鼠IgG购于美国CST公司。miR-182-5p模拟物(mimic)和抑制物(inhibitor)购于锐博公司。FoxO3a基因的干扰RNA(siRNA)购于美国Sigma公司。
1.1.2 动物模型建立及分组 按随机数字表法将40只小鼠分为5组,每组8只,分别为假手术(sham)组,缺血再灌注(IR)各组(缺血1.5 h,按再灌注时间分为IR 2 h组、IR 6 h组、IR 12 h组和IR 24 h组)。小鼠禁食6~8 h后,使用5%水合氯醛(0.15 mL/20 g)进行腹腔注射麻醉,固定小鼠,经腹正中纵行切口开腹(切口长3~5 cm),暴露腹腔脏器,动脉夹夹闭肝左、中叶脉管(包括门静脉、肝动脉与胆道)的共干,模拟70%的肝脏缺血,1.5 h后松开血管夹,随后进行关腹。Sham组小鼠仅行开腹、游离第一肝门及关腹,不行夹闭血管操作。各组达到预定再灌注时间后获取肝组织标本。
1.1.3 细胞缺氧/复氧模型(缺血再灌注处理)的建立及分组 将AML12细胞接种至6孔板,培养至细胞融合度为70%左右。细胞实验分组分为两部分,(1)缺氧模型建立,分为control组(37℃、5%CO2培养箱中常规培养)和IR组(缺氧1.5 h,复氧6 h)。(2)缺氧/复氧模型建立,分为control组(转染miR-182-5p空载体)、mimic组(转染miR-182-5p模拟物),inhibitor组(转染miR-182-5p抑制物)和inhibitor+siRNA(细胞转染miR-182-5p抑制物的同时转染FoxO3a siRNA以降低FoxO3a表达)。各组转染后置于37℃、5%CO2培养箱中常规培养。12 h后更换新鲜培养基,继续培养48 h后移去培养基,加入2 mL Hank’s培养液,放入模拟缺氧专用培养箱(O2浓度<5%),模拟缺血/缺氧状态。1.5 h后移去Hank’s液,加入2 mL完全培养基,于37℃、5%CO2培养箱中继续培养6 h,模拟再灌注/复氧。
1.2 实验方法
1.2.1 分析miR-182-5p与FoxO3a基因相关性
1.2.2 qRT-PCR检测小鼠肝组织标本和AML12细胞转染后miR-182-5p、FoxO3a和Caspase1的表达 Trizol法提取肝组织或细胞总RNA,根据操作说明反转录为cDNA,miR-182-5p引物上游5'-TGCGGTTTGGCAATGGTAGAAC-3',下游5'-CCAGTGCAGGGTCCGAGGT-3';FoxO3a引物上游5'-CTGGGGGAACCTGTCCTATG-3',下游5'-TCATTCTGAAC⁃GCGCATGAAG-3';Caspase1引物上游 5'-ACACGTCTT⁃GCCCTCATTATCT-3',下 游 5'-ATAACCTTGGGCTT⁃GTCTTTCA-3';GAPDH引物上游5'-CCACCCAGAAGACT⁃GTGGAT-3',下游5'-TTCAGCTCAGGGATGACCTT-3'。经过94℃预变性30 s;94℃变性5 s,60℃退火15 s,72℃延伸10 s,扩增45个循环。对结果使用比较阈值法进行定量分析,其计算方法是:目的基因相对定量值=2-ΔΔCt,ΔCt=Ct目的基因-Ct内参,ΔΔCt=ΔCt实验组-ΔCt对照组,计算各组目的基因相对定量值。
1.2.3 HE染色 取各组肝脏组织左、中叶,放入4%多聚甲醛内固定、梯度乙醇、二甲苯脱水后包埋蜡块,切片后按照操作流程行HE染色,显微镜下观察各组小鼠肝组织的病理学变化。
1.2.4 免疫细胞化学染色 每组经转染和缺血再灌注(IR)处理后的细胞用胰酶消化重悬,接种于24孔板中。37℃、5%CO2培养箱培养48 h后,采用链霉菌抗生物素蛋白-过氧化物酶染色(SP法)检测Caspase1表达分布。室温下4%多聚甲醛处理20 min,3%H2O2阻断内源性过氧化物酶15 min,5%山羊血清封闭1 h,孵育Caspase1一抗(稀释度1∶500)于4℃过夜。室温下孵育二抗1 h。二氨基联苯胺溶液(DAB)显色、苏木精染核后光镜显微镜下观察并采集图像。
1.2.5 细胞免疫荧光染色 将每组经转染和IR处理后的细胞用胰酶消化重悬,铺板制作细胞爬片,4%多聚甲醛固定爬片15 min,0.5%Triton X-100室温通透20 min,5%山羊血清封闭1 h,4℃环境下孵育Caspase1一抗(稀释度1∶500)过夜。室温下孵育荧光二抗(湿盒内)1 h。滴加DAPI避光孵育5 min,对标本进行染核。使用荧光封片剂封片后在荧光显微镜下观察并采集图像。
1.2.6 CCK-8法检测细胞活性 各组处理后的细胞重悬后接种到96孔板中(100 μL/孔),37℃、5%CO2培养箱中预培养,加入CCK-8溶液(10 μL/孔),培养箱内继续培养48 h后用酶标仪测定450 nm处的吸光度。
1.2.7 ELISA检测IL-1β、IL-18浓度 各组细胞消化后超速离心,吸取上清后按照ELISA试剂盒说明书加入试剂进行IL-1β和IL-18浓度的检测。
1.2.8 蛋白免疫印迹实验(Western blot)检测各目的蛋白表达情况 各组细胞或肝组织加入裂解液,于4℃超速离心机离心(12 000 r/min,15 min)后吸取上清,BCA法蛋白定量。每组取50 μg/孔行十二烷基硫酸钠聚丙烯酰胺凝胶电泳后转至PVDF膜,5%脱脂奶粉封闭1 h,孵育一抗(兔抗鼠FoxO3a、Caspase1、IL-1β、IL-18与GAPDH,1∶1 000),4 ℃环境下孵育过夜,TBST洗3遍后室温下孵育羊抗兔辣根过氧化物酶标记二抗(1∶5 000)1 h,等比例加入混合发光液后与PVDF膜反应,曝光并保存图片,使用Image J软件测定条带灰度值。
1.3 统计学方法 采用SPSS 22.0统计软件进行统计学分析处理。计量资料用均数±标准差(±s)表示,其中2组间比较用t检验,多组间比较用单因素方差分析,组间多重比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 缺血再灌注损伤(IRI)诱导小鼠肝脏产生焦亡和炎症 HE染色显示:sham组肝小叶结构基本清晰,肝细胞排列较规整,未见明显的肝细胞坏死和中性粒细胞浸润;与sham组比较,再灌注2 h组肝小叶结构欠清晰,肝细胞排列较整齐,汇管区可见少量的胆管增生及中性粒细胞浸润;再灌注6 h组部分肝小叶结构紊乱,可见小片的肝细胞坏死、中性粒细胞、胆管上皮增生。再灌注12 h组肝小叶结构明显紊乱,可见中央静脉周围大片的肝细胞坏死灶及大量的中性粒细胞浸润;再灌注24 h组肝小叶结构欠清晰,肝细胞排列较为规整,肝窦内可见少量的中性粒细胞浸润;再灌注12 h组小鼠肝组织破坏最严重,见图1A。Western blot结果显示,随再灌注时间延长,FoxO3a、Caspase1和IL-1β表达量较sham组逐渐升高,且在12 h时达峰值,再灌注24 h相对12 h表达降低,差异有统计学意义(P<0.05),见图1B、表1。qRT-PCR从mRNA水平定量检测小鼠肝组织中miR-182-5p表达水平:12 h组miR-182-5p表达量(14.43±0.40)较sham组(6.12±0.41)明显升高(t=14.322,P<0.05),差异有统计学意义。
2.2 IR处理可诱导AML12细胞焦亡 体外培养AML12细胞,分为2组,Control组常规培养,IR组进行细胞缺氧1 h/复氧12 h处理。qRT-PCR检测结果显示:IR组miR-182-5p表达量较Control组升高(P<0.05);而IR组FoxO3a表达量较Control组降低(P<0.05),见图2,表2。免疫荧光检测Caspase1表达情况:IR组Caspase1表达量较Control组升高(P<0.05),见表2。
2.3 miR-182-5p直接调控FoxO3a 基因相关性分析显示,miR-182-5p与FoxO3a基因具有高度相关性,见图3A。qRT-PCR测定转染后细胞内miR-182-5p表达情况:mimic组miR-182-5p mRNA的相对表达量较Control组升高,inhibitor组较mimic组和Control组降低(P<0.05),见表3。免疫细胞化学染色结果显示:mimic组FoxO3a阳性细胞率较Control组降低,inhibitor组FoxO3a阳性细胞率较Control组和mimic组均升高(P<0.05),见图3B,表3。
2.4 FoxO3a通过调节细胞焦亡参与LIRI Western blot结果显示,与Control组相比,inhibitor组的FoxO3a表达升高,Caspase1表达降低(P<0.05);而inhibitor+siRNA组与inhibitor组相比,FoxO3a表达降低,Caspase1表达升高(P<0.05),见图 4、表 4。ELISA检测结果显示,inhibitor组的IL-1β和IL-18浓度较Control组降低;而inhibitor+siRNA组IL-1β和IL-18浓度较inhibitor组升高(P<0.05),见表4。CCK-8检测显示:inhibitor组细胞活性较Control组升高,而inhibitor+SiRNA组较inhibitor组降低(P<0.05),见表4。
Tab.1 The relative expressions of related proteins of liver tissues in five groups of m ice表1 小鼠肝组织中各目的蛋白表达量 (n=5,±s)

Tab.1 The relative expressions of related proteins of liver tissues in five groups of m ice表1 小鼠肝组织中各目的蛋白表达量 (n=5,±s)
*P <0.05,**P<0.01;a与Sham组比较,b与2 h组比较,c与6 h组比较,d与12 h组比较,P<0.05
组别sham组IR 2 h组IR 6 h组IR 12 h组IR 24 h组F FoxO3a 0.715±0.041 0.735±0.029a 0.764±0.022ab 0.816±0.031abc 0.739±0.023abcd 62.361**Caspase1 0.314±0.012 0.548±0.018a 0.532±0.021ab 0.770±0.027abc 0.461±0.014abcd 112.574**IL-1β 0.361±0.014 0.471±0.026a 0.471±0.013ab 0.618±0.016abc 0.557±0.015abcd 12.663**IL-18 0.490±0.023 0.601±0.018a 0.606±0.022ab 0.778±0.019abc 0.829±0.011abcd 13.460**
Tab.2 The expression levels of m iR-182-5p and FoxO3a m RNA of liver tissues by qRT-PCR and the expression of Caspase1 of liver tissues by immunofluorescent staining表2 qRT-PCR检测m iR-182-5p与FoxO3a的mRNA表达情况及免疫荧光检测Caspase1表达情况(n=5,±s)
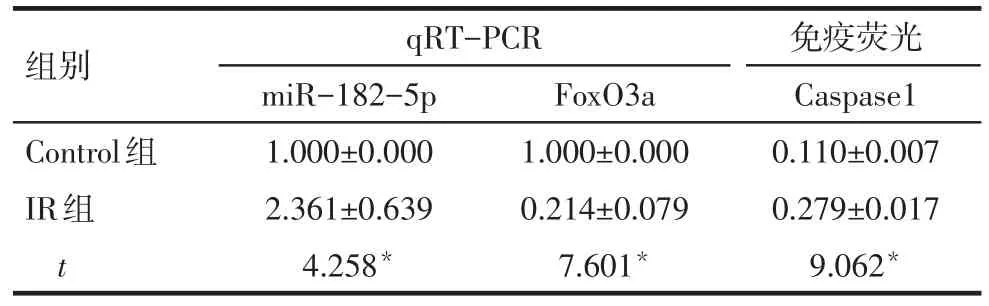
Tab.2 The expression levels of m iR-182-5p and FoxO3a m RNA of liver tissues by qRT-PCR and the expression of Caspase1 of liver tissues by immunofluorescent staining表2 qRT-PCR检测m iR-182-5p与FoxO3a的mRNA表达情况及免疫荧光检测Caspase1表达情况(n=5,±s)
*P<0.05
组别Control组IR组t qRT-PCR miR-182-5p 1.000±0.000 2.361±0.639 4.258*FoxO3a 1.000±0.000 0.214±0.079 7.601*免疫荧光Caspase1 0.110±0.007 0.279±0.017 9.062*
Tab.3 The expression levels of cellular m iR-182-5p m RNA detected by qRT-PCR and the expression of FoxO3a detected by immunohistochem istry staining表3 qRT-PCR检测细胞内m iR-182-5p m RNA表达情况和免疫组化检测FoxO3a表达情况 (n=5,±s)

Tab.3 The expression levels of cellular m iR-182-5p m RNA detected by qRT-PCR and the expression of FoxO3a detected by immunohistochem istry staining表3 qRT-PCR检测细胞内m iR-182-5p m RNA表达情况和免疫组化检测FoxO3a表达情况 (n=5,±s)
*P<0.05;a与Control组比较,b与mimic组比较,P<0.05
组别Control组mimic组inhibitor组F miR-182-5p 1.00±0.00 4.41±0.25a 0.87±0.04ab 3.09*FoxO3a阳性(%)67.1±2.9 32.7±2.6a 87.4±1.4ab 3.86*
3 讨论
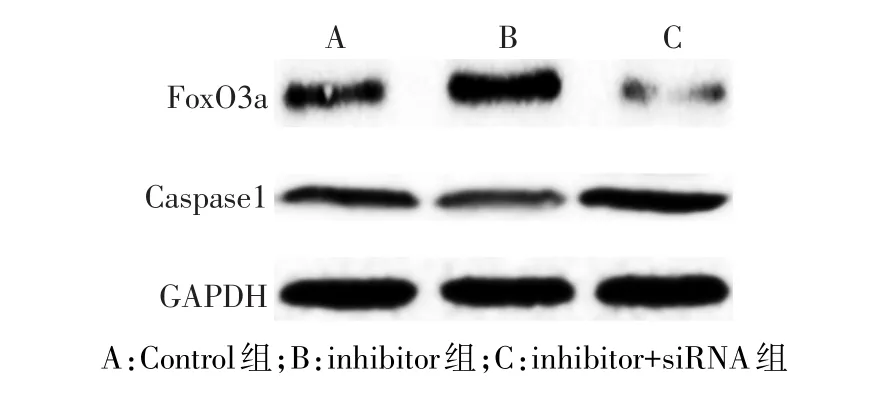
Fig.4 The FoxO3a and Caspase1 expressions detected by Western blot assay图4 Western blot检测FoxO3a和Caspase1表达量
LIRI是肝脏手术、肝移植中重要的病理生理过程。肝脏移植是治疗终末期肝病最有效的办法,为了改善供体器官严重短缺的问题,边缘供体(对IRI高度敏感)越来越多地应用于临床[7-8]。因此,如何研究出针对IRI的保护性策略以更好地保护移植物功能是亟待解决的临床问题。有研究表明,凋亡、坏死是IRI后肝细胞死亡的主要方式[9],笔者在之前的研究中也发现自噬能有效减轻LIRI的损伤效应,发挥保护作用[10-11]。而细胞焦亡是一种独特的程序性细胞死亡,其不同于细胞凋亡、坏死及自噬,能在LIRI中发挥至关重要的作用[12]。本研究表明,焦亡的特征在于IR后caspase-1、IL-1β和IL-18表达增加,同时也伴随着肝组织损伤加重;而体外细胞培养研究表明,IR处理后AML12小鼠肝细胞中caspase-1表达上调。综合这些结果表明,焦亡和炎症反应与LIRI关系密切。
焦亡的特征是快速的胞质膜破裂和促炎因子的释放,并且在形态学和机制上不同于凋亡、坏死等其他形式的细胞死亡[13]。Caspase1依赖性是焦亡的一个显著特征,焦亡的产生归因于Caspase1诱导细胞膜上的孔形成,进而导致大量的炎性因子的产生和释放[14]。Chen等[15]发现脓毒性急性肝损伤过程中,肝细胞焦亡能加重急性肝损伤,通过NLRP3和Caspase-1抑制剂抑制肝细胞焦亡,降低脓毒性肝损伤的程度。Heo等[16]报道了酒精性肝炎(AH)患者和实验动物模型中miR-148a表达显著降低,发现酒精通过FoxO1降低肝细胞中的miR-148a表达,促进TXNIP过表达和NLRP3炎性体激活,进一步诱导肝细胞焦亡。
miRNA已经成为翻译控制的重要媒介,广泛参与多种生物学过程。miRNA的过表达是各种疾病中的常见现象,并且异常表达的miRNA经常参与特定疾病(包括LIRI)的发病机制[17]。Li等[18]报道了过表达miR-17可以通过抑制Stat3表达来上调自噬以加重肝 IRI。Pellegrini等[19]通过研究发现 miR-155通过调节炎症细胞募集和呼吸氧化爆发来加重缺血再灌注损伤,IRI后miR-155的表达显著增加,这与IRI后人类肌肉组织中肿瘤坏死因子(TNF)-α、IL-1β、CD105和Caspase-3的表达增加以及白细胞浸润相关。而Jiang等[20]研究发现miR-146a能够直接抑制IRAK1和TRAF6以减轻缺血再灌注后肝细胞凋亡和多种炎症介质的释放,最终达到减轻肝缺血再灌注损伤的作用。Li等[21]发现miR-30b通过与Atg12特异性结合而与Atg12-Atg5偶联物发生相互作用,miR-30b的过表达能降低Atg12和Atg12-Atg5偶联物水平,促进IR后自噬的产生,减轻LIRI。本研究显示IRI小鼠肝组织和IR处理后的体外培养小鼠肝细胞中miR-182-5p的表达显著增加。通过TargetScan数据库预测显示FoxO3a是miR-182-5p的潜在靶基因。Chen等[22]报道了FoxO3a参与抑制细胞凋亡、促进IR后肝细胞再生。本研究发现敲除FoxO3a后Caspase1、IL-18、IL-1β表达升高,说明FoxO3a能抑制肝细胞焦亡;miR-182-5p过表达导致FoxO3a表达降低,而miR-182-5p的低表达处理后能导致FoxO3a表达升高,进一步减弱AML12细胞的炎性细胞死亡,表明FoxO3a可能是miR-182-5p调控焦亡的靶点,抑制miR-182-5p表达进而促进FoxO3a表达,可能作为预防肝细胞焦亡,减轻肝细胞损伤的有效策略。
Tab.4 Comparison of expressions of related proteins in AML12 cells,concentrations of IL-1β and IL-18 and cell viability detected by ELISA between three groups表4 AM L12细胞中目的蛋白相对表达量、ELISA检测IL-1β和IL-18浓度及细胞活性检测结果比较 (n=5,±s)
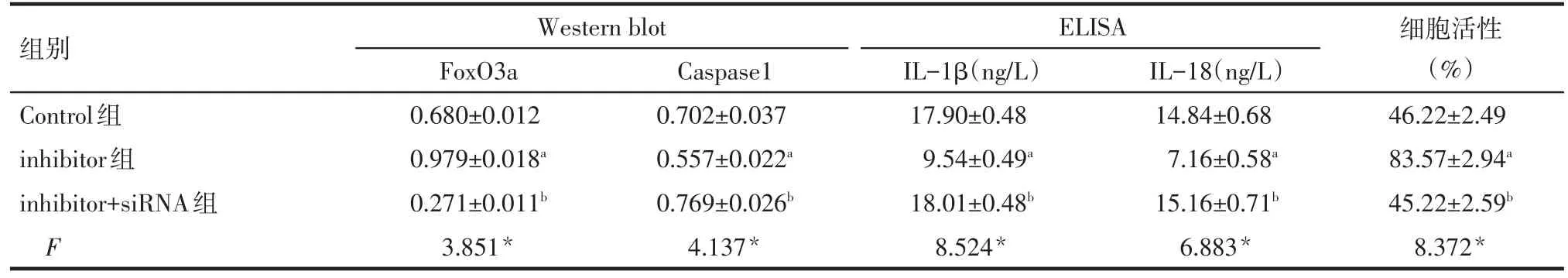
Tab.4 Comparison of expressions of related proteins in AML12 cells,concentrations of IL-1β and IL-18 and cell viability detected by ELISA between three groups表4 AM L12细胞中目的蛋白相对表达量、ELISA检测IL-1β和IL-18浓度及细胞活性检测结果比较 (n=5,±s)
*P<0.05;a与Control组比较,b与inhibitor组比较,P<0.05
组别Control组inhibitor组inhibitor+siRNA组F Western blot FoxO3a 0.680±0.012 0.979±0.018a 0.271±0.011b 3.851*Caspase1 0.702±0.037 0.557±0.022a 0.769±0.026b 4.137*IL-1β(ng/L)17.90±0.48 9.54±0.49a 18.01±0.48b 8.524*ELISA IL-18(ng/L)14.84±0.68 7.16±0.58a 15.16±0.71b 6.883*细胞活性(%)46.22±2.49 83.57±2.94a 45.22±2.59b 8.372*
总的来说,本研究表明由IRI引起的肝细胞焦亡可由miR-182-5p通过直接靶向调控Foxo3a以促进其产生。然而,除了FoxO3a/Caspase1途径之外,miR-182-5p对肝缺血再灌注损伤的影响可能由多种机制介导,并且需要进一步研究以揭示其他相关的重要机制。本研究发现了miR-182-5p在LIRI中的重要作用,有助于理解焦亡在缺血再灌注肝损伤中的作用,同时也为临床工作中减轻肝脏手术和肝移植后LIRI提供了新思路。
(图1~3见插页)
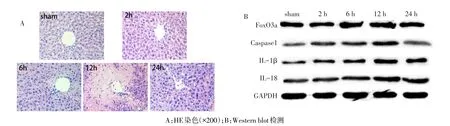
Fig.1 Histopathological changes and expressions of target proteins of mouse liver after IR treatment图1 IR处理后小鼠肝脏组织病理学变化及各目的蛋白表达情况

Fig.2 Changes of Caspase1 expression of liver tissues detected by immunofluorescence assay(IF,×200)图2 免疫荧光检测Caspase1表达变化情况(IF,×200)
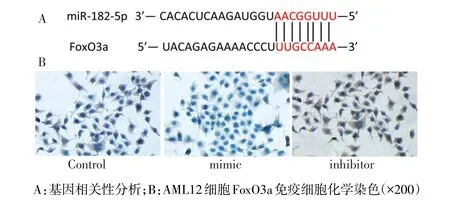
Fig.3 The correlation between miR-182-5p and FoxO3a and the expression of FoxO3a in AML12 cells图3 miR-182-5p与FoxO3a相关性及FoxO3a在AML12细胞中的表达
