抑制呕吐毒素生物合成的乳酸菌的筛选及鉴定
2018-10-17罗炜宋春艳李彦林张蔚鲁心怡曹钰
罗炜,宋春艳,李彦林,张蔚,鲁心怡,曹钰*
1(江南大学,教育部工业生物技术重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
镰刀菌是谷物感染赤霉病的主要病原菌,其在适宜环境下通过侵染麦子穗部从而导致作物死亡,对农业造成巨大的经济损失[1]。此外,镰刀菌还会产生各种真菌毒素,包括玉米赤霉烯酮、伏马毒素,以及多种单端孢霉烯族毒素等[2],其中单端孢霉烯B族化合物呕吐毒素(deoxynivalenol,DON)由于其易溶于水,对各类以谷物为主要原料的食品行业影响巨大,尤其是在啤酒中的大量堆积,会对人体安全产生重大威胁[3]。
为了保障食品安全性,降低谷物污染程度,可以通过抑制产毒真菌生长来实现[4]。目前一般采用化学杀菌剂来达到抑制产毒真菌生长,减少毒素产生的作用,但化学试剂可能对人体和环境产生一定危害[5],利用生物杀菌剂代替化学杀菌剂符合人们安全和环保需求。其中乳酸菌作为生物杀菌剂的典型代表,很早就用于食品防腐杀菌方面,通常乳酸菌都被认为是安全的菌株[6],其产生的代谢产物,包括有机酸[7-8]、蛋白类物质[9-10]等证明能够抑制产毒真菌特别是镰刀菌生长[11],进而降低谷物中DON的产生。研究显示啤酒生产中DON主要由镰刀菌在制麦过程中产生,通过在浸麦开始添加乳酸菌菌液,能够最终降低麦芽中DON质量浓度[12],说明利用乳酸菌降低谷物食品中DON质量浓度是可行的。
本实验通过筛选能够抑制禾谷镰刀菌生长的乳酸菌,并研究其对禾谷镰刀菌DON生物合成的影响,以期为利用乳酸菌降低谷物食品镰刀菌污染方面提供有力支持。
1 材料与方法
1.1 实验材料
1.1.1 菌株
禾谷镰刀菌(Fusariumgraminearum)ACCC36938,购自中国农业微生物菌种保藏中心。
1.1.2 培养基
MRS培养基;PDA培养基;KMnO4-KBr-MRS培养基[13]:在MRS培养基中加入质量浓度2 g/L KMnO4和质量浓度2.5 g/L的KBr;绿豆汤培养基[14]:质量浓度30 g/L绿豆加入蒸馏水中煮沸3 min,过滤定容即可。
1.1.3 试剂和仪器
DON试剂盒购自青岛普瑞邦生物公司;API50CHL试剂盒购自梅里埃公司;DNA提取试剂盒购自上海生工公司;蛋白酶购自江苏锐阳公司;其他试剂购自国药集团。
酶标仪Enspire2300,珀金埃尔默有限公司;BME显微镜,上海徕卡公司。
1.2 实验方法
1.2.1 乳酸菌筛选
将土壤、酸菜等发酵食品样品加入到灭菌的MRS液体培养基中于30 ℃下振荡培养12 h,取其中100 μL液体稀释凃布到含KMnO4-KBr-MRS培养基上,在30 ℃培养箱中培养48 h,选择透明圈较大的单菌落挑起接种到新的MRS平板上纯化2次,然后进行革兰氏染色和过氧化氢酶实验,将革兰氏染色阳性,过氧化氢酶试验阴性且能在KMnO4-KBr-MRS平板上产生较大透明圈的菌株初步认定为乳酸菌,甘油管保藏。
1.2.2 乳酸菌对禾谷镰刀菌抑制作用
1.2.2.1 禾谷镰刀菌孢子制备
将禾谷镰刀菌接种到PDA培养基上, 25 ℃下培养3 d,然后取部分菌丝接种到绿豆汤培养基中,在200 r/min,25 ℃摇床中振荡培养3~5 d至产生大量孢子,血球板计数,用无菌水稀释至105个孢子/mL浓度,备用。
1.2.2.2 抑菌实验
将筛选得到的乳酸菌菌株接种到MRS液体培养基中,在30 ℃下静置培养24 h,用生理盐水将其稀释至浓度为1×109CFU/mL,然后取20 μL乳酸菌菌液点接在MRS平板中心,将其在30 ℃下静置培养2 d,覆盖上50 ℃左右每毫升含104个禾谷镰刀菌孢子的PDA培养基,凝固后在30 ℃下培养3 d,测量抑菌直径,以不加乳酸菌的相同浓度的禾谷镰刀菌孢子培养物做对照。
1.2.3 乳酸菌培养物中抑菌物质特性分析
1.2.3.1 乳酸菌上清液的制备
将活化乳酸菌按5%接入MRS培养基中,30 ℃培养2 d,10 000 r/min离心10 min,上清液用0.22 μm滤膜过滤,备用。
1.2.3.2 热处理对乳酸菌上清液抑菌活性影响
将乳酸菌上清液分别在60、80、100 ℃下处理10 min,然后按1∶9加入到50 ℃左右的PDA培养基中,混匀倒平板,待其凝固后在平板中心滴加20 μL禾谷镰刀菌孢子液,30 ℃培养3 d,测定禾谷镰刀菌生长直径,以无菌水代替上清液做对照,计算各上清液的抑菌率。
抑菌率/%=
1.2.3.3 酶处理对乳酸菌上清液抑菌活性影响
调节乳酸菌上清液的pH值到酸性蛋白酶、中性蛋白酶的胃蛋白酶、胰蛋白酶、过氧化氢酶的最适pH值,按1 mg/mL加入相应酶到乳酸菌上清液中,分别在其最适温度下水浴2 h,处理结束调回原pH值,然后按1∶9加入到50 ℃左右的PDA培养基中,混匀倒平板,待其凝固后在平板中心滴加20 μL禾谷镰刀菌孢子液,30 ℃培养3 d,观察禾谷镰刀菌生长直径,以无菌水代替上清液做对照,计算各上清液的抑菌率(同1.2.3.2)。
1.2.3.4 pH值处理对乳酸菌上清液抑菌活性影响
采用牛津杯法,将乳酸菌上清液浓缩10倍,分别调pH值至5.0、6.0,取200 μL禾谷镰刀菌孢子液涂布到PDA平板上,放置牛津杯,加入200 μL不同pH值的浓缩上清液,以原上清液做对照,30 ℃下培养2 d,记录抑菌直径。
1.2.4 乳酸菌在麦芽汁培养基中生长情况
1.2.4.1 麦芽汁培养基制备
按图1糖化工艺曲线配制麦芽汁培养基,麦芽粉碎度为2,料水比为1∶4,初始按1800 U/g大麦加入中性蛋白酶,糖化结束后煮沸1 h,滤纸过滤,稀释成8%糖浓度,加入质量浓度10 g/L柠檬酸氢二铵,115 ℃下灭菌20 min。

图1 麦芽汁制备的糖化工艺曲线Fig.1 Profile of mashing process for wort preparation
1.2.4.2 乳酸菌在麦芽汁培养基中生理特性研究
将活化乳酸菌菌株按10%接种量接入麦芽汁培养基中,在30 ℃下静置培养,每隔3 h取样测600 nm下吸光值,以空白培养基做对照,同时测定样品总酸,绘制生长曲线和产酸曲线,每组3个平行。
1.2.5 乳酸菌对禾谷镰刀菌生长及DON生物合成的影响
将活化乳酸菌接种到麦芽汁培养基中,在30 ℃下培养18 h,然后各取1、5 、10 、20 mL乳酸菌菌液离心菌体细胞,与4 mL浓度为1×105个孢子/mL的禾谷镰刀菌菌液混合倒入灭菌培养皿中,再加入50 ℃左右的麦芽汁琼脂培养基,混合凝固后在25 ℃下培养5 d,以不加乳酸菌菌体的平板做对照,观察平板禾谷镰刀菌生长情况。
取平板培养物放入离心管中,捣碎并加入5 mL蒸馏水,按1 g培养物加入到5 mL蒸馏水,在摇床中振荡混匀3 h,按DON试剂盒测定滤液的毒素质量浓度。
1.2.6 乳酸菌上清液对禾谷镰刀菌生长及DON生物合成的影响
将活化乳酸菌接入到麦芽汁培养基中,30 ℃下培养18 h,离心后得到上清液,将其在旋转蒸发仪中浓缩16倍,过滤除菌,再分别稀释至原浓度的8倍、4倍、2倍、1倍浓度,取1 mL各浓度上清液与4 mL浓度为1×105个孢子/mL的禾谷镰刀菌菌液混合加入到无菌平板中,再加入50 ℃左右的麦芽汁琼脂培养基,混合凝固后在25 ℃下培养5 d,以不加乳酸菌菌体的平板做对照,观察平板禾谷镰刀菌生长情况。
取平板培养物放入离心管中,捣碎并加入5 mL蒸馏水,按1 g培养物加入到5 mL蒸馏水,在摇床中振荡混匀3 h,按DON试剂盒测定滤液的毒素质量浓度。
1.2.7 乳酸菌细胞对DON吸附作用分析
采用改良的FRANCO方法[15],将活化乳酸菌接入到麦芽汁培养基中,在30 ℃下培养18 h,各取4 mL菌液,一份煮沸使细胞失活,另一份做对照,离心后用PBS缓冲液清洗菌体2次,再用无菌水清洗菌体2次,加入配制的DON标准液(1 500 μg/L),旋涡振荡后在30 ℃培养箱中培养4 h,离心测定上清液中毒素质量浓度。
1.2.8 乳酸菌鉴定
1.2.8.1 乳酸菌生理生化试验
按照梅里埃碳水化合物鉴定试剂条(API50CHL)的说明书进行测试,记录相关结果。
1.2.8.2 乳酸菌分子生物学鉴定
将菌株进行纯培养,使用细菌基因组DNA提取试剂盒提取乳酸菌DNA,然后利用细菌通用引物进行序列扩增,PCR产物经琼脂糖凝胶电泳分析纯化后,送去无锡天霖生物公司测序。将测得序列在NCBI网站上进行Blast比对,选取同源性较高的模式菌株序列,构建发育进化树[16]。
1.2.9 数据处理
2 结果与分析
2.1 乳酸菌筛选
从土壤、酸菜等发酵食品样品中分离得到革兰氏染色阳性、过氧化氢酶试验阴性,且在KMnO4-KBr-MRS培养基中透明圈大于10 mm的菌株58株,初步认定为乳酸菌,编号并甘油管冷冻保藏。
2.2 乳酸菌抑菌实验
大部分乳酸菌对禾谷镰刀菌都表现出一定的抑制效果,表1陈列了抑菌直径大于40 mm的乳酸菌菌株编号,可以看出,A14-2菌株抑制效果最强。
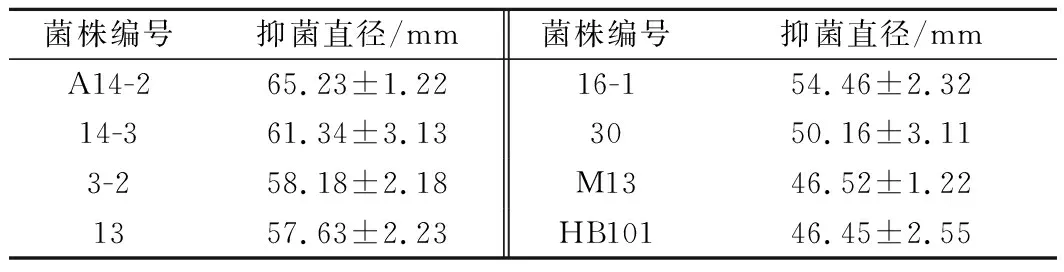
表1 乳酸菌对禾谷镰刀菌的抑制作用Table 1 Inhibitory effect of lactic acid bacteria A14-2 onFusarium graminearum
2.3 乳酸菌培养物的抑菌特性分析
2.3.1 热处理对乳酸菌上清液抑制活性影响
不同温度处理上清液,其对抑菌活性影响如图2所示, 60 ℃水浴处理10 min其抑菌活性相对空白对照组无显著差异,而80 ℃甚至100 ℃处理上清液,其抑菌活性相对空白对照组下降显著,降幅达到26%,说明上清液中存在某种热不稳定性抑菌物质,可能是蛋白类物质。
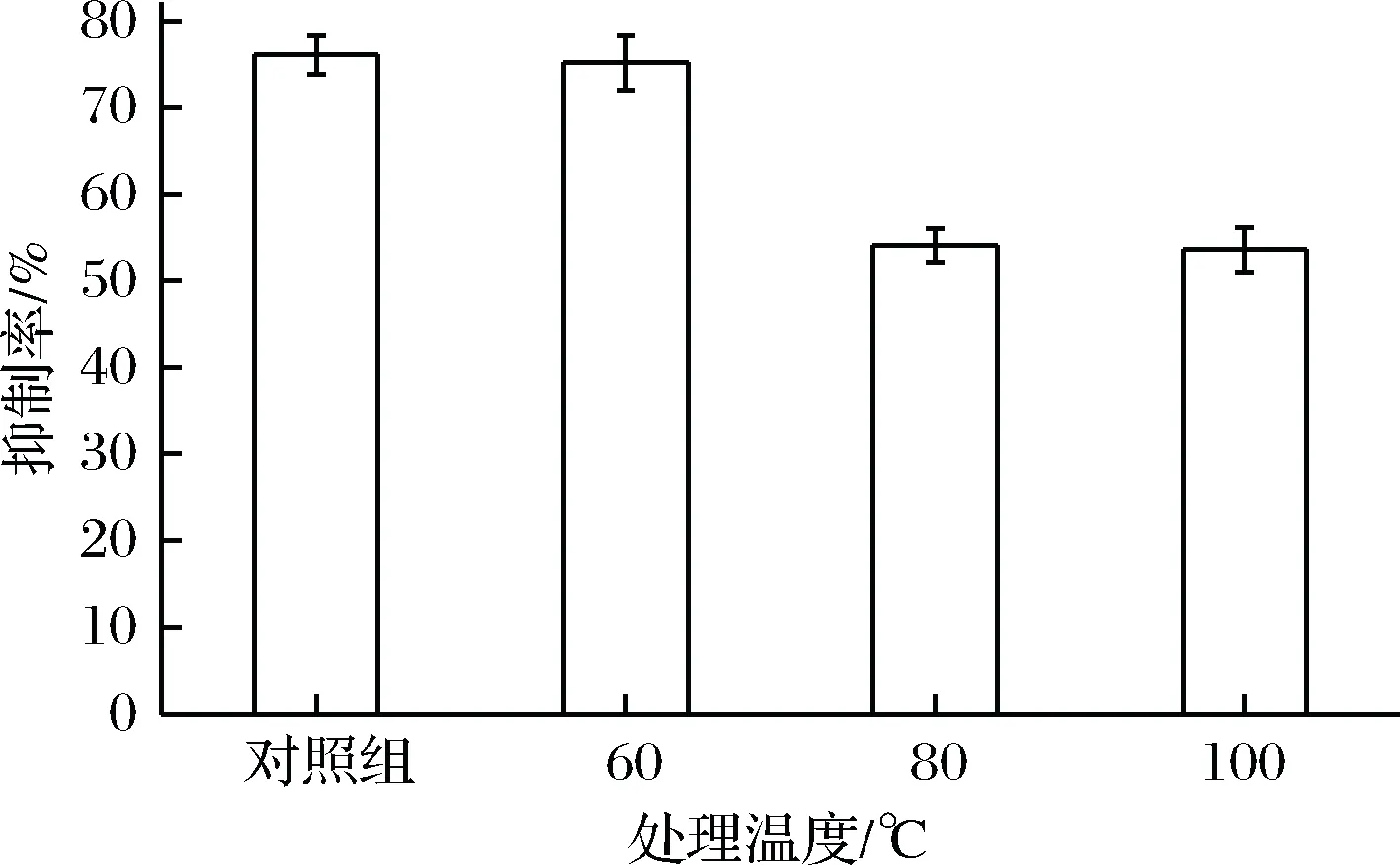
图2 不同处理温度对乳酸菌上清液抑菌活性影响Fig.2 Effect of heat treatments on the antimicrobial activity of cell-free solution
2.3.2 酶处理对乳酸菌上清液抑菌活性影响
上清液经过蛋白酶、过氧化氢酶处理后,对禾谷镰刀菌抑制效果的影响结果如图3所示,乳酸菌上清液经酸性蛋白酶和中性蛋白酶处理,其抑菌率相对空白对照几乎没有发生变化,而经胃蛋白酶、胰蛋白酶处理,其对镰刀菌抑制率从74.8%分别下降到69.1%和70.5%,变化显著(p<0.05),说明上清液中存在某些蛋白类物质对镰刀菌生长具有一定的抑制作用。用过氧化氢酶处理上清液,其抑菌活性变化不明显,所以可以排除过氧化氢的抑菌作用。

图3 不同蛋白酶处理对乳酸菌上清液抑菌活性影响Fig.3 Effect of protease enzyme treatments on the antimi-crobial activity of cell-free solution
2.3.3 pH值处理对乳酸菌上清液抑菌活性影响
结果如表2所示,可以看出,将上清液pH值调至5.0、6.0,其对禾谷镰刀菌抑制效果消失,说明浓缩乳酸菌上清液的抑菌活性受pH值变化影响较大,可能是有机酸类物质。

表2 pH值处理对乳酸菌上清液抑菌活性影响Table 2 Effect of pH treatments on the antimicrobial activity of cell-free supernatant
2.4 麦芽汁培养基中乳酸菌生长及产酸
将活化乳酸菌按10%接种量接入麦芽汁培养基中,30 ℃下培养18 h,测定其600 nm下吸光度、pH值及总酸,以空白培养基做对照,结果见图4。
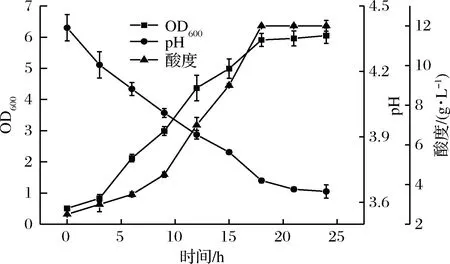
图4 乳酸菌A14-2在麦芽汁培养基中生长特性Fig.4 Growth characteristics of Lactobacillus strain A14-2 in wort-based substrate
从结果可以看出,0~18 h发酵液pH值逐步降低,OD600值和总酸呈直线上升状态,在18 h之后,乳酸菌发酵液OD值增加变得缓慢,酸度不再增加,pH几乎不再变化,说明18 h时乳酸菌生长达到了稳定期。
2.5 乳酸菌抑制禾谷镰刀菌生长及DON的生物合成
将乳酸菌混合禾谷镰刀菌,在麦芽汁培养基中培养5 d后,可以观察到添加乳酸菌的麦芽汁平板中禾谷镰刀菌生长都被完全抑制,测定各平板培养物中呕吐毒素质量浓度,结果如图5所示,可以看出,只添加1 mL乳酸菌菌体,DON抑制率就超过了90%,说明乳酸菌在培养基中不仅能够抑制禾谷镰刀菌生长,也显著降低了其DON的产生。

图5 不同添加量下乳酸菌A14-2对DON生物合成的抑制作用Fig.5 Inhibition of DON production by different amount oflactic acid bacteria
2.6 乳酸菌上清液抑制禾谷镰刀菌生长及DON的生物合成
各培养基禾谷镰刀菌生长情况如图6所示。
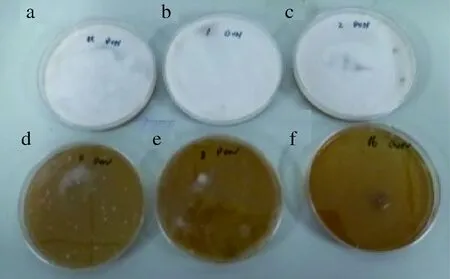
a-空白对照;b-添加1倍浓缩上清液;c-添加2倍浓缩上清液;d-添加4倍浓缩上清液;e-添加8倍浓缩上清液;f-添加16倍浓缩上清液图6 乳酸菌上清液对禾谷镰刀菌生长抑制作用Fig.6 Inhibitory effect of lactic acid bacteria supernatant on Fusarium growth
从图6可以看出,相对空白对照(图6-a),1倍(图6-b)、2倍(图6-c)浓度乳酸菌上清液对禾谷镰刀菌生长未显示出明显的抑制效果,4倍(图6-d)、8倍(图6-e)、16倍(图6-f)浓度乳酸菌上清液则非常显著抑制了禾谷镰刀菌生长,不同浓度乳酸菌上清液对DON产生抑制率测定结果如图7所示,DON抑制率随着乳酸菌上清液浓度的增加变化显著,虽然图7中低浓度的乳酸菌上清液对生长的抑制作用不明显,但对DON生物合成的抑制也已经达到15%~21%,并且上清液浓度越高,其对禾谷镰刀菌DON的生物合成的抑制作用越强,最大可达到91%。

图7 不同浓度乳酸菌上清液对DON生物合成的抑制作用Fig.7 Inhibition of DON production by different concentrations of Lactobacillus supernatant
2.7 乳酸菌菌体细胞对DON吸附作用
从2.5和2.6结果可知,禾谷镰刀菌与1 mL乳酸菌细胞共同培养不仅生长受到显著抑制,其DON生物合成量也被抑制了90%,但与对应的乳酸菌上清液共同培养时,生长受抑制作用非常不明显,其DON生物合成量也仅仅被抑制了15%,2者之间存在差异是否由于乳酸菌细胞本身吸附毒素的作用而导致的,为此进一步进行了菌体细胞对DON吸附作用分析,细胞分别进行非灭活和热灭活处理后加入到DON溶液中,处理后测定上清液中DON质量浓度,结果如表3所示,从结果可以看出,无论灭活与否,乳酸菌A14-2细胞本身并不能够通过吸附作用降低溶液中DON质量浓度。

表3 乳酸菌对DON吸附作用测定结果Table 3 The determination results of LAB bind of DON
2.8 乳酸菌A14-2菌株的鉴定
2.8.1 乳酸菌生理生化鉴定
梅里埃API50CHL试剂盒测定结果如表4所示,根据鉴定结果分析可以初步确定A14-2菌株为植物乳杆菌。

表4 乳酸菌A14-2菌株的API50CHL生理生化反应结果Table 4 Physiological and biochemical reaction of A14-2 strain by API50CHL
注:“-”代表阴性;“+”代表阳性。
2.8.2 乳酸菌分子生物学实验
将乳酸菌菌株A14-2的PCR产物测序并进行同源性比对,构建系统发育进化树结果如图8所示,A14-2和植物乳杆菌NBRC 15891亲缘性更近,结合API50CHL碳水化合物利用情况,可以确定A14-2为植物乳杆菌(Lactobacillusplantarum)。

图8 乳酸菌A14-2的16SrDNA序列系统发育树Fig.8 Polygenetic tree of A14-2 strain based on the complete 16S rDNA sequence
3 讨论
本研究从发酵食品中分离得到1株对禾谷镰刀菌具有高拮抗活性的乳酸菌株A14-2,经生理生化及分子鉴定为植物乳杆菌,对该菌抑菌有效成分分析结果显示,其对热较敏感,对pH值变化异常敏感,但对蛋白酶处理不敏感,说明其抑菌成分主要为有机酸,也包含一些非蛋白类热敏感物质。通过将不同浓度乳酸菌菌体及发酵上清液与禾谷镰刀菌共培养,发现乳酸菌及其上清液能够降低禾谷镰刀菌DON的生物合成,目前很多研究显示乳酸菌菌体可以通过吸附作用降低溶液中DON质量浓度[17-18],但乳杆菌A14-2并不具备这种作用,其主要作用是通过形成具有抑菌作用的代谢产物以及竞争营养物质和形成不利于禾谷镰刀菌生长的环境影响镰刀菌生长和抑制DON的生物合成,但对于已经存在的毒素,并不能通过细胞吸附将其去除。
禾谷镰刀菌是谷物污染的主要病原菌,本实验结果为利用乳酸菌降低谷物食品中呕吐毒素含量提供了理论依据,在之后的研究中,可以进一步将这株植物乳杆菌应用于酿造行业如麦芽制造过程中,从而探究其实际应用的可行性。
