不同发酵剂对发酵羊肉香肠有害生物胺控制及游离脂肪酸释放的影响
2018-10-17王德宝王晓冬康连和梁俊芳纳钦王莉梅张园园
王德宝,王晓冬,康连和,梁俊芳,纳钦,王莉梅,张园园
(内蒙古农牧业科学院,内蒙古 呼和浩特,010031)
发酵香肠是指将绞碎的瘦肉与丁状脂肪及辅料混匀后灌入肠衣,经自然或添加外源发酵剂发酵、干燥成熟制成pH值低于安全酸度5.3一类发酵肉制品[1-2]。低pH值使香肠成品色泽呈现玫瑰红色,风味独特,货架期也相对延长[3-4]。pH值、风味物质、生物胺、游离脂肪酸等变化离不开糖类、蛋白质、脂肪等物质的氧化分解。pH值的变化主要是由乳酸菌对糖类物质分解产生乳酸等小分子有机酸所致,低pH值可抑制香肠中腐败菌和致病菌的生长,也有助促进香肠水分活度(Aw)降低和亚硝酸盐等酶类活性[5-6]。香肠干燥成熟过程为游离脂肪酸释放的关键时期,降低饱和脂肪酸、增加不饱和脂肪酸含量是提高香肠品质关键,且游离脂肪酸又进一步被氧化分解为醇、醛、酮等,是香肠风味物质的主要来源[7-8]。香肠发酵成熟过程中,蛋白质主要被分解为多肽、寡肽以及游离氨基酸,这些小分子物质被称为非蛋白氮,也为香肠风味贡献一定力量;且游离氨基酸在脱羧酶作用下被分解生成生物胺,少量胺类物质有助于机体正常生长发育,若在体内积累过量则会造成毒害作用,并且易与亚硝酸结合成具有强致癌的亚硝胺,因此食品中生物胺也成为近年来重点关注的食品安全问题。因而选择具有降生物胺特性的微生物作为香肠发酵剂,是目前发酵肉制品研究重点方向。本试验选择具有降生物胺特性的清酒乳杆菌与木糖葡萄球菌作为羊肉香肠发酵剂,探究其对发酵羊肉香肠中有害生物胺含量控制及游离脂肪酸释放的影响。
1 材料与方法
1.1 试验材料
1.1.1 主要原辅料
原料肉:羊肉(肥瘦比为1∶4),购于内蒙古呼和浩特市北亚清真食品市场。肠衣:25~30 mm羊小肠。辅料:食盐、抗坏血酸钠。发酵剂:清酒乳杆菌(Lactobacillussake)和木糖葡萄球菌(Staphylococcusxylosus),由内蒙古农业大学食品科学与工程学院微生物保藏实验室提供。
主要药品:蔗糖、葡萄糖、抗坏血酸钠、硝酸钠、亚硝酸钠:分析纯,上海国药集团有限公司;单磺酰氯、组胺、β-苯乙胺、精胺、酪胺、亚精胺、尸胺、1,7-二氨基庚烷、37种游离脂肪酸标准品:色谱级,美国Sigma公司;甲醇、正己烷及丙酮:色谱级,上海安谱实验科技股份有限公司。
主要仪器:F-11 pH计,香港兴万电子仪器有限公司;HD-3A智能水分活度测量仪,上海精密仪器仪表公司;LRH-250-HS恒温恒湿培养箱,天津市福元铭仪器设备有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;1260高效液相色谱仪,美国安捷伦公司;GC2014岛津气相色谱仪,日本岛津公司。
1.2 试验方法
1.2.1 香肠工艺[2]
配方:羊后腿肉80%、羊尾肥膘20%、蔗糖0.5%、食盐2.5%、亚硝酸钠70 mg/kg、硝酸钠100 mg/kg、葡萄糖0.5%、抗坏血酸钠0.05%、发酵剂107CFU/g。
1.2.2 试验设计
在采用预试验、菌株降生物胺特性以及单因素模拟试验基础上,获得发酵剂清酒乳杆菌与木糖葡萄球菌最佳复配比为1∶2。本试验共分3组,第1组为对照组(不加外源发酵剂),第2组为单一清酒乳杆菌(Lactobacillussake)组,第3组为清酒乳杆菌(Lactobacillussake)和木糖葡萄球菌(Staphylococcusxylosus)复配组(1∶2)。分别于灌肠后(4 ℃)、腌制(4 ℃)、发酵结束(25 ℃)、干燥中期(15 ℃)、干燥结束即成熟(13 ℃)、后熟14 d(4 ℃)、28 d(4 ℃)等工艺点测定香肠理化指标。
1.2.3 理化指标测定
1.2.3.1 pH值、Aw、亚硝酸盐残留量的测定[9-10]
参照GB/T 9695.5—2008《肉与肉制品pH测定》、GB 5009.33—2010《食品中亚硝酸盐与硝酸盐的测定》测定香肠pH值、亚硝酸盐;使用HD-3A型智能水分活度仪测定Aw。
1.2.3.2 蛋白质分解指数(PI)测定[11-12]
针对海上风电嵌岩区域的风机基础比选,首先应确定桩型。根据目前国内桩基设计、桩型工程应用、施工水平和施工经验,适宜于海上或潮间带风电场的桩基主要有钢管桩、高强预应力混凝土管桩(PHC桩)和钻(冲)孔灌注桩三类。
参考DIAZ和HUGHES描述的方法,将2 g肉样加到含有18 mL蒸馏水的50 mL离心管中,用组织破碎机均质2 min,然后在5 ℃条件下100 r/min离心15 min,用whatman1# 过滤上清液,重复1次,称量滤液体积 (V)。取15 mL滤液和15 mL 10%TCA混合,在室温下静置30 min,与上述同样条件下离心,用whatman4# 过滤上清液,取5 mL用凯氏定氮的方法测定氮含量N1,通过N0(0.2V×N1)计算非蛋白氮含量,总氮含量为N。蛋白水解指数PI=N0/N。
1.2.3.3 生物胺测定
参照GB/T5009.208—2008测定发酵香肠中生物胺含量[13]。
色谱条件:C18色谱柱(150 mm×4.6 mm,5 μm),流速0.8 mL/min,紫外检测波长254 nm,进样量10 μL,柱温30 ℃,流动相A为甲醇,B为超纯水。
1.2.3.4 脂肪酸测定
脂肪酸提取:称取低温下粉碎样品10 g于250 mL三角瓶,加入135 mL Folch液(三氯甲烷∶色普级甲醇=2∶1),振摇3 h后浸泡8 h用G3漏斗过滤,移取5 mL、质量浓度200 g/L NaCl溶液于滤液中。待静置分层吸取下层,在下层液体中加入适量无水Na2SO4脱水。一段时间后将液体吸入旋转蒸发瓶,40 ℃水浴条件下浓缩即得脂肪。加入0.5 mol/L NaOH/ CH3OH溶液5 mL,70 ℃下回流5 min。加入5 mL三氟化硼-乙醚和甲醇混合液(1∶3),70 ℃下回流2 min,进行甲酯化。再加3 mL正己烷,70 ℃下回流1 min。接着加入5 mL饱和NaCl溶液,静置10 min,移取1 mL上层液体于1.5 mL离心管中,放入-80 ℃冰箱中待测。
气相色谱条件:升温程序:初温为120 ℃,保持5 min,然后以4 ℃/min的速率升至250 ℃,250 ℃保持28 min;进样口温度250 ℃,检测器温度280 ℃;载气为高纯氮气(99.99%),氢气流速为40 mL/min,恒定柱流速为1.1 mL/min,分流比20∶1;进样量1.0 μL。
1.3 数据处理
采用Excel和Spss19.0对数据进行统计处理和显著性分析,p<0.05表示差异显著,同组不同制作时间差异性用小写字母表示,同一时间不同组间差异用大写字母表示,相同字母表示不显著。
2 结果与分析
2.1 不同发酵剂对羊肉香肠pH值影响
发酵香肠pH值下降主要源于原料肉中微生物与发酵剂分解糖类生成乳酸等有机酸所致,促使香肠pH值迅速降至发酵要求5.3以下;随着蛋白质被组织蛋白酶及发酵剂分解产生氨类等碱性物质的增加,由于酸碱中和,促使pH值逐渐回升[14-15]。
如图1,发酵香肠在0~0.5 d腌制期,由于环境温度(4 ℃)较低致使原料肉中微生物生命活动被抑制,pH值变化甚微;灌肠后香肠在25 ℃、90%~95% RH条件下发酵,发酵过程中3组pH值快速下降;发酵结束时(3 d),对照组pH值(5.25)>单一组(5.02)>复配组(4.85)(p<0.05),由此可知添加复配发酵剂产酸速率>单一发酵剂>对照组;3~6 d干燥过程环境温度和湿度(RH)急剧下降到15 ℃、85%,随着产酸速率下降及蛋白可能被分解所产生的碱性物质含量增加[16],促使pH值呈现回升趋势;6~9 d成熟过程降低的温度和湿度,致使大部分微生物生命活动被抑制,酶活性也受到影响,因而氨类物质产生速率下降,pH值上升速率也变缓,发酵结束时3组pH分别为5.73、5.66、5.60;成品在4 ℃、贮藏2周情况下,与成熟期结束时pH值差异不显著(p<0.05)。
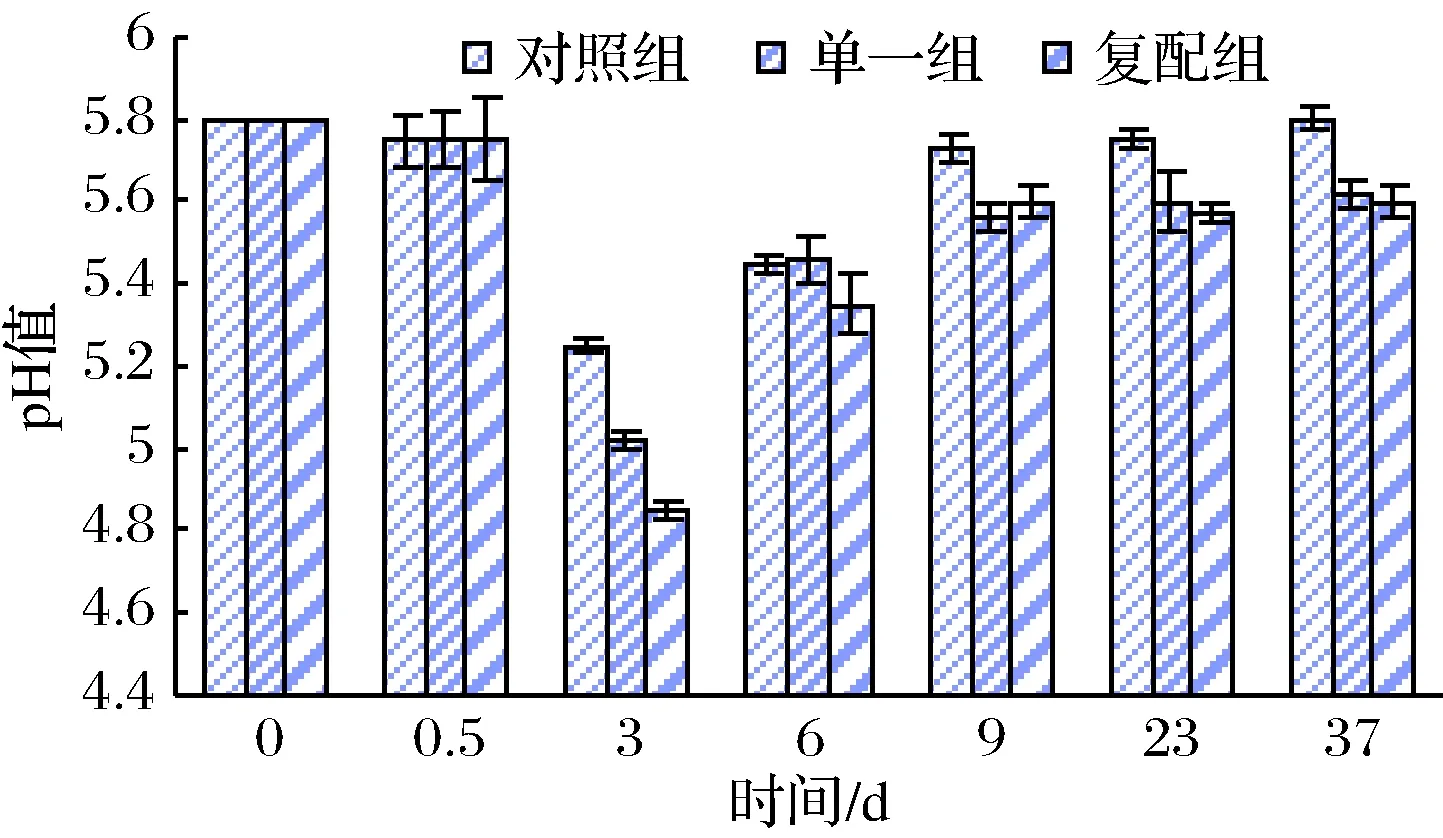
图1 不同发酵剂对发酵香肠pH值变化规律的影响Fig.1 Effects of different starter cultures on the pH change of fermented sausages
2.2 不同发酵剂对羊肉香肠A w影响
水分活度(Aw)已经成为衡量食品保藏期长短的一个重要指标,当Aw小于某个临界值时,特定微生物生长活性将被抑制,如绝大多数细菌要求Aw大于0.9、霉菌要求Aw大于0.8,而耐盐菌要求最低Aw为0.75,当Aw低于0.6时绝大多数微生物无法生长;并当食品中Aw<0.85时,酶活性大幅下降[17-18]。
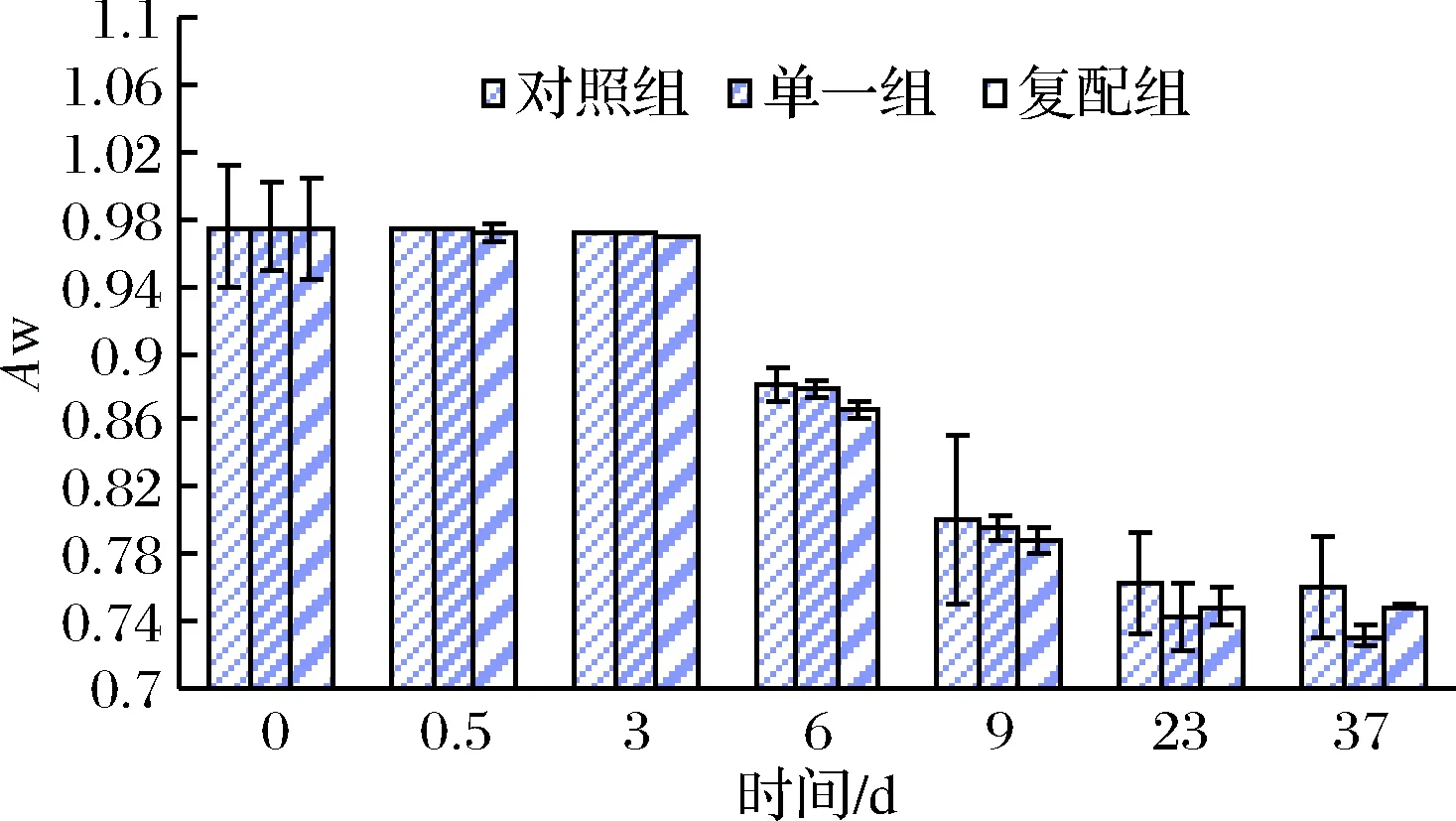
图2 不同发酵剂对发酵香肠Aw变化规律的影响Fig.2 Effects of different starter cultures on the Aw change of fermented sausages
由图2可知,0~3 d 3组香肠Aw变化微小,均在0.98±0.01范围内;3~6 d干燥期,因香肠内外RH差,促使水分逐渐向外部环境扩散,干燥初期结束时对照组、单一组、复配组Aw分别降低到0.91、0.90、0.90,下降幅度复配组>单一组>对照组,说明添加混合发酵剂可能较单一发酵剂和自然发酵更有助于Aw下降,此结论与吴满刚等研究相似[19];6~9 d成熟过程3组香肠Aw相比干燥过程下降幅度小,可能由于香肠肉馅外层水分扩散速率快于内层,导致外层较为干燥,限制了肉馅中心水分散发速率;在9~37 d,Aw下降缓慢,37 d末对照组和单一组均在0.83±0.01、复配组降到组中最低0.82。
2.3 不同发酵剂对羊肉香肠中亚硝酸盐影响
亚硝酸盐具有发色、抗氧化及防腐作用,可消除原料肉不适风味,提高产品质量[20]。但其残留过量会与香肠中仲胺、生物胺生成具有强致癌作用的亚硝胺,是目前食品界备受关注的食品安全问题[21]。
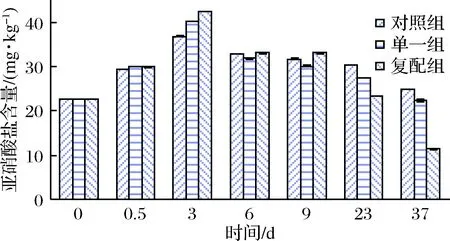
图3 不同发酵剂对低酸发酵香肠亚硝酸盐变化的影响Fig.3 Effects of different starter culture on nitrite changes of low acid fermented sausages
由图3可知,腌制初期硝酸盐添加可能成为后期各组亚硝酸盐含量增加主要源头;发酵结束,对照组、单一组及复配组亚硝酸盐含量(36.80、40.20、42.50 mg/kg)均有所增加,相比腌制结束,复配组亚硝酸盐增加速率显著快于单一组(p<0.05),与含量最低对照组差异显著(p<0.05),这一现象可能是由于复合发酵剂产生硝酸盐还原酶含量高于其他2组,加速硝酸盐被还原;干燥期间环境温度、RH、Aw下降,硝酸盐还原酶活性可能被抑制或发酵剂对亚硝酸盐分解速率加快,促使亚硝酸盐含量急剧下降[22];6~9 d变化不显著;在9~37 d复配组亚硝酸盐含量急剧降低,37 d末降到组中最低11.30 mg/kg,低于国家安全规定30 mg/kg[23]。
2.4 不同发酵剂对羊肉香肠PI影响
蛋白质分解指数(PI)在香肠制作过程中呈逐渐上升趋势,曲线变化轨迹表明蛋白质在干燥成熟过程降解程度较高。原料肉PI为26.74%,腌制期间仅复配组PI上升;发酵结束,对照组、单一组、复配组PI为27.80%、28.13%、28.37%;干燥过程各组pH值上升促使蛋白分解酶活性逐渐增强,6 d末复配组PI上升至30.67%,显著高于其他2组(p<0.05);9 d末复配组、单一组PI为31.00%、29.83%,而对照组也上升至29.00%,说明蛋白质分解主要依赖内源酶;9~23 d的成品贮藏2周过程中非蛋白氮成分含量近下降2%左右,但在23~37 d贮藏过程中各组PI快速升高,37 d末PI与发酵结束时趋于相近。
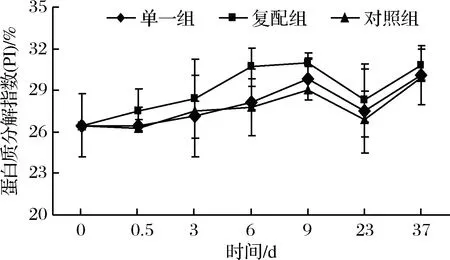
图4 不同发酵剂对发酵香肠蛋白质分解指数(PI)的影响Fig.4 Effects of different starter culture on protein discomposition index of fermented sausages
2.6 不同发酵剂对羊肉香肠中生物胺变化影响
本试验采用新鲜无污染原料肉进行发酵香肠制作试验,目的是降低原料肉卫生质量对生物胺积累的影响,并添加降生物胺发酵剂旨在减少有害生物胺在发酵香肠中检出率。精胺和亚精胺在整个过程含量变化微小,且无毒害作用,因此本试验仅测出3种有害生物胺—腐胺、酪胺及组胺。由表1所列3种生物胺变化规律可知,3组香肠中腐胺和酪胺在发酵、成熟(0.5~9 d)过程中含量增加较为显著,9~37 d贮藏过程中含量则呈下降趋势;通过组间比较可知,复配组腐胺含量增加速率缓慢,9~37 d酪胺含量下降速率显著快于其他2组(p<0.05);且酪胺仅在干燥成熟过程中检出,复配组含量显著低于对照和单一组(p<0.05)。综观3组香肠中3种胺总量变化,可知对照组和单一组显著高于复配组(p<0.05),说明添加复合发酵剂可有效降低有害生物胺在发酵香肠中的积累。
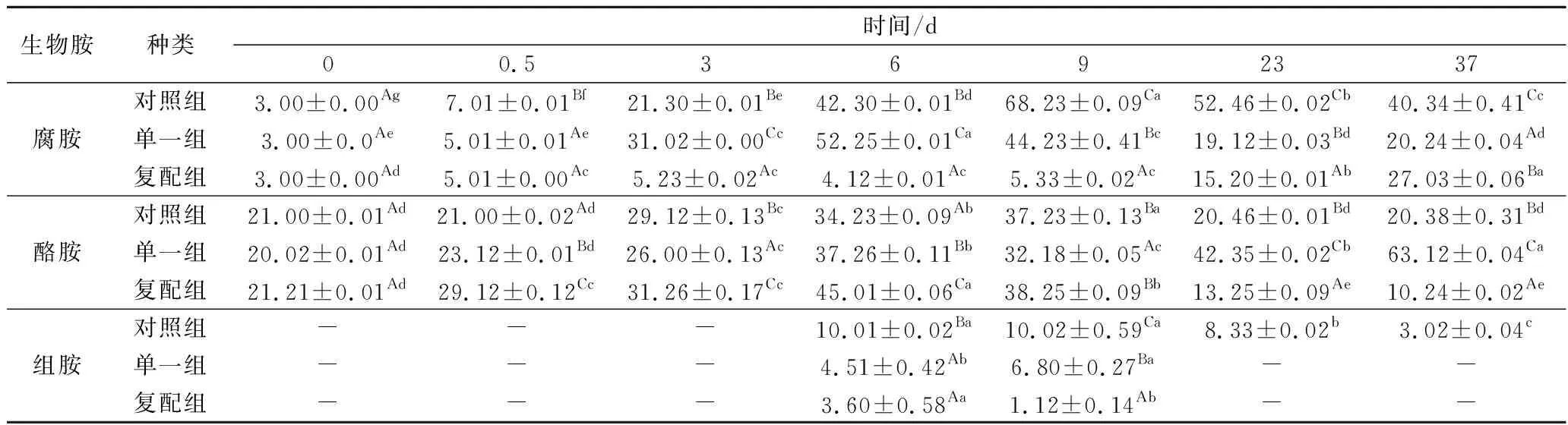
表1 不同发酵剂对发酵香肠中有害生物胺变化规律的影响Table 1 Effects of different starter cultures on changes of biogenic animes in fermented mutton sausages
注:同一行(列)相同小(大写)写字母表示差异不显著,p>0.05;不同则表示差异显著,p<0.05,“—”表示无检出。
2.5 不同发酵剂对羊肉香肠中游离脂肪酸影响
香肠中游离脂肪酸的形成受到加工工艺温度、发酵pH值、湿度等条件影响。所添加发酵剂具有分解生成有机酸、脂肪酸等酶系,可生成有机酸降低肉制品pH值,同时与内源脂酶可将产品中脂肪分解为短链挥发性脂肪酸、醛、酯等赋予发酵肉制品特有风味[24],还可促进饱和脂肪降解、加速单不饱和脂肪酸和多不饱和脂肪酸的释放[25]。
图5表明,发酵过程中对照组饱和脂肪酸(SFA)含量增加速率>单一组>复配组,3组SFA由原料肉中15.26 mg/kg左右分别增至发酵结束时24.97、21.40、16.13 mg/kg,可能添加的清酒乳杆菌和木糖葡萄球菌发酵剂在发酵期间大量繁殖促使饱和脂肪酸转化或分解[26],导致发酵剂组SFA含量增加速率较为缓慢;在3~9 d干燥成熟过程各组SFA含量均下降,9 d末复配组含量显著低于其他2组(p<0.05);成品贮藏期间SFA含量整体有所下降。
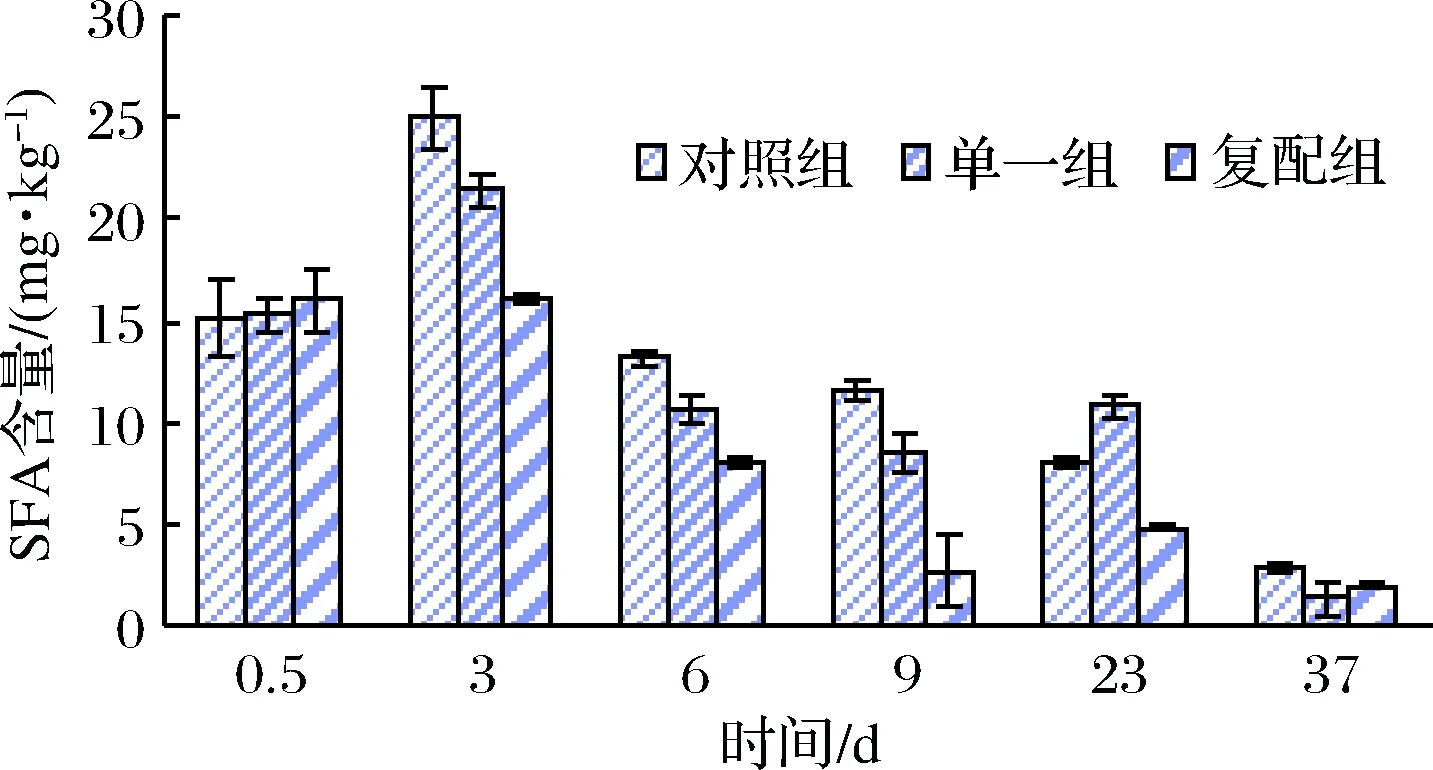
图5 不同发酵剂对发酵羊肉香肠SFA含量的影响Fig.5 Effects of different starter cultures on the SFA in the fermented mutton sausages
图6表明,发酵剂组单不饱和脂肪酸(MUFA)含量在制作过程一直呈上升趋势,而对照组则在贮藏期含量呈下降趋势。对照组MUFA含量9 d末达到最高(52.77 mg/kg),显著高于此时单一组33.60mg/kg和复配组31.60 mg/kg;通过比较3组MUFA含量变化,可知在0~23 d对照组含量一直高于单一组和复配组,而单一组与复配组MUFA含量差异不显著(p>0.05),可能是由于内源脂肪酶对MUFA的释放起到主要作用,这一结果与沈清武研究相一致[25]。
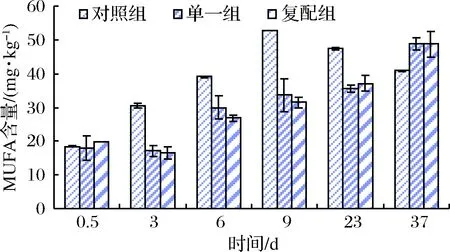
图6 不同发酵剂对发酵羊肉香肠中MUFA含量的影响Fig.6 Effects of different starter cultures on the MUFA in the fermented mutton sausages
由图7可知,在干燥结束前,多不饱和脂肪酸(PUFA)释放速率:对照组>复配组>单一组,说明香肠在干燥前期内源酶对PUFA释放起主要作用;成熟及贮藏过程,复配组PUFA释放速率显著快于其他2组(p<0.05),说明木糖葡萄球菌对脂肪水解主要发生在香肠成熟过程。综观图6和图7可知,MUFA释放速率及累积量>PUFA。通过图5、6和7可知,复配组香肠在成熟后期:MUFA含量>PUFA>SFA;单一组与对照组:MUFA含量> SFA> PUFA。说明,添加清酒乳杆菌和木糖葡萄球菌复合发酵剂有助于羊肉香肠中不饱和脂肪酸积累和SFA降解。
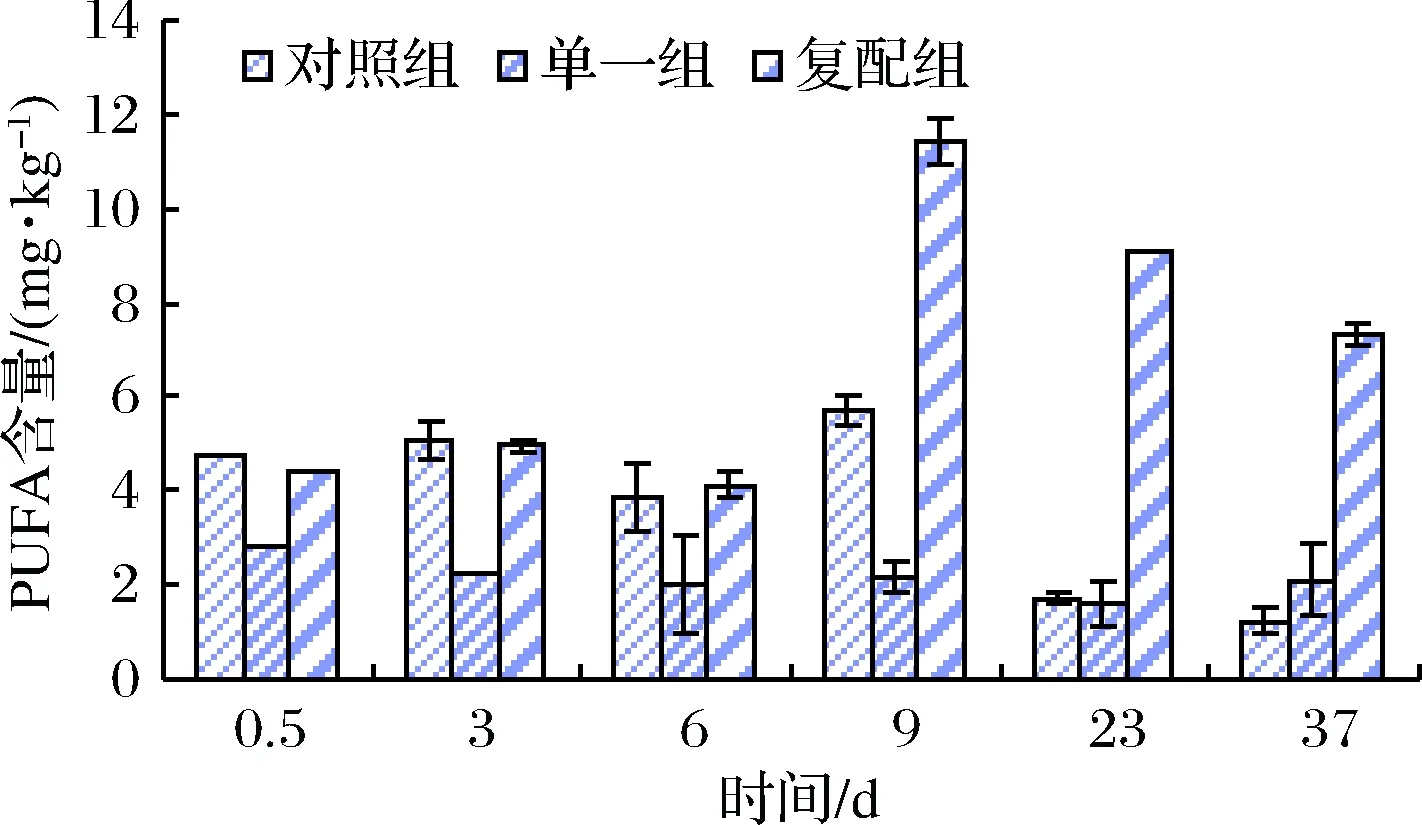
图7 不同发酵剂对发酵羊肉香肠中PUFA含量的影响Fig.7 Effects of different starter cultures on the PUFA in the fermented mutton sausages
3 讨论
本试验共为3组,即对照组、单一发酵剂组和复配发酵剂组。对照组与发酵剂组区别在于是否添加外源发酵剂,通过这一设计目的是探究发酵剂对发酵羊肉香肠中有害生物胺含量控制及游离脂肪酸释放的影响。微生物在适宜条件下分解碳水化合物快速产酸,1.5 d发酵结束,复配组pH值显著低于单一组和对照组(p<0.05),说明添加复配发酵剂有利于缩短香肠发酵周期。随着香肠pH值降低,致使蛋白质束缚水分能力下降,发酵剂组Aw下降速率快于对照组;可能由于香肠肉馅表层水分扩散速率高于内层,导致表层较为干燥,限制了中心水分向外层迁移速率,使香肠干燥成熟后期Aw下降速率较为缓慢。pH、Aw下降也抑制硝酸盐还原酶活性,在9~37 d复合发酵剂促使复配组亚硝酸盐含量急剧降低,使得复配组亚硝酸盐残留量远低于国家规定30 mg/kg。
通过探究内源酶和微生物发酵剂对蛋白质分解指数(PI)、有害生物胺含量控制和游离脂肪酸释放影响可知:3组PI在0.5~9 d呈现上升趋势,此过程内源蛋白酶与发酵剂蛋白酶系共同作用蛋白质分解。9 d末复配组腐胺、组胺含量远低于其他2组(p<0.05),酪胺在9~37 d急剧下降,37 d末含量显著低于对照和单一组(p<0.05)。在3~37 d,复配组SFA含量<对照组,说明添加清酒乳杆菌与木糖葡萄球菌复配发酵剂可有效降低香肠中SFA含量;0~37 d发酵剂组MUFA含量逐渐上升,0~23 d对照组含量高于单一组和复配组,说明原料肉中内源脂酶对MUFA贡献高于清酒乳杆菌和木糖葡糖球菌;6~9 d复配组PUFA含量高于其他2组,说明复合发酵剂此时有利于促进PUFA生成。
4 结论
综上可知,添加复配发酵剂不但有利于缩短香肠发酵周期、快速降低水分含量,更有助于抑制和降低香肠中亚硝酸盐及有害生物胺含量,也有助于香肠不饱和脂肪酸释放和饱和脂肪酸的降解。从而利用复合发酵剂有利于提高发酵香肠营养品质和安全性。
