一株产细菌素乳酸菌的筛选及其细菌素特性研究
2018-10-17孙杰姜杰冯彬斌孔令民汪钊魏春
孙杰,姜杰,冯彬斌,孔令民,汪钊,魏春
(浙江工业大学 生物工程学院,浙江 杭州, 310014)
细菌素是由某些细菌在发酵过程中通过核糖体合成产生的一类有抑(杀)菌活性的蛋白或多肽类物质[1]。细菌素的抑菌活性主要针对革兰氏阳性菌和一些亲缘关系相近的菌种,而对革兰氏阴性菌、真菌等抗菌活性很弱或者无效。细菌素由于具有天然、无公害、无残留、热稳定性好、不易产生耐药性等优点,逐渐成为微生物防腐剂研究领域中的热点,并且被认为是“抗生素的理想替代品”。
乳酸菌是公认的具有潜在开发价值的天然生物防腐剂[2],大多数乳酸菌会在生长过程中向外部环境中释放具有抑菌活性的细菌素。因此乳酸菌广泛应用于医药、食品以及饲料的防腐。乳酸菌细菌素的理化性质与其结构密切相关。乳酸菌细菌素一般为阳离子小肽并且具有较强的疏水性和较高的等电点。目前认为细菌素主要的作用机制为作用于细胞膜从而达到抑菌目的[3]。除了作用于细胞膜之外,细菌素还可以作用于细胞壁、抑制核苷酸合成、抑制蛋白质折叠或作用于线粒体[4-9]。
乳酸链球菌素(Nisin)已经作为一种公认安全、无毒的天然食品防腐剂,被广泛应用于牛奶、罐头、肉制品等。本研究从传统发酵食品中筛选产细菌素稳定性和抑菌效果较强的乳酸菌菌株。对细菌素进行分离纯化,以及生物学性质的探究,为其作为添加剂,以抑制食品或饲料中的腐败菌或致病菌提供支持。
1 材料和方法
1.1 材料
浙江地区米酒、内蒙古地区酸粥。大肠杆菌(ATCC 25922)、枯草芽孢杆菌(CCTCC AB130001)、地衣芽孢杆菌(CCTCC AB205131)、发酵乳杆菌( CCTCC AB2013124)、金黄色葡萄球菌(ATCC 25923)、酿酒酵母(ATCC 9080)、白色假丝酵母(ATCC 10231)和米曲霉(CCTCC AF91012)均为实验室保存菌株。
1.2 主要试剂盒与培养基
MRS培养基,购于OXOID 公司。MRS固体培养基加入2%的琼脂。
改进的MRS培养基(g/L):葡萄糖40、酵母粉30、乙酸钠10、柠檬酸氢二铵5、磷酸氢二钾2、硫酸锰0.25。
LB培养基(g/L):酵母粉5、蛋白胨10、NaCl 5L,pH 7.0~7.5,121℃ 20 min 高压蒸汽灭菌,备用。固体培养基则加入2%的琼脂粉。
YPD培养基(g/L):葡萄糖20、蛋白胨20、酵母粉10,pH自然,115℃ 30 min高压蒸汽灭菌,备用。固体培养基则加入2%的琼脂粉。
基因组提取试剂盒和Taq酶为宝生物公司产品。其余试剂为国产分析纯。
1.3 方法
1.3.1 样品中乳酸菌的分离与初筛
将酸粥和米酒上清液用0.9%的生理盐水梯度稀释,吸取100 μL涂布到MRS固体培养基上,30 ℃培养48 h。用无菌接种环挑取具有不同菌落形态的单菌落接种于MRS液体培养基,30 ℃培养24 h。菌液8 000 r/min离心10 min取上清液,0.22 μm的微孔滤膜过滤后进行抑菌活性分析。
1.3.2 琼脂扩散法测定抑菌活性。
大肠杆菌(ATCC 25922)作为指示菌株,接种于LB培养基,37 ℃、200 r/min培养过夜。用0.9%的生理盐水稀释大肠杆菌菌液至OD600值为1,取稀释后的菌液1 mL加入到冷却至50~60 ℃的100 mL固体LB培养基中混匀,倒平板。平板冷却后用直径10 mm打孔器均匀打孔。吸取待测样品100 μL加入到孔洞中,37 ℃培养15 h,测量抑菌圈直径并记录(抑菌圈直径=测量直径-打孔器直径)。挑选抑菌活性较强的菌株进行下一步实验。
1.3.3 抑菌物质的初步鉴定
1.3.3.1 有机酸排除试验
由于细菌素一般在酸性条件下抑菌活性强,在中性及碱性条件下抑菌活性较弱或失活,故本实验不调发酵液的pH值,而是配制与发酵液上清液具有相同pH值的乳酸和乙酸溶液,并检测有机酸溶液的抑菌活性。
1.3.3.2 过氧化氢排除试验
记录抑菌效果较好并预处理好的发酵液上清液的pH值,然后将发酵液调pH值为7.0,加入过氧化氢酶使其终浓度为4.5 g/L,37 ℃温浴1 h后将pH值调至与原发酵液相同,检测其抑菌活性。
1.3.4 具有较强抗菌性能细菌素的稳定性对比
为观察温度稳定性,将发酵上清液,分别在60、80、100、121 ℃恒温处理30 min,并以未经热处理的发酵液上清为对照进行抑菌活性分析。为研究pH值稳定性,用1 mol/L的NaOH和1 mol/L的HCl将发酵上清液pH值调为2、4、6、8、10,在30 ℃静置后90 min调回初始pH值,以未调pH值的上清液为对照进行抑菌活性分析。为研究酶解稳定性,将处理好的发酵液上清液pH值调至木瓜蛋白酶、胃蛋白酶、胰蛋白酶、蛋白酶K、糜蛋白酶的最适pH值,在各酶的最适温度下处理90 min(各种蛋白酶的终浓度为1 mg/mL)。将处理好的酶解液调至发酵液的初始pH值,测定其抑菌活性。
1.3.5 菌株鉴定
1.3.5.1 生理生化鉴定实验
参照凌代文和东秀珠的方法[10],采用形态观察和过氧化氢酶实验、糖发酵实验、吲哚实验、硝酸盐还原实验等常规生理生化检测方法对实验菌株进行下一步鉴定。
1.3.5.2 菌株16S rDNA鉴定
用Takara细菌基因组DNA提取试剂盒提取基因组,PCR扩增16S rDNA片段,扩增引物为:
上游引物:5’-CAGAGTTTGATCCTGGCT-3’;下游引物:5’-AGGAGGTGATCCAGCCGCA-3’
PCR反应程序为98 ℃变性2 min;98 ℃ 10 s,55 ℃退火15 s,72 ℃延伸1.5 min,32个循环。
PCR产物由北京擎科新业生物技术有限公司进行测序。
根据16S rDNA序列结果通过Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性对比,利用MEGA 6.0软件中的Phylogeny中的Construct/Test Neighbor-joining Tree方法构建进化树,并经Bootstrap重复验证1 000次。
1.3.6 乳酸菌细菌素的纯化
使用阳离子交换柱CM SefinoseTMFF纯化乳酸菌细菌素。用含1 mol/L NaCl的5 mmol/L乙酸钠缓冲液梯度洗脱,流速为1 mL/min,在280 nm和220 nm紫外检测,收集蛋白峰,检测蛋白含量和抗菌活性。之后使用制备液相色谱,进一步纯化细菌素。用5 mmol/L乙酸钠缓冲液平衡。流速为3 mL/min,紫外检测波长为280 nm。收集蛋白峰。计算纯化过程中的纯化倍数和细菌素收率等。将纯化后的细菌素冻干浓缩,加去离子水溶解进行Tricine-SDS-PAGE电泳[11]。将得到的目的蛋白条带切下,放于混有E.coli的LB平板上进行抑菌活性检测。
1.3.7 WZS02发酵液的细菌素效价测定
目前细菌素效价测定方法多采用逐步稀释法[13]或者与Nisin进行对比,本实验以大肠杆菌和金黄色葡萄球菌为指示菌,将Nisin标准品用pH值4.5的乙酸钠缓冲液稀释成1 mg/mL,然后将发酵液梯度二倍稀释与1 mg/mL的Nisin标准品一起采用打孔法测定抑菌活性,打孔器直径为5 mm,加入的量为50 μL。抑菌活性的计算方式:如果稀释2n倍具有最小抑菌圈,那么细菌素的效价为2n×1 000 μL/50 μL,将细菌素的效价转换为Nisin的标准效价。
2 结果与讨论
2.1 样品中乳酸菌的分离与初筛
从米酒和酸粥中分离筛选了60株乳酸菌,选择其中抑菌效果较好的3株菌作为研究对象,分别命名为菌株WZK01、WZK02和WZS02。乳酸菌发酵液中含有乳酸、乙酸和过氧化氢。为了证明这些菌株的抑菌活性并不是来源于有机酸和过氧化氢,进行了有机酸和过氧化氢的排除实验。发现与发酵液具有相同pH值的乳酸和乙酸并不会产生抑菌圈。说明乳酸菌的抑菌活性并不依靠发酵液中的有机酸,其抑菌活性来源于发酵液中的其他物质。过氧化氢酶处理发酵液后,发酵液的抑菌圈直径仅有微弱的减少,说明乳酸菌在生长代谢中产生的过氧化氢具有一定的抑菌活性,但并不起到决定性作用。因此初步认为乳酸菌发酵液的抑菌活性主要来源于其中的细菌素。
2.2 三株乳酸菌发酵液抗菌活性稳定性的对比
如图1-a所示,菌株WZS02细菌素热稳定性最好,其可以耐受121 ℃的高温,并且后续经过抑菌率试验测得121 ℃处理30 min后活性仅降低了8%左右。pH值稳定性结果表明这3种乳酸菌细菌素的pH值适应范围都较窄并且在强酸性处理条件下活性降低,随着pH值增高至碱性,抑菌活性降低甚至失活。这3种乳酸菌细菌素中的WZK01细菌素和WZK02细菌素的最适pH值均为6,而WZS02细菌素的最适pH则为4(图1-b)。

a-温度稳定性;b-pH稳定性对比; c-酶解稳定性对比图1 三株乳酸菌发酵液抗菌活性稳定性的对比Fig.1 Comparison of the stability of the antibacterial activity of three strains of lactic acid bacteria
图1-c表明本实验所采用的各种蛋白酶对于这3株乳酸菌发酵液中的抑菌物质均具有一定的水解作用,同时根据蛋白酶酶解后抑菌活性下降剧烈这一现象可以判断这3株乳酸菌发酵液中的抑菌物质为细菌素。从图中可以看出糜蛋白酶对于这3株乳酸菌分泌的细菌素酶解能力较强,胃蛋白酶以及胰蛋白酶处理后活性损失较小。这3株乳酸菌细菌素经过蛋白酶处理90 min后活性大部分丧失。因此其如果作为饲料添加剂,不会对环境产生过多的污染。综合以上研究结果发现,WZS02细菌素具有热稳定性好、抗菌性能强、对环境友好等优点,因此选用WZS02为后续研究菌株。
2.3 菌株鉴定
将抑菌活性强的WZS02、WZK01、WZK02菌株进行16S rDNA扩增,并将扩增产物测序。根据GenBank中16S rDNA序列同源性比较发现WZS02菌株与植物乳杆菌的同源性为99%;WZK01菌株与发酵乳杆菌的同源性为99%;WZK02与明串球菌的同源性为99%。在GenBank中选择合适菌株的16S rDNA序列构建进化树(图2)。

图2 三株乳酸菌的系统进化关系Fig.2 Phylogenetic relationships of three lactic acid bacteria
结果表明WZS02菌株与L.plantarumBCH-2的同源性为100%,因此将其命名为L.plantarumWZS02;WZK01菌株与L.fermentumF4S8的同源性为100%,因此将其命名为L.fermentumWZK01;WZK02菌株与L.citreumKM20的同源性为97%,因此将其命名为L.citreumWZK02。
由于WZS02细菌素的温度稳定性明显优于其他2种,因此本文以其为研究对象进行下一步实验。参照《乳酸菌分类鉴定及实验方法》,进一步对WZS02菌株进行了生理生化实验确认。该菌株过氧化氢试验、硝酸盐还原试验、吲哚试验、明胶液化试验呈阴性,不产硫化氢,pH 4.5能生长,能够发酵果糖、葡萄糖、蔗糖等碳水化合物,不能发酵阿拉伯糖和木糖。显微镜观察实验表明,WZS02菌体成杆状,单个、成对或成链状排列,革兰氏染色阳性,无芽孢。根据生理生化鉴定与菌体形态进一步确定菌株WZS02为植物乳杆菌(L.plantarum),与之前的16S rDNA鉴定结果一致。
2.4 生长曲线的测定及其与抑菌活性的关系
将活化好的菌株以2%的接种量接种到改进的MRS培养基中,放置在37 ℃培养箱中培养。如图3所示,菌株从18 h左右进入稳定期,OD在2.25左右维持稳定,并在28 h左右进入衰亡期,菌体开始自溶导致OD值下降。细菌素WZS02在发酵6 h后产生,说明细菌素为次级代谢产物,发酵时间8 h后,从抑菌曲线来看随着菌体量增长,细菌素的产量也在不断增加,当发酵时间达到20~26 h时,即菌株稳定期的后期、衰亡期的前期,发酵液中细菌素的含量也达到最大,抑菌率为52%左右,随后抑菌活性有所下降,或许与菌体自溶导致胞内蛋白酶流出降解细菌素有关。

图3 植物乳杆菌WZS02的生长量与抑菌活性的关系Fig.3 The relationship between the growth of LZ lactic acid bacteria WZS02 and the antibacterial activity
2.5 植物乳杆菌WZS02细菌素的纯化
采用CM SefinoseTMFF阳离子交换柱对发酵液中的细菌素进行纯化,将有抑菌活性的洗脱液泵入制备液相色谱,在280 nm下测得蛋白吸收峰。每一步纯化倍数与回收率见表1。
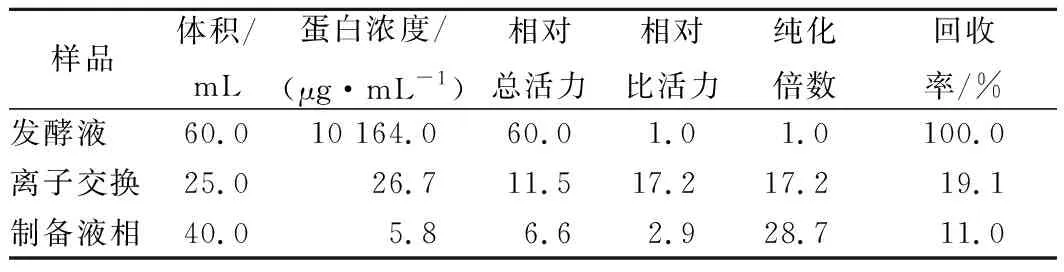
表1 细菌素WZS02纯化表Table 1 Purification table of bacteriocin WZS02
注:以发酵液抑菌活性为1,离子交换以及液相制备的抑菌活性与发酵液对比后计算相对总活力与相对比活力。
将经阳离子交换层析以及液相制备色谱纯化得到的蛋白样品进行Tricine-SDS-PAGE(图4-a),在1.7~4.6 kDa之间可见明显的小肽条带。将该小肽条带切下,并取空白蛋白胶为对照测其抑菌活性。从图4-b中可以看出Tricine-SDS-PAGE得到的细菌素蛋白条带仍保持有一定的抑菌活性,这一现象表明即使经过SDS变性剂处理以及热处理后,细菌素WZS02仍能保持一定的生物活性。

a-Tricine SDS-PAGE电泳图;b-蛋白条带抑菌活性检测图4 Tricine SDS-PAGE电泳图与蛋白条带抑菌活性检测Fig.4 Tricine SDS-PAGE and detection of antibacterial activity of protein bands
2.6 WZS02细菌素的效价及抑菌谱测定
测定改进的MRS培养基中培养WZS02菌株24 h的发酵液中的细菌素效价。以大肠杆菌为指示菌,有明显抑菌圈的最大稀释倍数为8倍,计算得效价为160 AU/mL,根据原发酵液与1 mg/mL的Nisin标准品(1 000 IU/mg)的抑菌率的比值,算得以大肠杆菌为指示菌其相对Nisin的效价为9 097 IU/mL。以金黄色葡萄球菌最为指示菌,有明显抑菌圈的细菌素最大稀释倍数为16倍,计算得效价为320 AU/mL,根据原发酵液与1 mg/mL的Nisin标准品(1 000 IU/mg)的抑菌率的比值,算得其对金黄色葡萄球菌的抗性为2 796 IU/mL。因此,WZS02的细菌素对革兰氏阴性及阳性均具有较强的抗性,同时也证明了其抑菌谱较广,抑菌活性强于Nisin。同时也证明了细菌素对革兰氏阳性的抗性一般强于革兰氏阴性。

表2 细菌素WSZ02的抑菌谱Table 2 Bacteriostatic spectrum of WZS02 bacteriocin
注:“+++”直径 ≥ 20 mm高度敏感;“++”直径 ≥ 10 mm中度敏感;“+”直径 ≥ 0 mm低度敏感;“—”无抑菌作用。
测定了细菌素WZS02对实验室现有的一些菌株的抑制效果。从表2中可以看出细菌素WZS02具有较广的抑菌谱,其对革兰氏阳性菌及阴性菌均具有较强的抑制效果,并且对革兰氏阳性菌或阴性菌中的腐败菌(枯草芽孢杆菌)及致病菌(大肠杆菌、金黄色葡萄球菌)抑菌活性较强。此外,对部分真菌(如假丝酵母)也具有一定的抑菌活性。
3 结论
本研究通过发酵液的抑菌活性、酶解稳定性、温度稳定性及pH值稳定性等测定,从传统发酵食品中,筛选出一株对革兰氏阳性和阴性均具有较好的抑制效果的菌株,经分子和生理生化鉴定后,命名为L.plantarumWZS02。将发酵液上清液通过阳离子交换树脂层析和液相制备纯化,得到细菌素纯度较高的蛋白溶液。然后对抑菌谱进行了测定,发现其对大部分革兰氏阳性菌以及阴性菌均有较好的抑制效果,为其作为食品或饲料中的添加剂,以抑制食品或饲料中的腐败菌或致病菌提供了有力支持。
