外源添加维生素C对链霉菌ε-聚赖氨酸发酵的影响
2018-10-17孙浩本颜鹏陆鹏麒毛忠贵唐蕾
孙浩本,颜鹏,陆鹏麒,毛忠贵,唐蕾,*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南学大 生物工程学院,江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine, ε-PL)是微生物合成的短肽,由25~35个赖氨酸残基经α-COOH和ε-NH2缩合而成[1]。作为天然产物,ε-PL具有良好的生物相容性,无毒且具有广谱抑菌作用,可应用于食品、医药等领域,市场前景广阔[2]。目前链霉菌发酵是ε-PL工业化生产的主要方式,由于产物浓度低、成本居高不下,对原始菌株进行遗传改造,获得ε-PL高产菌株成为解决问题的首选方式。HAMANO等[3]研究发现,天门冬氨酸激酶是L-赖氨酸代谢途径的关键酶,HIRAKI等[2]通过解除/降低L-赖氨酸对天门冬氨酸激酶的反馈抑制,在早期的ε-PL生产菌改造中非常奏效,产量从原始菌株的0.2 g/L提升至2.1 g/L。但是这种通过对单一酶进行改造的方法具有明显的局限性。LI等[4]采用基因组重排技术(genome shuffling, GS)同时提高了StreptomycesgraminearusLS-B1对葡萄糖耐受性和ε-PL的产量;李双等[5]从已有不同表型的ε-PL菌株出发,再进行GS,使得ε-PL产量在原有基础上有了进一步提升;吴光耀等[6]采用核糖体工程菌株育种的手段,通过链霉素(Streptomycin, Str)和利福平素(Rifampin, Rif)2种抗生素抗性筛选,获得了1株ε-PL高产突变株StreptomycesalbulusWG-608,其摇瓶产量达到3.7 g/L,较出发菌提高了42.3%。
建立在优良菌株基础上的发酵工艺优化是提高ε-PL产量的另一种有效策略。KAHAR等[7]根据Streptomycesalbulus410在菌体生长和ε-PL合成过程中的pH关系,建立了两阶段pH值调控策略,在5 L搅拌式发酵罐中补料-分批发酵,ε-PL产量从5.7 g/L提高到48.3 g/L。REN等[8]基于酸性pH值对菌体代谢活力的影响以及冲击相关参数的优化,建立了一种酸性pH值冲击策略,经过192 h的补料-分批发酵,ε-PL的最高产量达到54.7 g/L,与未经过pH值冲击的发酵相比提高了52.5%。
添加不同的外源物质也是一种有效的手段。CHEN等[9]从补料-分批发酵的72 h开始不断脉冲流加1 g/L的L-赖氨酸直到发酵结束,最终的ε-PL产量达到37.6 g/L,比对照提高了6.2%。LIU等[10]在补料-分批发酵过程中通过流加酵母粉的方式提高菌体活力、促进菌体生长,最终的ε-PL产量为28.2 g/L,与对照相比提高了73%。
本研究的前期工作通过对GS菌株和亲本菌株的比较,发现GS菌株具有较好的pH值和ε-PL耐受性及抗氧化胁迫能力,发酵后期细胞活性和ε-PL均保持较高水平。因此设想是否可以通过添加外源物质,提高链霉菌ε-PL发酵过程中的抗氧化胁迫能力,从而达到产量提升的目的,为ε-PL的发酵控制提供一个新的思路。
1 材料与方法
1.1 实验材料
1.1.1 菌株
GS菌株Streptomycessp. AF3-44为作者实验室前期研究中经过3轮GS筛选得到的ε-PL耐受型菌株[5]。
1.1.2 培养基
固体培养基(BTN)、种子培养基参考文献[5]。发酵培养基(g/L):葡萄糖 60.0,酵母粉 8.0,(NH4)2SO45.0,K2HPO4·3H2O 2.0,MgSO4·7H2O 1.0,ZnSO40.04,FeSO4·7H2O 0.03。1×105Pa灭菌20 min,用体积分数为50%的氨水调pH值至6.9。
1.2 实验方法
1.2.1 培养方法
固体培养、种子培养参照文献[5]。
摇瓶发酵:将浓度为2 mol/L的Vc母液,经0.45 μm的滤膜除菌后,分别在相应的发酵阶段添加1 mL(对照组添加等体积无菌水),为了避免添加后因pH值的下降对发酵带来影响,用2 mol/L NaOH调节pH值至发酵阶段pH值。
分批发酵:在5 L发酵罐中,以装液总体积为3.5 L进行分批发酵,其中发酵培养基为3.26 L,种子液为0.24 L。发酵培养温度为30 ℃,初始转速为200 r/min,通气量维持在1 vvm,接种前校正溶氧为100%,发酵时间延长菌体量增多,好氧需求变大,溶氧迅速降低,待溶氧降至20%时采用溶氧关联转速的方式来自动控制溶氧水平,通过增加转速来维持溶氧20%,每隔一定时间进行取样,分别对葡萄糖、菌体干重(dry cell weight,DCW)、ε-PL浓度进行测定,直至葡萄糖耗尽后,发酵结束。添加Vc的分批发酵罐中预装已灭菌的发酵培养基3.06 L,种子液0.24 L,0.875 mol/L的Vc 0.2 L,总体积维持在3.5 L。在5 L罐上以不添加Vc作为对照组,pH值降到4.0时,通过流加体积分数为50%的氨水维持pH值4.0至发酵结束。添加Vc的实验组在pH值自然下降到4.0时,通过流加体积分数为50%的氨水维持pH值恒定的同时,将膜过滤的Vc溶液经蠕动泵缓慢流加,流加速率以溶氧维持20%进行适当调节。
1.2.2 发酵过程参数的测定
ε-PL浓度的测定参考ITZHAKI等[11]的方法。DCW的测定参考CHEN等[12]的方法。
1.2.3 丙二醛(malonaldehyde,MDA)和ROS的测定
参考曾昕等[13]的方法。
1.2.4 细胞活力的测定
参考周永鹏等[14]的方法。
1.2.5 细胞提取液的制备
参考颜鹏等[15]的方法。
1.2.6 细胞膜脂肪酸含量的测定
参考任喜东[16]的方法。
1.2.7 抗氧化酶类活力测定
超氧化物歧化酶(superoxide dismutase,SOD)参考史竞艳等[17-18]的方法。过氧化氢酶(catalase,CAT)参考燕国梁[19]的方法。
1.2.8 总抗氧化能力(total antioxidant capacity,T-AOC)的测定
采用总抗氧化能力(T-AOC)测试盒(奥青生物科技有限公司,南京),按照说明书的要求进行操作。
1.2.9 显著性分析
采用SPSS Statistics 19(IBM,USA)进行方差分析(Fisher’s least significant difference,LSD),当p值<0.05时认为差异显著。
2 结果与分析
2.1 Streptomyces sp. AF3-44菌株发酵过程中菌体活力和ROS水平的变化
前期研究表明AF3-44菌株胞外ROS的水平随着发酵进行呈上升趋势,本研究采用DCFH-DA(2,7-dichlorofuorescin diacetate)荧光染色的办法,进一步分析胞内ROS的变化。DCFH-DA没有荧光,进入细胞后被酶水解为DCFH(dichlorofuorescin)。在ROS存在下,将DCFH氧化为不能透过细胞膜的强绿色荧光物质DCF(dichlorofluorescein),细胞内活性氧水平与荧光强度成正比。
细胞活力常常以细胞有氧呼吸的能力来表征。作为一种细胞氧化还原代谢的指示剂,5-氰基-2, 3-二-(p-苄基-四唑氯化物)(5-cyano-2,3-ditolyl tetrazolium chloride, CTC)可进入细胞,并被呼吸链中的还原酶还原,得到显红色荧光的产物[20]。
如图1-A所示,ROS染色显示绿色荧光强度逐渐增强,尤其是在54 h之后尤为明显,说明胞内的ROS逐渐累积增多,ROS不断积累会造成细胞的氧化损伤,包括蛋白质、脂质和DNA的氧化[21],从而导致菌体活力降低;同时,CTC染色显示红色荧光强度减弱,表明菌体活力有所下降(图1-B)。以上结果与摇瓶发酵过程参数变化相一致(图2),即在低pH值和ε-PL快速合成和积累的发酵后期,菌体受到的氧化胁迫增强,活力降低,因此通过外源添加抗氧化物质有可能减少伤害的发生,提高菌体活力和ε-PL的发酵水平。
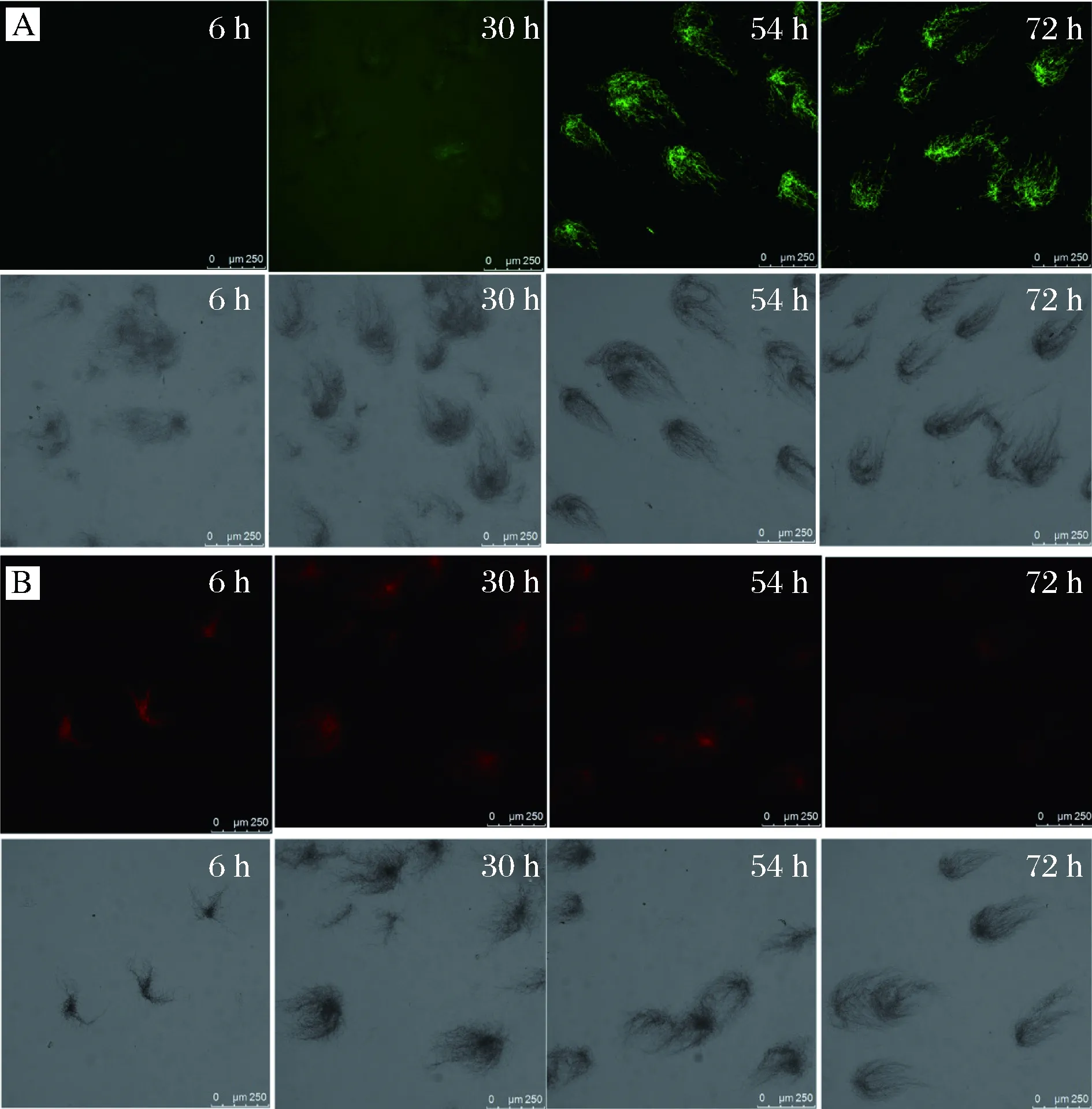
图1 细胞内ROS(A)和细胞活力(B)染色Fig.1 Cell intracellular ROS (A) staining and viability (B) staining注:图A上半部分与图B上半部分为荧光下拍摄的影像;图A下半部分和图B下半部分是明场下拍摄的影像。
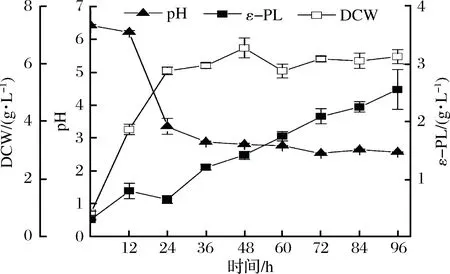
图2 摇瓶发酵过程参数Fig.2 Profile of process parameters in shake-flask fermentation
2.2 Vc对菌体生长和ε-PL合成的影响
Vc可以清除微生物体内多余的氧自由基,防止细胞受到氧化损伤[19]。XIAO等[22]在甲醇补料阶段加入Vc可明显缓解细胞内ROS对细胞膜的损伤,发酵结束时细胞活力增强,水蛭素产量达到5.0 g/L比对照高出7%。在青霉菌的类胡萝卜素生产中,Vc的添加替代了β-胡萝卜素的抗氧化作用[23-24]。REN等[25]在利用裂殖壶菌产DHA的发酵过程中采用两点法添加Vc策略,使得DHA的产量提高30%。另外Vc价格低,食用安全,不会对后续的ε-PL纯化带来安全风险。
因此,选取Vc作为抗氧化剂,考察Vc的添加时间和添加浓度对ε-PL摇瓶发酵的影响。结果如表1所示。Vc的添加时间和添加浓度对ε-PL发酵和菌体量均有影响,其中在24 h添加Vc(浓度为50 mmol/L)时产量达到2.45±0.04 g/L,比对照高出18.93%(p<0.05),而菌体量为5.84±0.06 g/L与对照的5.93 g/L相差不大。表明随着Vc的添加,ε-PL的生产得到较大的增强,尤其是单位菌体的合成能力。Vc添加的最佳条件下单位菌体的合成能力达到了0.42 g ε-PL/g菌体,高于对照的0.35 g ε-PL/g菌体。因此选择发酵至24 h添加Vc溶液(50 mmol/L)进行后续实验。
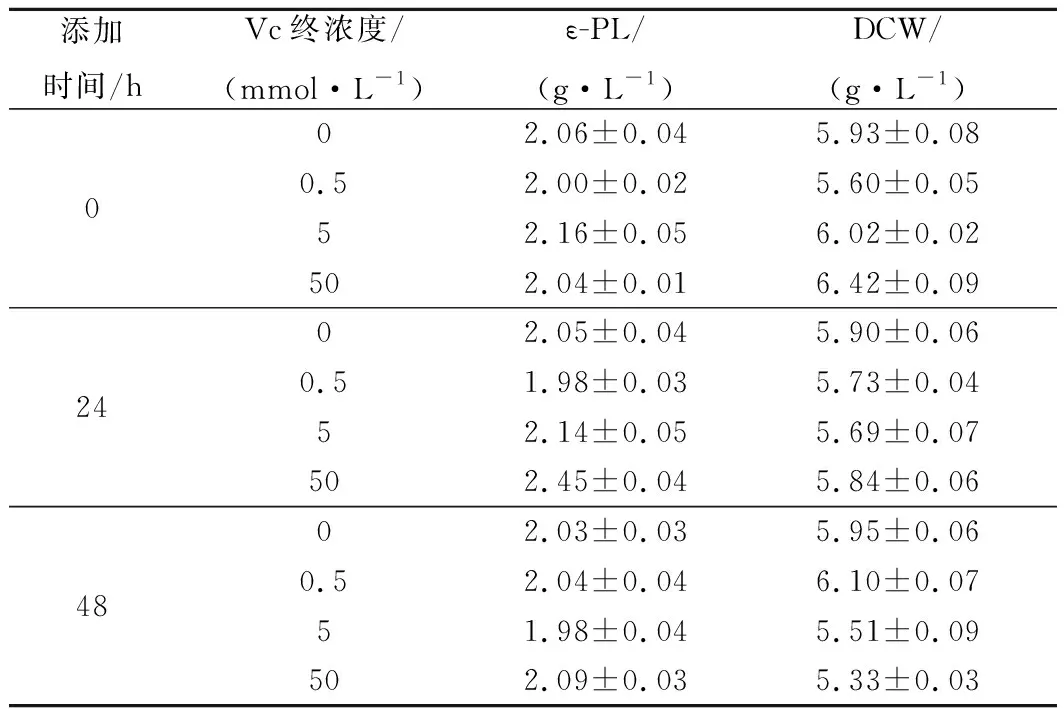
表1 Vc添加时间和浓度对细胞量和ε-PL浓度的影响Table 1 The addition time and concentration of Vc on biomass and ε-PL titer
2.3 Vc对菌体抗氧化胁迫能力的影响
细菌中的ROS水平与抗氧化系统有密切的关联,通常细菌体内ROS水平激增都伴随着体内抗氧化系统活力的减弱。还原性酶活力降低和还原性物质不足均会导致细菌中ROS的大量产生并在体内不断积累[26]。
微生物细胞内的抗氧化酶保护细胞免受ROS的损伤[27]。通过对抗氧化酶的测定,结果表明:对照组过氧化氢酶的活力基本维持在恒定水平且有升高的趋势,而实验组在24 h时,CAT活力高于对照,发酵后期CAT活力均处于较高水平,可以更好的抵抗氧化胁迫。这也与文献报道相一致[28]。而对于SOD,对照组和实验组总的趋势是前期SOD酶活力高到后期降低,实验组SOD初期高于对照组,而后期低于对照,且变化不明显,一般认为SOD与CAT在微生物体内协同作用:SOD以O2-·作为底物,通过歧化反应SOD使O2-·歧化为H2O2和O2,从而起到清除O2-·的作用;产生的H2O2则在CAT作用下被清除,分解生成H2O和O2,而H2O2量的增加会抑制SOD酶的活性[29],这与本文实验结果也具有一致性(图3-A,图3-B)。
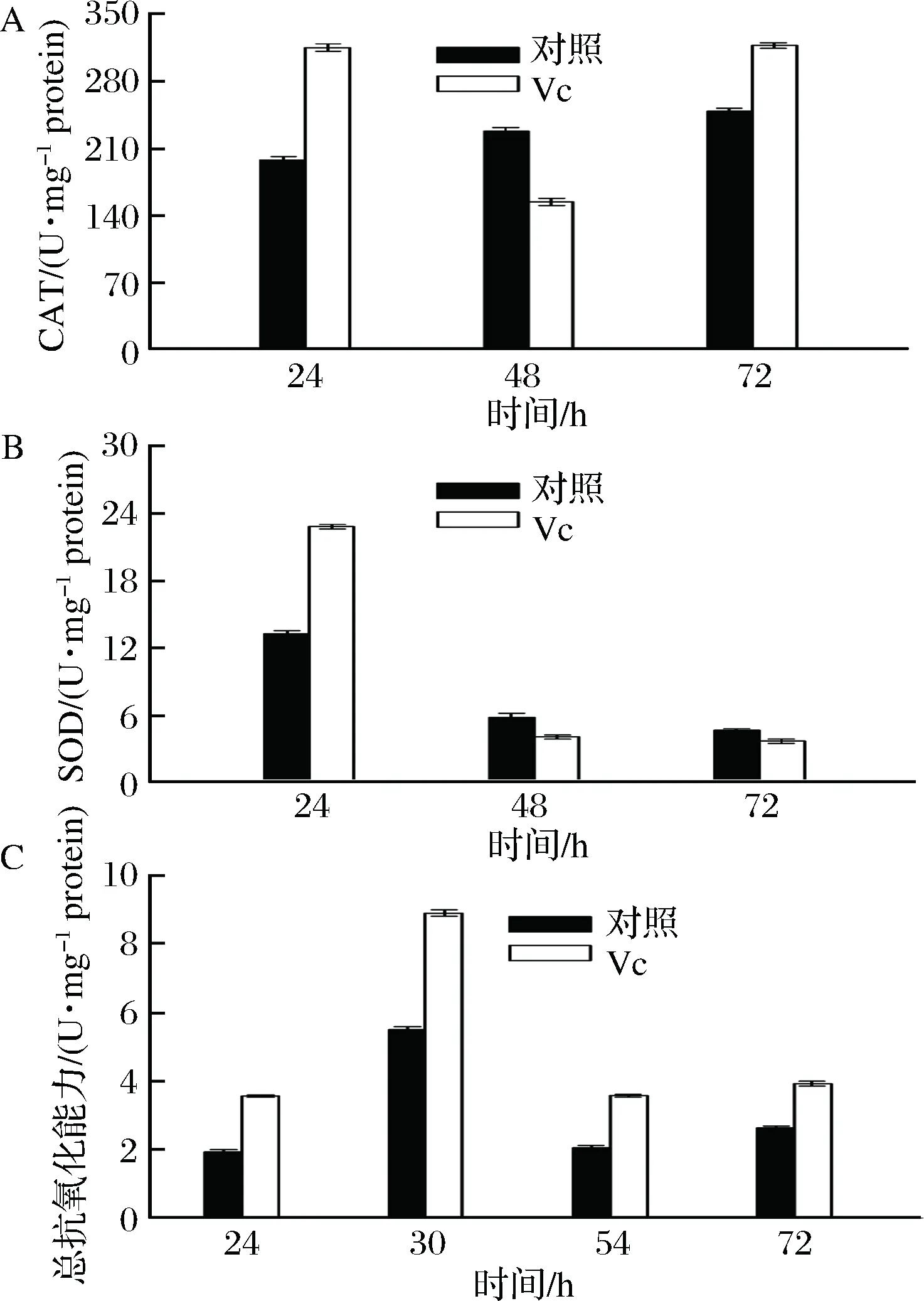
图3 Vc对关键酶活力和总抗氧化能力的影响Fig.3 The effect of Vc on the key enzymes activities and total antioxidant capacity
生物体的抗氧化防御体系主要分为2大类。一类叫预防性抗氧化剂,主要包括SOD、CAT等。另一类叫自由基捕捉剂,包括VC、VE等[30]。因此除了考察细胞抗氧化酶的活力,还进一步测定细胞的总抗氧化能力,如图3-C所示,Vc的添加改善了整个发酵过程中总抗氧化能力,总抗氧化能力较对照组均提高1.5倍以上,尤其在30 h总抗氧化能力达到最大,为8.91 U/(mg protein)。外源添加Vc显著提高了菌体的抗氧化能力。近年来,已经有许多尝试通过外部补充抗氧化剂,来改善细胞生长或目的产物的生产。LIU等[31]通过外加芝麻酚,提高总抗氧化能力,增加了Crypthecodiniumcohnii的细胞增殖和脂肪酸生产能力。这与本文的研究思路一致,且实验结果具有一致性。
2.4 Vc对细胞膜氧化损伤的影响
大多数有氧代谢的微生物在细胞呼吸过程中都会产生ROS,其中高氧化活力的HO·将对生物大分子进行攻击,从而破坏它们的结构,特别是细胞膜及其相关组分,为此本文考察了Vc的添加对细胞膜成分以及膜氧化损伤标志物MDA的影响。
Vc是食品工业中众所周知的抗氧化剂,可以增强T-AOC并减少细胞中的ROS产生。高T-AOC对于许多必需的生物学功能是必不可少的,特别是必需的多不饱和脂肪酸过氧化,以及DNA损伤的保护[32]。实验结果表明,Streptomycessp. AF3-44的细胞膜组成主要由饱和脂肪酸肉豆蔻酸(C14∶0)十五烷酸(C15∶0)、棕榈酸(C16∶0)以及不饱和脂肪酸肉豆蔻油酸(C14∶1)和油酸(C18∶1)组成。随着时间的延长,环境pH值的下降,饱和脂肪酸和不饱和脂肪酸在细胞膜中的组成比例呈现出相反的趋势:饱和脂肪酸在细胞膜中的含量下降;而不饱和脂肪酸的含量增加(图4)。这在对照组和实验组中具有一致性。值得注意的是同一时间点,实验组不饱和脂肪酸所占的比例高于对照组。发酵结束时,实验组总不饱和脂肪酸所占比例达到23.8%,高于对照19.4%。其中增加最明显的为不饱和脂肪酸肉豆蔻油酸(C14∶1),实验组所占比例从8.5%提高到11.7%。细胞膜脂肪酸不饱和度的升高增强了膜的流动性,从而更加有利于细胞膜中物质的运输以及能量代谢的发挥,以保证细胞在氧化胁迫条件下的生存与功能行使。这也与文献报道相一致[16]。
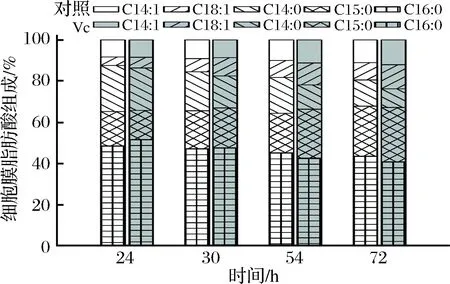
图4 细胞膜脂肪酸组成随发酵时间的变化Fig.4 Changes of cell membrane fatty acid composition with the fermentation time
MDA是膜脂过氧化最重要的产物之一,MDA水平的高低间接反映了膜系统受损程度。
如图5所示,对照组MDA水平前期较低,后期较高。实验组加入Vc后MDA水平显著低于对照组,虽然在48 h之前实验组和对照组相差并不大,这是由于在这一时间段菌体仍处于快速生长时期,抵抗氧化胁迫的能力较强;但是48 h之后菌体生长能力下降,氧化胁迫作用逐步增强,此时Vc对脂质的保护效果更为突出,在60 h实验组MDA含量为3.81±0.13 nmol/mg protein,相比于对照4.67±0.11 nmol/mg proteinMDA水平下降了18.41%。72 h时与实验组MDA含量相比对照组下降幅度进一步增大,达到了29.30%。说明添加Vc后发酵后期,细胞膜脂质过氧化水平较低,氧化损伤较轻。这也与总抗氧化能力和CAT的变化趋势相一致,因此Vc的添加缓解了细胞的氧化损伤。
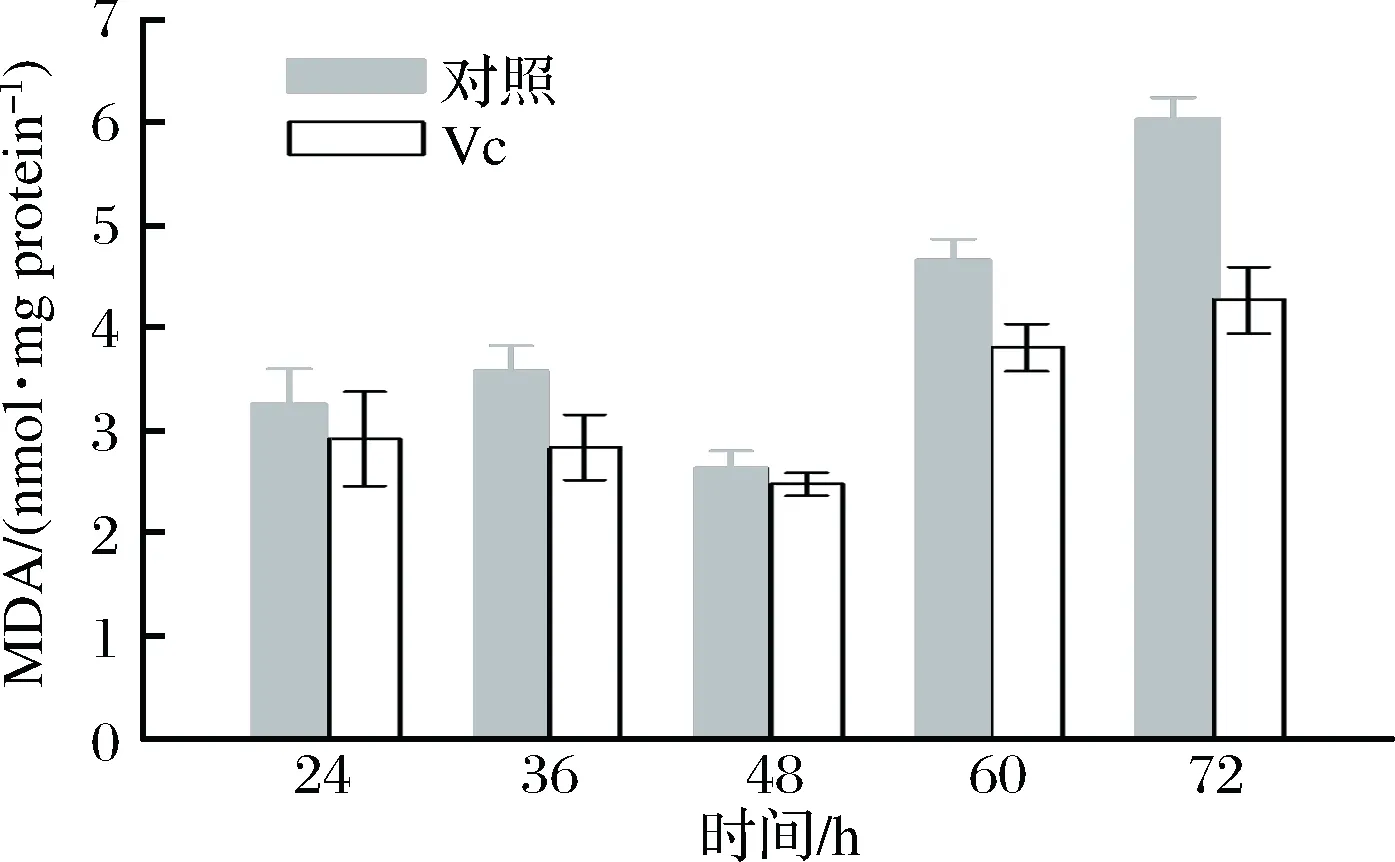
图5 细胞膜MDA含量随发酵时间的变化Fig.5 Changes of cell membrane MDA content with the fermentation time
2.5 添加Vc对5 L罐分批发酵的影响
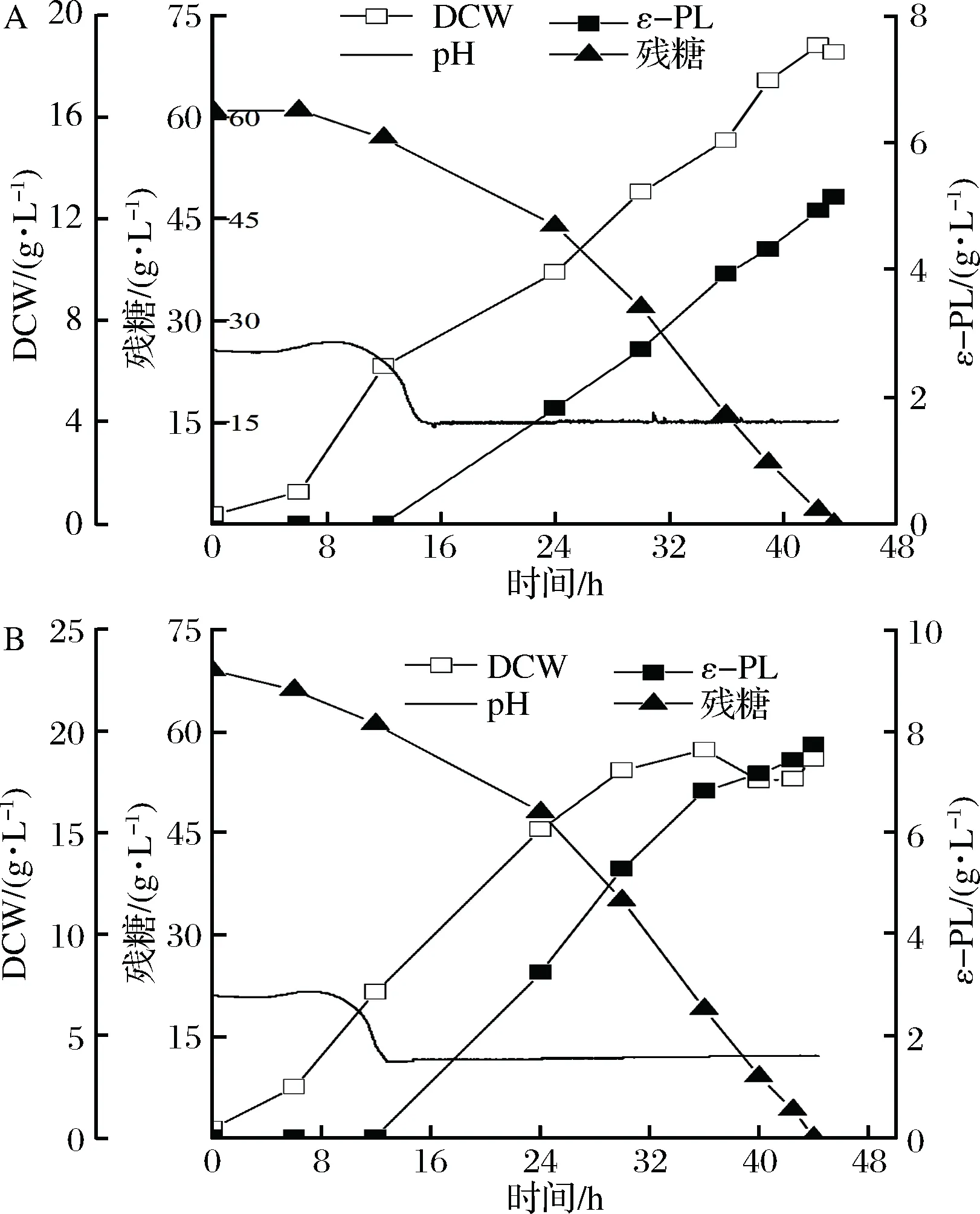
A-对照组;B-添加Vc实验组图6 5 L罐分批发酵过程参数Fig.6 Profile of fermentative parameters in 5 L fermenter
为了进一步比较添加Vc对ε-PL发酵性能的影响,在5 L罐上以不添加Vc作为对照组,pH值大约在14 h降到4.0时(此时ε-PL大量合成),通过流加体积分数为50%的氨水维持pH值4.0至发酵结束。对照组发酵43.6 h结束,ε-PL产量为5.14 g/L,菌体量为18.54 g/L。实验组在pH值自然下降到4.0时,通过流加体积分数为50%氨水维持pH值恒定的同时,将膜过滤的Vc溶液经蠕动泵缓慢流加,流加速率以溶氧维持20%进行适当调节,流加Vc整个过程大约2.5 h结束,最终44 h发酵结束,ε-PL浓度为7.73 g/L,菌体量为18.5 g/L。因此Vc的添加促进了ε-PL产量的提高。
3 结论与讨论
ε-PL作为天然防腐剂应用潜力巨大,但是野生菌ε-PL的合成能力较低,近年来新型的育种方法如GS、核糖体育种等,较传统的方法很大程度上提升了ε-PL的浓度[26-27]。补充外源添加物是发酵优化的一种常用手段,在ε-PL发酵中,多以添加氨基酸类[9,33]、营养基质[10]、吸附载体[34]为主。本文通过外源添加价廉与安全的抗氧化剂Vc,从生理角度进行初步的分析:发酵过程中随着时间的延长,菌体活力逐渐下降,ROS水平逐渐积累升高;实验结果表明摇瓶发酵中Vc最优的条件为:24 h添加浓度为50 mmol/L,此时ε-PL产量2.45±0.04 g/L,比对照高出18.93%;Vc的添加改善了整个发酵过程中总抗氧化能力、提高了细胞膜脂肪酸不饱和度、缓解了细胞的氧化损伤。而细胞膜脂肪酸不饱和度的升高增强了膜的流动性,从而有利于细胞膜中物质的运输以及能量代谢的发挥,保证细胞在氧化胁迫条件下的生存与功能行使;细胞膜脂质过氧化水平降低,氧化损伤较轻。5 L罐分批发酵对照43.6 h发酵结束,ε-PL 5.14 g/L,菌体量18.54 g/L。实验组44 h发酵结束,ε-PL 7.73 g/L,菌体量18.5 g/L,Vc的添加促进了ε-PL产量的提高。与此类似,GAFFNEY等[35]通过补充亚麻籽油提高了Schizochytriumsp.的T-AOC,改善不饱和脂肪酸的生产。而BURG等[36]发现添加盐对培养基可以增强紫菜的T-AOC。这些结果表明通过调整氧化损伤和T-AOC状态来改变细胞活力和产物合成是行之有效的手段。另外,外源添加Vc如何与现有的优良的发酵工艺相结合,进一步提高ε-PL产量还有待进一步的研究。
