固相萃取整体捕集剂-气相色谱-质谱联用仪结合电子鼻技术对中华绒螯蟹关键脂质热氧化体系的构建
2018-10-17付雪艳吴娜袁凯王锡昌
付雪艳,吴娜,袁凯,王锡昌*
1 (上海海洋大学 食品学院,上海,201306) 2(江西农业大学 食品科学与工程学院,江西 南昌,330045)
中华绒螯蟹是中国传统的淡水养殖甲壳类水生动物,俗称河蟹,系大宗名贵水产品之一。中华绒螯蟹味道鲜美、营养丰富,这与其丰富的脂肪和蛋白质含量组成密切相关,其中中华绒螯蟹的脂肪含量占总营养成分的13.33%[1],在水产品中位居前列(贝类占2.71%,刀鲚占6.42%,海蟹占4.80%[2-4])。目前有关中华绒螯蟹基本营养成分、脂肪酸、氨基酸、挥发性物质等的研究已日益成熟,但是有关脂质热氧化降解对中华绒螯蟹挥发性物质的作用的研究还很少见。脂质主要包括以磷脂为主的极性脂和由甘油三酯、游离脂肪酸和胆固醇等组成的中性脂。磷脂、甘油三酯和游离脂肪酸是脂质中对香气贡献最大的三种组分[5-6]。这些香气物质多是一些醛、酮、醇等小分子化合物,其中很多化合物具有良好的风味特征[7]。
不少研究旨在探究脂质降解与挥发性物质生成的关联,但还仅限于不同加工处理前后脂肪酸组成与挥发性成分的关联性分析[8-9],以及不同可食部位脂质组成变化及对挥发性成分的影响上[10-11]。基于本研究团队之前对中华绒螯蟹在热处理前后不同脂质组分含量变化的研究[12],发现雌蟹性腺中的甘油三酯(triglyceride, TG)、甘油二酯(diglyceride, DG)和游离脂肪酸(free fatty acid, FFA)以及雌蟹肝胰腺中的游离脂肪酸(FFA)和磷脂酰胆碱(phosphatidyl ethanolamine, PE)在蒸制之后出现显著下降,由此推断这几种脂质为其相应可食部位对挥发性物质贡献显著的关键脂质。TG作为性腺中含量最多的脂质[13],其在热处理过程中很不稳定,酰基链上的脂肪酸极易氧化降解,特别是多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)。其降解产物可能是DG和FFA,因此DG和FFA的变化就变得很复杂,一方面会因为中性脂和极性脂的不断降解而增加,另一方面自身也会发生降解,最终其含量下降,说明其降解速率远大于生成速率。SWEETEN[14]和DUCKETT[15]等的研究表明中性脂和极性脂由不同的脂肪酸组成,其中PUFA主要集中在极性脂上。倪逸群等[10]研究发现,极性脂中的C18∶1n-9c、C20∶1n-9、C20∶4n-6和C22∶6n-3脂肪酸对挥发性化合物的形成贡献显著,因此PE更容易发生降解。考虑到TG的量多且提取过程相对简单[16],PE的量多且下降明显[11],本实验主要针对性腺TG和肝胰腺PE进行热氧化体系的构建。基于此基础笔者通过研究建立雌蟹性腺和肝胰腺关键脂质的热氧化体系,为后续脂质热氧化降解特性的研究提供条件。
1 材料与方法
1.1 实验材料与仪器
50只雌性中华绒螯蟹(150 g左右)于2015年10月采自上海市崇明中华绒螯蟹养殖基地。捕捞后的活蟹立即用棉线扎紧,置于带有冰块的泡沫箱中,于2 h之内运送至实验室。清水冲洗后擦拭,活体剥离其性腺和肝胰腺,分别分装后置于-40 ℃超低温冰箱中储藏备用。
试剂:氯仿、甲醇、二氯甲烷、正己烷、无水乙醚,以上均为分析纯,国药集团化学试剂公司;2, 4, 6-三甲基吡啶(纯度>98.0%),东京化成工业株式会社Trimethyl pyride, TMP;
电子鼻Fox 4000,法国Alpha M.O.S公司;7890A-5975C气相色谱-质谱联用仪,美国Agilent 公司;圆柱形萃取吸附-热脱附吸附子MonoTrap RCC18(2.9 mm×5 mm,孔径1 mm),日本GL Sciences 公司;热脱附器TDU、多功能进样器MPS、冷却型进样口CIS,德国Gerstel 公司;旋转蒸发仪,德国IKA集团;Silicic酸性硅胶柱(Kieselgel 60, 70目-230目),德国默克公司。
1.2 实验方法
1.2.1 样品前处理
分别称取3 g性腺和肝胰腺于20 mL带有橡胶垫片的棕色顶空瓶中(n=3),经热处理[17](时间:0、5、10、15、20、25、30 min; 温度:60、70、80、90、100 ℃)后立即冷却,用于GC-MS检测。
分别称取1 mg TG(添加水分6.15 μL)和12 mg性腺以及1 mg PE(添加水分15.19 μL)和31.15 mg肝胰腺于10 mL顶空瓶中[11](n=3),经上述热处理后立即冷却,用于电子鼻分析。
1.2.2 挥发性气味物质的测定
取上述分别经过热处理后的样品,加入2 μL浓度为10-5g/mL的TMP作为内标[18-19],将3个老化并清洗后(保证没有杂质及残留)的吸附材料(MonoTrap RCC18)用固定装置串联后置于顶空瓶中样品上方,于50℃吸附萃取30 min,以保证样品中挥发性气味物质萃取完全。然后将吸附材料从固定装置上取下,并迅速装入热脱附玻璃衬管中,由多功能进样器(MPS)将MonoTrap转移至热脱附器(TDU)中热脱附,通过-40 ℃液氮冷阱(CIS)进行组分汇集,然后在高温条件下汽化,进入仪器检测。
实验采用DB-5MS弹性毛细管柱(30 m×0.25 mm, 液膜厚度1 μm);程序升温参数参照ZHUANG, WU等研究[20-21];采用不分流模式,流速1.2 mL/min,汽化室温度240 ℃。
1.2.3 脂质的提取
1.2.3.1 总脂的提取
参照FOLCH[22]的方法,分别称取(10.00±0.50)g雌蟹性腺和肝胰腺于烧杯中,经20倍体积的氯仿、甲醇(体积比为2∶1)于4 ℃下静置提取24 h,经滤纸反复过滤,然后用0.03 mol/L MgCl2溶液于4 ℃反复萃取后,移除上层甲醇层,将氯仿层转移至圆底烧瓶中,于40 ℃真空旋转蒸发以去除溶剂至恒重,即得总脂肪。
1.2.3.2 关键脂质的提取
参照SAITO[16]的方法,称取(10.00±0.50)g填料(silica gel 60 0.063 mm~0.200 mm)于酸性硅胶柱中,V(加入二氯甲烷)∶V(正己烷)=2∶3溶液200 mL用来活化柱子,然后加入0.5 g总脂肪,紧接着按照表1顺序分离不同脂质组分:

表1 不同脂质组分洗脱程序[16]Table 1 Elution program of different lipid fractions
注:一些组分中会包含其他组分。
1.2.4 电子鼻分析
本实验采用含有18根传感器(分别为:组A:T30/1、P10/1、P10/2、P40/1、T70/2、PA/2;组B:P30/1、P40/2、P30/2、T40/2、T40/1、TA/2;组C:LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/g CTL、LY2/g CT)的Fox 4000 电子鼻,其能够系统的对河蟹样品进行整体气味轮廓区分。为了使各个样品保持状态的统一,将称好的样品置于自动进样系统的低温托盘(4 ℃)上。采用动态顶空法采集气体,进样前样品置于50 ℃平衡600 s以保证样品释放完全并均匀分散,进样器温度60 ℃,进样体积2 500 μL,1 s进样,以干净空气作为载气,流速为150 mL/min,数据采集时间120 s,在进行下一个样品分析之前,用洁净空气吹扫10 min,以防止样品气味的残留。
1.3 数据处理
所有检测结果均以平均值±标准偏差(Mean±SD,n=3)表示。采用SPSS 20.0对数据进行单因素分析(ANOVA),所有差异分析均在p=0.05水平进行,电子鼻采用仪器工作站自带的Alpha soft 14.0进行分析。
2 结果与分析
2.1 雌性中华绒螯蟹性腺和肝胰腺热处理时间的优化
表2为雌蟹性腺0~30 min,100 ℃热处理过程中的挥发性物质鉴定结果,可以看出随着热处理时间的延长,挥发性物质的种类呈不断增加趋势。生样性
腺仅检测出7种气味物质,而当热处理时间达到25 min和30 min时,检测的气味物质达到19种。由此可推断热处理时间为25 min以上时,其挥发性物质能释放完全。6种气味物质在30 min时被检测的含量达到最高,其他气味物质的含量均在25 min时被检测到有最高值,并且所有被检测到的气味物质总含量均在25 min时达到最高。其中三甲胺、2-丁酮、3-甲基丁醛、戊醛、庚醛和苯甲醛在生样中均未检出,但在5 min开始检出,被检出的含量值在0~15 min呈现一定波动性,15~25 min之间各检出物质的含量呈逐渐增加趋势。25 min之后有13种物质含量有下降趋势,这可能是由于已产生的挥发性物质进一步降解为小分子物质或者是与其他物质发生了进一步反应[23]。
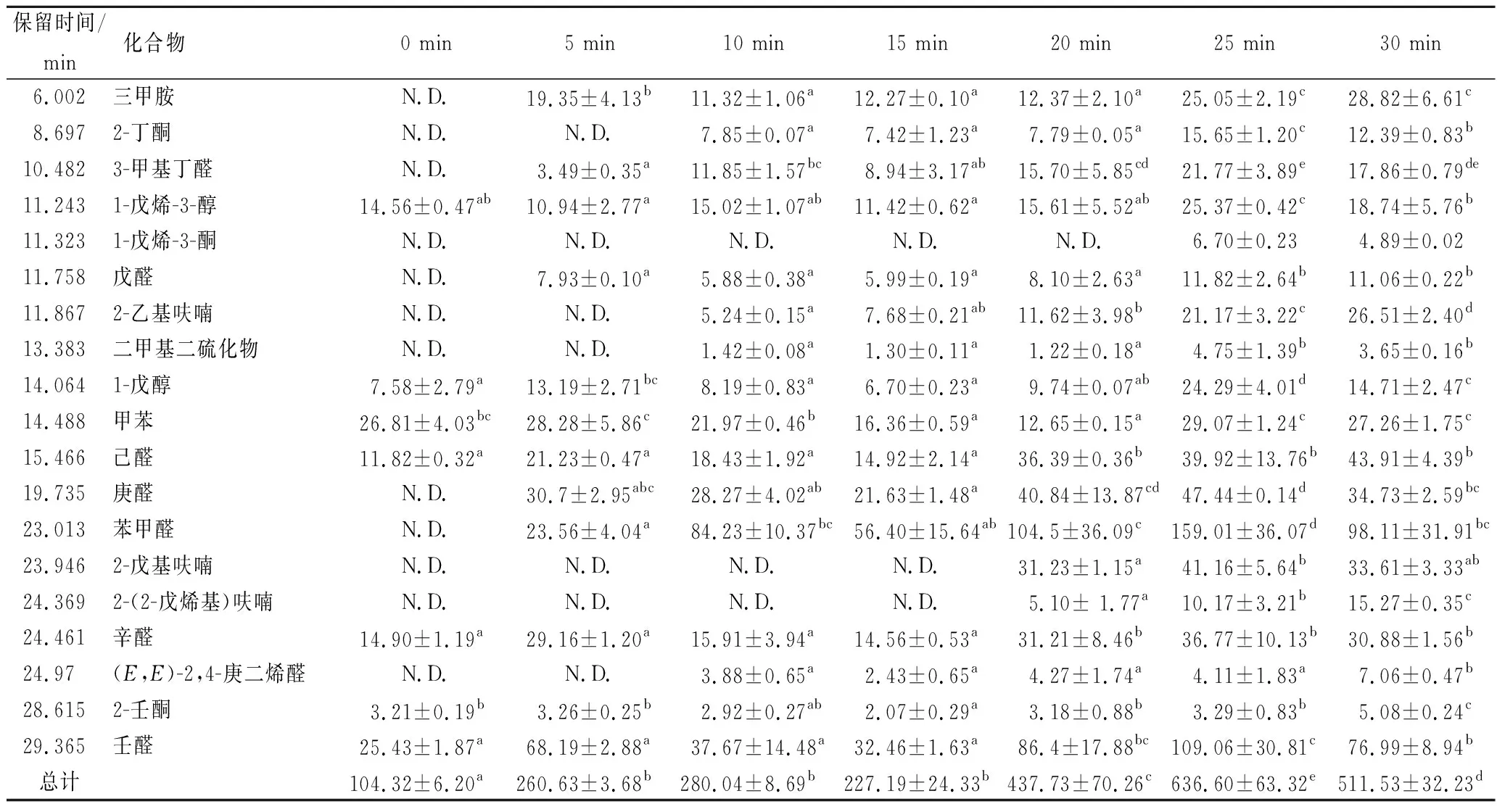
表2 雌性中华绒螯蟹性腺加热0~30 min过程中挥发性物质的鉴定 单位:ng/g
注:1.N.D. 表示未检出;2.同一行不同字母表示存在显著性差异 (p<0.05);下同。
雌蟹肝胰腺在100 ℃热处理0~30 min过程中气味物质的变化如表3,肝胰腺生样仅检测出10种气味物质,随着热处理时间的延长,被检测到气味物质种类依次增加,其中25 min时共检测出23种气味物质,其中16种物质含量达到最高值;而当热处理时间为30 min时,检测出22种气味物质,其中7种气味物质含量达到最高值,其他15种相对于25 min热处理时均有下降,这与性腺结果相似,而2-(2-戊烯基)呋喃则未检出,这可能是其发生了进一步降解;雌蟹肝胰腺经不同时间的热处理,挥发性物质的含量波动较大,说明肝胰腺受温度的影响要大于性腺,但总含量在25 min时达到最高。2-甲基-2-丁烯醛含量在15 min时达到最高,之后有明显下降,这可能是由于15 min之后其降解速度大于生成速度。另外(E)-2-丁烯醛和2-戊基呋喃从10 min开始被检出,2-甲基丁醛从20 min开始被检出,(E)-2-庚烯醛从25 min开始被检出。说明不同热处理时间对不同挥发性化合物的生成和富集有显著影响[24]。
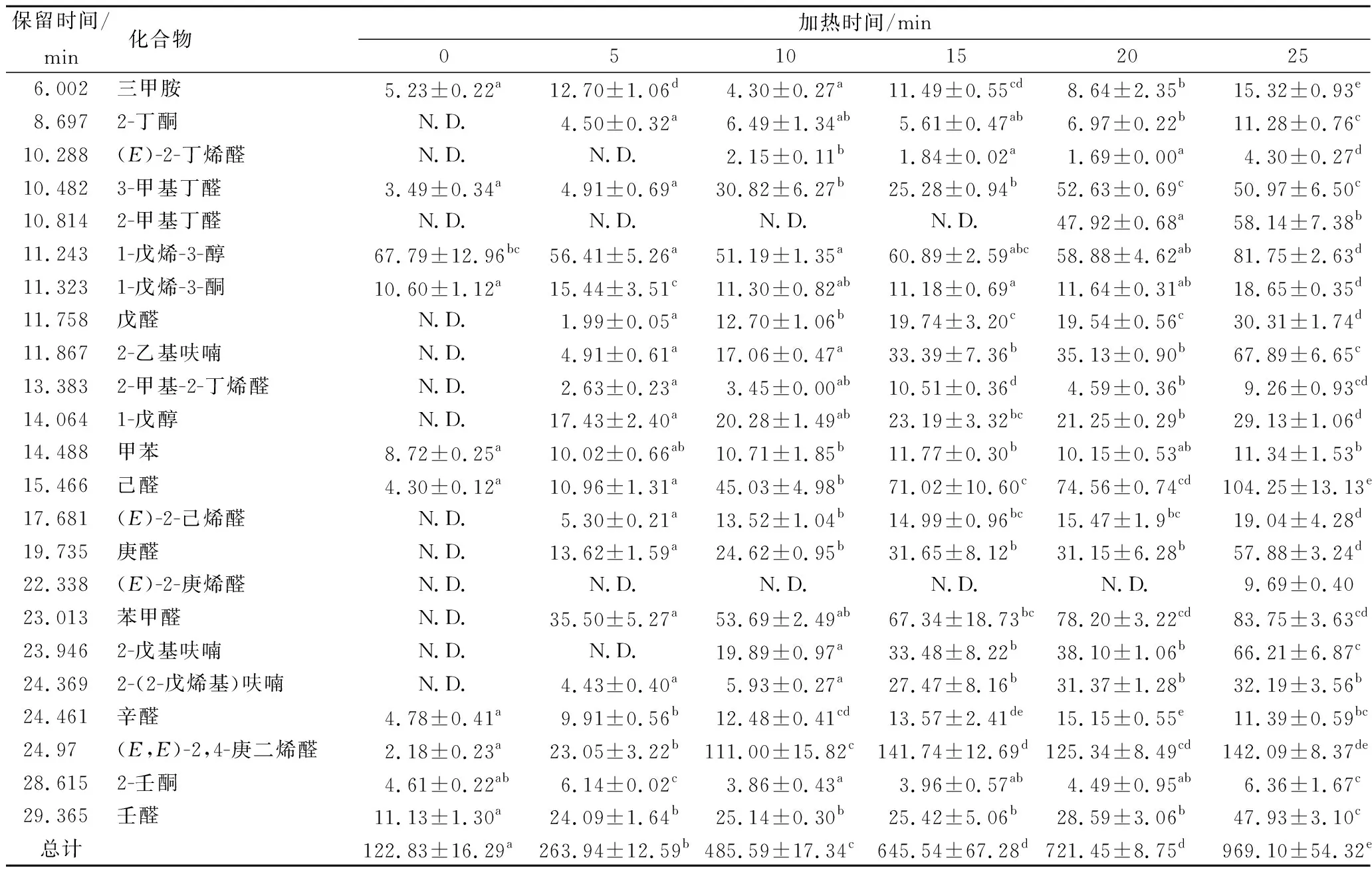
表3 雌性中华绒螯蟹肝胰腺加热0~30 min过程中挥发性物质的鉴定 单位:ng/g
挥发性化合物主要是一些小分子物质,而脂质和蛋白质作为挥发性化合物的重要风味前体物质[25-26],其含量和组成对气味物质的形成有很重要的作用。吴娜[11]对雌性中华绒螯蟹的基本营养成分研究得出,雌蟹性腺中蛋白质含量高于肝胰腺,而肝胰腺中的脂肪含量达40%,显著高于性腺中的脂肪含量,说明肝胰腺具有高脂肪的特点。表2和表3的结果也显示肝胰腺的整体气味物质要比性腺丰富,这可能与其高脂肪含量有关。综合上述结果可以得出,热处理时间为25 min时雌性中华绒螯蟹的气味物质种类最丰富。
2.2 雌性中华绒螯蟹性腺和肝胰腺热处理温度的优化
选择上述优化的热处理时间条件,采用GC-MS对中华绒螯蟹性腺和肝胰腺不同热处理温度下的挥发性物质进行测定,分别如表4和表5所示。
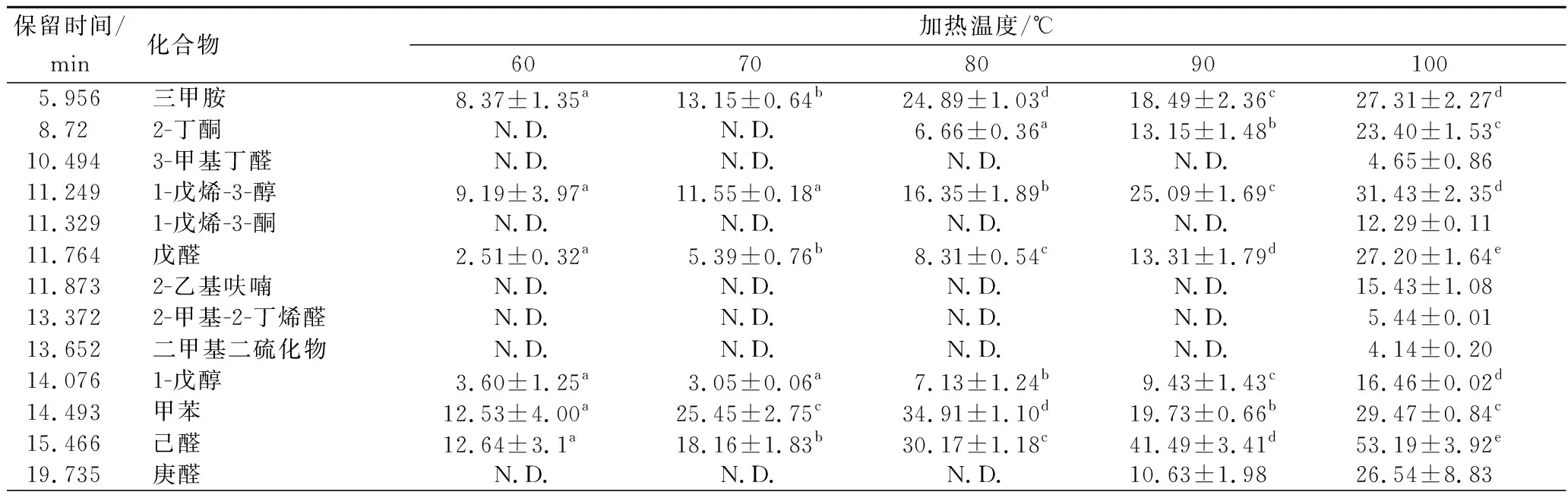
表4 雌性中华绒螯蟹性腺不同热处理温度下的挥发性物质鉴定 单位:ng/g
续表4

保留时间/min化合物加热温度/℃6070809010016.839糠醛3.93±0.184.36±1.143.03±0.25N.D.N.D.23.013苯甲醛19.15±2.39a35.18±3.09b45.82±6.14b116.09±9.06c142.00±11.54d23.9462-戊基呋喃N.D.N.D.N.D.5.03±0.6938.06±5.8424.3692-(2-戊烯基)呋喃N.D.N.D.N.D.6.03±0.7910.20±2.3224.461辛醛27.99±1.18a27.22±2.75a36.64±2.90b41.94±5.48b51.71±6.00c24.965(E,E)-2,4-庚二烯醛N.D.N.D.N.D.N.D.12.29±0.0228.6152-壬酮1.00±0.48a3.63±1.04b3.63±0.21b4.43±0.20bc5.31±0.24c29.365壬醛17.94±3.06a23.71±4.30a36.26±3.54b34.46±2.40b98.83±3.26c总计118.86±19.58a170.82±15.80b253.79±15.93c337.61±10.97d506.32±8.57e

表5 雌性中华绒螯蟹肝胰腺不同热处理温度下的挥发性物质鉴定 单位:ng/g
随着温度的升高,性腺中被检出的气味物质逐渐增加,在60、70、80、90和100 ℃热处理时,分别检测出11、11、12、14和20种气味物质,其中三甲胺、1-戊烯-3-醇、戊醛、1-戊醇、甲苯、己醛、苯甲醛、辛醛、2-壬酮和壬醛在所设定温度范围内都有被检测到;其含量值总体呈现递增趋势,这可能是随着热处理温度的升高,大分子物质降解程度加剧的结果,并在100 ℃时其含量值达最大。所以此类物质也将是之后脂质热氧化降解研究中应该要着重关注的。挥发性物质的总含量在100 ℃时达到最高,且显著高于其他温度水平,其中3-甲基丁醛、1-戊烯-3-酮、2-乙基呋喃、2-甲基-2-丁烯醛、二甲基二硫化物和(E,E)-2,4-庚二烯醛仅在100℃热处理时才被检出,这表征性腺中这些物质对热处理温度具有选择性[24]。
雌性中华绒螯蟹肝胰腺不同热处理温度下的挥发性物质种类和含量相对于性腺要更丰富,其中在60、70、80、90和100 ℃热处理后分别检测出14、15、21、25和25种物质,除1-戊烯-3-醇、1-戊烯-3-酮、1-戊醇、甲苯和2-壬酮的含量在80 ℃时有下降趋势之外,其他物质含量都随着热处理温度的上升呈现递增趋势,在100 ℃时含量达到最高,这和性腺结果相似。80 ℃时这几种物质的含量值逐渐下降,然而被检测到的挥发性物质种类显著增加,说明该温度点对性腺气味物质影响较大[17]。己醛和戊醛由亚油酸盐氢过氧化物的分解产生[23],80 ℃时才被检出,这也验证了上述结果。而三甲胺、3-甲基丁醛、2-戊基呋喃和壬醛在设定温度范围内都有被检出,且含量随温度的上升而升高,100 ℃时含量达到最高。综合上述结果,可以得出雌性中华绒螯蟹热处理温度和时间分别是100 ℃和25 min时其挥发性物质含量和种类都最丰富,能够使其达到最佳风味。
2.3 雌性中华绒螯蟹关键脂质的热氧化体系构建
国内外学者的研究也已经证实,醛类作为河蟹性腺和肝胰腺的主要香气物质,主要来自于脂质和脂肪酸的热降解[27],而温度、时间、水分、氧气等作为脂质氧化的关键因素,是本实验热氧化体系的构建主要考虑的4种因素。本实验通过向关键脂质中添加水分构建体外模型以还原蟹体原始脂质与水分比例。结合实际蒸制条件,热处理温度和时间选择100 ℃,25 min,通过电子鼻对关键脂质的水分和氧气条件进行优化,构建完整的脂质热氧化体系。
2.3.1 雌蟹性腺中TG热氧化体系的构建
图1为添加不同水分梯度的TG在100 ℃, 25 min热处理之后的PCA图,第一和第二主成分方差贡献率之和(PC1%+ PC2%)为98.73,区分指数(Discrimination index, DI)为85,说明其能够反映样本信息的完整程度,且不同样品之间可以进行很好的区分[28]。其中第一主成分贡献率最高(91.039%),因此在PC1方向上当添加水分为6 μL和9 μL时其气味轮廓与性腺样品最为接近[29-30]。结合性腺样品中的实际水分与TG比值,确定当6 μL 为TG的最终水分添加量,此时其气味轮廓与性腺样品最为接近。
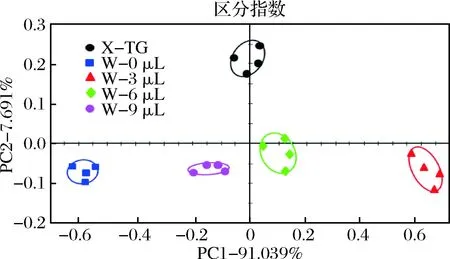
图1 河蟹性腺中的TG在添加不同水分后的PCA图Fig.1 PCA results of TG in gonads added with differentcontents of water
在添加6 μL水分的基础上,通过对真空和正常有氧条件下的TG进行热处理,结合电子鼻雷达图结果进行分析(图2),可以看出有氧条件下的TG对各个传感器的响应值与性腺样品最为接近,整体气味轮廓与样品最为相似。其中传感器P30/2, T30/1, LY2/g CTL, LY2/GH, LY2/AA和LY2/G在真空条件下相对样品其响应值均变小,因此这些传感器所对应的敏感物质类型[31],如极性有机化合物、胺类化合物、氨、醛类、丙酮、碳氧化合物等是值得后续关注的。综上所述,雌蟹性腺中的关键脂质TG的最优热氧化体系条件是:100 ℃, 25 min, 水分6 μL,正常有氧条件。
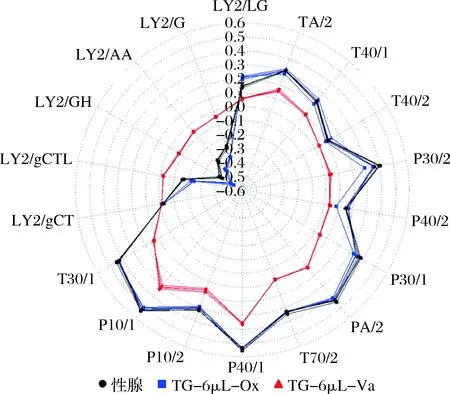
图2 河蟹性腺及TG有氧和真空条件下的雷达图Fig.2 Radar results of TG in gonads under aerobic and vacuum conditions注:Ox, 有氧条件;Va, 真空条件;以下同。
2.3.2 雌蟹肝胰腺中PE热氧化体系的构建
同样地,雌蟹肝胰腺PE中水分的添加以15 μL为基础设置梯度,分别为0、7.5、15和22.5 μL,电子鼻结果如图3-a所示,PCA图区分指数为79,第一主成分贡献率达到99.094%, 说明不同样品在PC1方向上可以达到良好区分。PCA图显示添加不同水分的PE的气味轮廓与肝胰腺样品相差较远,相对来说添加水分为0和15 μL时,PE的气味轮廓与肝胰腺样品最为接近。通过进一步对添加0和15 μL水分的PE和肝胰腺样品进行PCA分析发现(图3-b),添加水分为0时,在PC1方向上,其气味轮廓与样品更为接近。在此基础上对氧气条件进行验证,雷达图中对各个传感器的响应值可知(图4),真空条件下的PE对各个传感器几乎无响应,而有氧条件下除LY2/g CTL, LY2/GH, LY2/AA和LY2/G外,PE对各个传感器的响应值与肝胰腺样品最为接近。根据传感器响应值的高低,说明肝胰腺的主要气味集中在这几个传感器所对应的敏感物质上。综合上述可知,雌蟹肝胰腺中PE的热氧化体系条件为:100 ℃,25 min,水分0 μL,有氧条件。
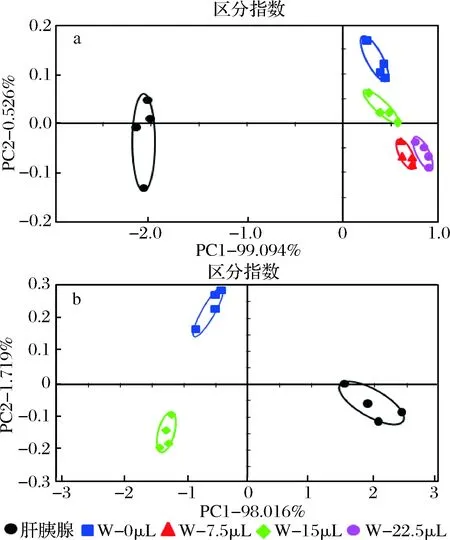
图3 河蟹肝胰腺中的PE在添加不同水分后的PCA图Fig.3 PCA results of PE in hepatopancreas added with different contents of water

图4 河蟹肝胰腺及PE有氧和真空条件下的雷达图Fig.4 Radar results of PE in hepatopancreass under aerobic and vacuum conditions
3 结论与展望
MMSE结合GC-MS对雌性中华绒螯蟹性腺和肝胰腺热处理过程中关键挥发性物质进行测定,根据关键挥发性物质在热处理过程中含量及种类的变化,最终确定热处理时间和温度。在此基础上通过电子鼻结合PCA图和雷达图对关键脂质的气味轮廓与相应可食部位的气味轮廓进行比较,对关键脂质的水分添加以及有氧和真空进行优化,最终确定,性腺中关键脂质TG的热氧化条件为:100 ℃,25 min,水分6 μL,有氧条件;肝胰腺中关键脂质PE的热氧化条件为:100 ℃,25 min,水分0 μL,有氧条件。本研究对关键脂质进行热氧化体系的构建,为脂质分子种、脂肪酸以及挥发性物质的测定提供反应条件,从而确定关键脂质分子种,为脂质热氧化降解特性的研究提供基础。
