溶氧对L-羟脯氨酸发酵的影响及其控制
2018-10-16,,,
, , ,
(1.天津科技大学生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.吉林大学 生物与农业工程学院,吉林 长春 130022)
羟脯氨酸是脯氨酸羟基化后的产物[1],它有四种立体异构体,分别为顺式-3-羟脯氨酸、反式-3-羟脯氨酸、顺式-4-羟脯氨酸和反式-4-羟脯氨酸,其中反式-4-羟脯氨酸(文中均称为L-羟脯氨酸)在自然界中较为常见,并且被广泛应用于医药、化工、食品和美容等行业.L-羟脯氨酸可以用于合成消炎药、碳青霉烯类等化学药物的合成[2-3];可以作为手性催化剂催化许多不对称反应[4];还可以作为化妆品添加剂用来改善饮料风味.目前国内生产L-羟脯氨酸的主要方法是从胶原中提取,但生物提取法具有成本高、收率低和污染严重等弊端[5];化学合成法同样具有成本高的缺点[6].随着代谢工程等技术的不断发展,以及微生物发酵法生产氨基酸所展现出来的优势[7-8],使得发酵法成为一种最具前景的L-羟脯氨酸生产方法.
采用发酵法生产氨基酸时,溶氧是限制大肠杆菌高密度发酵的一个关键因素,不适宜的溶氧水平会对菌体代谢产生影响,从而影响目的产物的积累.L-羟脯氨酸发酵生产需要消耗大量的氧气[9],过低的溶氧水平会限制L-羟脯氨酸的高效生产,同时会导致副产物乙酸的大量积累,对菌体生长和蛋白表达产生抑制作用.而过高的氧含量会加快细胞内部酶的氧化过程,造成菌体提前衰老,最终导致产量下降.因此,研究了不同溶氧水平对L-羟脯氨酸发酵的影响,并提出一种分阶段溶氧控制策略,对L-羟脯氨酸工业发酵生产具有重要意义.
1 材料与方法
1.1 菌 种
Escherichiacoli4HYP,由天津科技大学代谢工程研究室保藏.
1.2 培养基
1.2.1 斜面培养基
蛋白胨10 g/L,酵母粉5 g/L,KH2PO41 g/L,MgSO40.4 g/L,NaCl 10 g/L,琼脂20 g/L.
1.2.2 种子培养基
葡萄糖30 g/L,酵母粉6 g/L,柠檬酸0.5 g/L,(NH4)2SO41 g/L,KH2PO42 g/L,VB11 mg/L,VH0.3 mg/L.
1.2.3 发酵培养基
发酵培养基:葡萄糖10 g/L,(NH4)2SO41 g/L,酵母粉3 g/L,柠檬酸0.5 g/L,KH2PO44 g/L,MgSO4·7H2O 1.5 g/L,MnSO4·H2O 10 mg/L,FeSO4·7H2O 0.1 g/L,VB15 mg/L,VH0.2 mg/L.
1.3 培养方法
1.3.1 菌种活化
在无菌条件下,用接种环取2环菌种接种于斜面培养基上,恒温培养箱中37 ℃静置培养12 h后,将其接种于250 mL茄形瓶中,37 ℃培养12 h.
1.3.2 种子培养
在无菌条件下,用无菌水将活化好的菌种进行悬浮,再将其接种于5 L发酵罐中,自动控制温度为37 ℃,pH 7.0~7.2,通过调节搅拌转速和通风量控制溶氧在25%~30%,待菌体OD600大约达到15时,准备接入发酵培养基.
1.3.3 发酵培养
在30 L发酵罐中,以发酵培养基10%的接种量进行接种,接种后发酵液体积为14 L.控制培养温度为37 ℃,通过自动流加25%的氨水溶液控制pH为7.0~7.2,通过对搅拌转速、通风量和罐压的调节使溶氧保持在相应的水平,当培养基中底糖耗尽时,以一定的脉冲比自动流加80%的葡萄糖溶液,将发酵液中残糖浓度控制在1%左右.发酵过程中,每隔2 h取样、测样、记录数据.
1.4 分析方法
1.4.1 溶氧及pH的检测
溶氧是采用发酵罐连接的溶氧电极进行检测;pH是采用发酵罐连接的pH电极和精密pH试纸(6.4~8.0)进行检测[10].
1.4.2 菌体浓度的检测
见参考文献[11].
1.4.3 L-羟脯氨酸和乙酸含量的检测
见参考文献[12].
1.4.4 糖酸转化率的计算方法
糖酸转化率=

2 结果与分析
为了研究不同溶氧水平对L-羟脯氨酸发酵的影响,分别使发酵溶氧维持在10%~20%,20%~30%和30%~40%,对发酵过程中菌体生长情况、L-羟脯氨酸产量、糖酸转化率和副产物乙酸积累量进行考察,确定L-羟脯氨酸发酵的最佳供氧方式.
2.1 溶氧对菌体生长和L-羟脯氨酸产量的影响
在不同的溶氧水平下进行L-羟脯氨酸的发酵,发酵过程中菌体生长情况如图1所示,L-羟脯氨酸产量如图2所示.

图1 不同溶氧水平对菌体生长的影响Fig.1 Effect of different levels of dissolved oxygen on the growth of bacteria

图2 不同溶氧水平对L-羟脯氨酸质量浓度的影响Fig.2 Effect of different levels of dissolved oxygen on L-hydroxyproline production
溶氧对氨基酸发酵有很大影响,溶氧过高会抑制菌体生长,并加速菌体衰老,过低也会对菌体代谢产生影响[13].由图1和图2可知:采用不同的溶氧水平进行L-羟脯氨酸发酵时,发酵过程中菌体生长和产物积累情况差异明显.从菌体生长情况来看,当发酵过程中溶氧维持在10%~20%时,菌体OD600为115.1,随着溶氧提高到20%~30%,菌体OD600显著提高,达到了125.4,而将溶氧继续提高至30%~40%后,菌体OD600大幅下降,仅为96.4,与溶氧水平在20%~30%的OD600相比,降低了23.1%.从L-羟脯氨酸积累情况来看,10%~20%的溶氧水平难以满足菌体产酸需要,此时,L-羟脯氨酸质量浓度只有32.4 g/L;当发酵溶氧维持在30%~40%时,发酵前24 h,菌体表现出较高的产酸能力,但24 h之后,由于较高的溶氧使菌体早衰,导致产酸速率下降,发酵结束时,L-羟脯氨酸质量浓度为36.5 g/L;当采用20%~30%的溶氧进行发酵时,L-羟脯氨酸质量浓度最高,达到42.0 g/L,较10%~20%溶氧下的质量浓度提高了29.6%.
2.2 溶氧对糖酸转化率和乙酸积累量的影响
重组大肠杆菌发酵过程中,乙酸是主要的代谢副产物,它的积累会抑制菌体生长和重组蛋白的表达,而供氧不足是乙酸产生的一个主要原因[14].实验过程中,不同溶氧水平对糖酸转化率和乙酸质量浓度的影响如图3所示.

图3 不同溶氧水平对糖酸转化率和乙酸质量浓度的影响Fig.3 Effect of different levels of dissolved oxygen on the glucose conversion rate and accumulation of acetic acid
由图3可知:分别采用10%~20%,20%~30%和30%~40%的溶氧进行发酵时,当溶氧在20%~30%时,糖酸转化率最高,为19.8%,此条件下的乙酸质量浓度为2.8 g/L;当溶氧为10%~20%时,因溶氧无法满足菌体生长和产酸需要,糖酸转化率有所下降,与20%~30%溶氧条件下的糖酸转化率相比,下降了6.7%,并且此时较低的溶氧限制了菌体的呼吸,使得乙酸质量浓度达到5.4 g/L;当溶氧为30%~40%时,乙酸质量浓度最低,仅有1.4 g/L,但该溶氧条件下的糖酸转化率最低,为16.3%.因此,在三种不同的溶氧水平范围内,20%~30%的溶氧最有利于L-羟脯氨酸发酵.
2.3 分阶段溶氧控制策略的提出及验证
微生物发酵的目的在于使底物的消耗尽可能多的转化为目的产物[15].为了提高整个发酵过程中L-羟脯氨酸的产率,在上述实验的基础上提出分阶段溶氧控制策略,即在发酵前期(0~8 h),将溶氧维持在20%~30%;发酵中期(8~24 h),菌体快速增殖和产酸需要消耗大量的氧气,此阶段将溶氧控制在30%~40%;发酵后期(24~32 h),菌体代谢减弱,耗氧量减少,将溶氧降至20%~30%.按照该溶氧控制策略进行发酵,实验结果如图4,5所示.
由图4可知:采用分阶段溶氧控制策略进行L-羟脯氨酸发酵时,发酵32 h,菌体OD600达到128.7,与溶氧为20%~30%的恒定供氧发酵相比,菌体总量稍有增长,L-羟脯氨酸产量达45.3 g/L,提高了7.9%.由图5可知:分阶段供氧下糖酸转化率为20.7%,乙酸积累量为1.7 g/L,与20%~30%的恒定供氧发酵相比,糖酸转化率提高了4.5%,乙酸积累量减少了39.3%.可见,采用分阶段溶氧控制策略既有利于菌体生长,促进产物高效合成,又能够有效降低副产物乙酸的形成,使整个发酵过程表现出良好的状态.

图4 分阶段溶氧控制策略下OD600和L-羟脯氨酸质量浓度Fig.4 The OD600and L-hydroxyproline production under the strategy of staged dissolved oxygen control
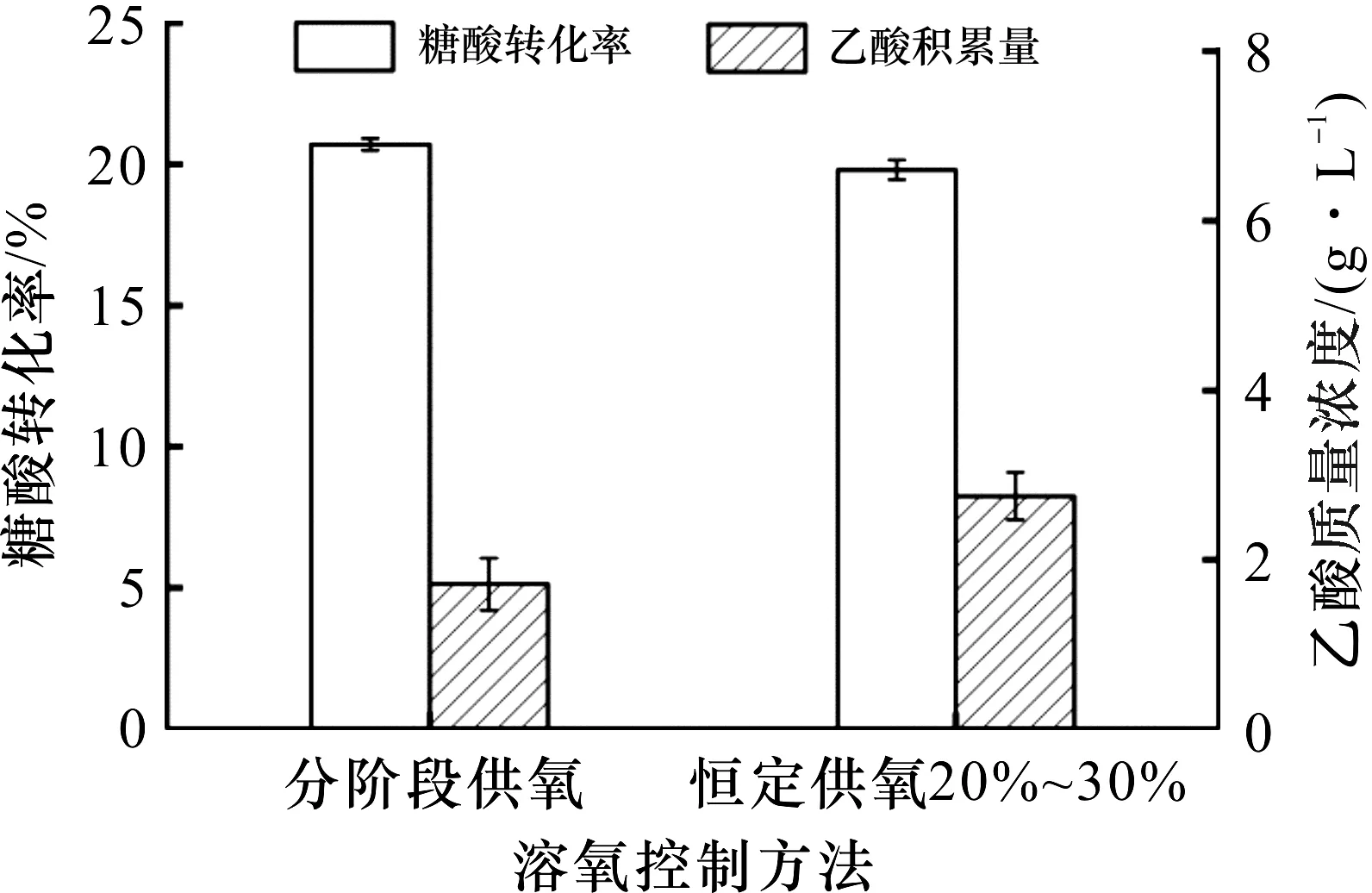
图5 不同溶氧控制方法对糖酸转化率和乙酸质量浓度的影响Fig.5 Effect of different dissolved oxygen control methods on the glucose conversion rate and accumulation of acetic acid
3 结 论
溶氧对氨基酸的发酵生产具有重要影响,发酵液中溶氧水平的高低会直接影响微生物体内的酶活和代谢,进而影响菌体生长和产物积累[16].研究了不同溶氧水平对L-羟脯氨酸发酵的影响,结果表明:10%~20%的溶氧水平不能满足L-羟脯氨酸的发酵需要,并且会导致副产物乙酸的大量积累;30%~40%的溶氧较高,会使菌体提前衰老,导致L-羟脯氨酸产量和糖酸转化率偏低;而将溶氧维持在20%~30%时,菌体OD600、L-羟脯氨酸产量和糖酸转化率较高.在确定了不同溶氧水平下的发酵情况后,提出一种分阶段溶氧控制策略,即发酵前期(0~8 h),溶氧维持在20%~30%;发酵中期(8~24 h),溶氧控制在30%~40%;发酵后期(24~32 h),溶氧维持在20%~30%.结果表明:采用分阶段溶氧控制策略使L-羟脯氨酸发酵整个过程表现出良好的状态,发酵32 h,菌体OD600为128.7,L-羟脯氨酸产量达45.3 g/L,糖酸转化率达到20.7%,乙酸积累量仅有1.7 g/L.
