中国水仙NtMYB7基因的克隆及功能初步研究
2018-10-16王桂青吴嘉诚MUHAMMADAnwar曾黎辉
王桂青,姚 红,吴嘉诚,MUHAMMAD Anwar,曾黎辉
(福建农林大学 园艺学院,福州 350002)
中国水仙(Narcissustazettavar.chinensis)是中国十大传统名花之一,是一类观赏价值极高的经济植物[1-2]。然而水仙花色单调、品种单一,制约着水仙产业的进一步发展。花颜色的形成主要是由类黄酮、类胡萝卜素和生物碱三类物质决定。其中,属于类黄酮类物质的花青素(anthocyanin)为天然水溶性色素, 决定绝大多数植物的花色, 可以使花朵呈现出红、粉、蓝和紫等颜色[3-4]。类黄酮代谢还有原花青素代谢、黄酮醇代谢等其他代谢分支途径,黄酮醇途径中黄酮醇能和花青素共同作用使植物呈现丰富多彩的颜色[5]。中国水仙花色以黄白色为主,主要原因是缺乏花青素[6]。植物中很多调控黄酮类次生代谢的转录因子,主要包括编码MYB、MYC、bZIP 蛋白、WD40蛋白和锌指蛋白等基因家族[7]。MYB基因家族广泛存在于植物中,高等植物中绝大多数的MYB基因都属于R2R3-MYB,它们广泛参与植物次生代谢调控,并对细胞分化、植物形态建成及抗病具有重要的调节作用[8-16]。R2R3类MYB转录因子在类黄酮代谢途径产生色素的次生代谢过程中发挥重要调控作用[17],R2R3-MYB转录因子主要通过与类黄酮代谢途径中某些关键酶基因启动子中的重要顺式作用元件结合,从而调控类黄酮生物合成途径中一个或多个酶基因的表达,有效地调节类黄酮生物合成途径[7]。
R2R3-MYB转录因子的共同特征是在其N端都具有一段高度保守的MYB结构域[18],在C端有一个激活或抑制的结构域[19]。目前已经发现的类黄酮代谢途径R2R3-MYB激活因子有葡萄中的VvMYB1[20]、草莓中的FaMYB10[21]以及拟南芥中的AtMYB75、AtMYB90、AtMYB113等[22]。调控类黄酮合成的MYB基因,并非全都是正向调控作用,有些起负调控作用,抑制目标基因的表达,如拟南芥中的AtMYB3、AtMYB4、AtMYB7、AtMYB32等[23]以及棉花中的GhMYBL2[24]等,都是抑制因子,它们通过与靶基因启动子结合来抑制结构基因转录;草莓中的FaMYB1也是抑制因子,其通过竞争占据MBW复合体中其他MYB蛋白的结合位点,以此抑制花青素合成相关基因的转录[25-26];此外,拟南芥中发现的R2R3-MYB蛋白AtMYBL2能直接与MBW复合体中的关键bHLH蛋白TT8结合形成复合体,进而抑制花青素的合成[27-28]。Xu等[29]在银杏(Ginkgobiloba)中发现了类黄酮合成的负调控MYB蛋白GbMYBF2,并通过转化拟南芥证实了它的功能。然而在单子叶植物中,对类黄酮合成起负调控作用的MYB基因研究相对较少。
本实验从水仙鳞茎盘转录组中筛选得到一个R2R3-MYB转录因子,命名为NtMYB7。用RT-PCR技术克隆该基因cDNA编码区全长序列,采用生物信息学方法对其进行序列分析,荧光定量PCR检测该基因在水仙不同部位不同发育时期的表达以及利用烟草瞬时表达对基因功能进行初步研究。研究结果为进一步了解NtMYB7基因的功能奠定基础,而且有助于进一步探究中国水仙不能合成花青素的分子机制。
1 材料和方法
1.1 材 料
以漳州水仙‘金盏银台’为试验材料,分别采集中国水仙成花过程不同时期的花瓣和副冠,以及鳞茎盘、叶片,用液氮速冻,立即放入-80 ℃冰箱中贮存备用。
瞬时表达实验以普通烟草(Nicotianatabacum)为实验材料,将普通烟草种子播种于土中,待其生长出4片真叶后用于后续试验。
多糖多酚植物总RNA提取试剂盒购于北京百泰克生物技术有限公司;cDNA第一链合成试剂盒购于Thermo公司的RevertAid First Strand cDNA Synthesis Kit。
1.2 方 法
1.2.1总RNA的提取及cDNA第一链的合成参照RNA提取试剂盒的方法,提取中国水仙‘金盏银台’总RNA。利用紫外分光光度计Q-5000检测RNA的浓度和纯度,1%琼脂糖凝胶检测RNA条带的完整性和清晰度;按照ReverAidTMFirst-Strand cDNA Synthesis Kit试剂盒说明书合成cDNA的第一条链,放入-20 ℃冰箱中备用。
1.2.2PCR引物的设计与合成利用DNAMAN设计引物(表1),引物合成及基因测序工作均委托由上海铂尚生物技术有限公司完成。
1.2.3NtMYB7基因cDNA的克隆以鳞茎盘cDNA为模板,进行PCR扩增。反应体系为25 μL,其中10×Ex-Taq缓冲液 2.5 μL,dNTPs(10 mmol/L)0.5 μL,上下游引物(10 μmol/L)各0.5 μL,模板cDNA 1 μL,Ex-Taq(5 U /μL)0.2μL,加水至终体积25 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃ 变性30 s,60 ℃ 退火30 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min。PCR反应结束后,经1%琼脂糖凝胶电泳检测,目的片段的回收按照Omega胶回收试剂盒的操作流程进行,并按照全式金pEASY-T1 Simple Cloning Kit说明连接至pEASY-T1载体,热激法转化大肠杆菌DH5α,筛选阳性克隆进行测序。
1.2.4生物信息学分析基因的分子特征分析主要采用生物信息学方法,利用DNAMAN软件进行序列比对和蛋白质翻译;利用Blastn和Blastx(http://blast.ncbi.nlm.Nih,gov/Blast.c)进行核苷酸及蛋白质同源性搜素;利用MEGA7.0软件的邻接法(Neighbor-Joining,NJ)构建系统发育进化树。
1.2.5NtMYB7在中国水仙花不同发育阶段和不同部位的表达以中国水仙‘金盏银台’Actin基因为内参基因,荧光定量PCR研究NtMYB7在鳞茎盘、叶片以及3个发育时期的花瓣和副冠(花苞期、始花期和盛花期)的表达,引物见表1,在罗氏LightCycler 480荧光定量PCR仪上进行。将合成的cDNA(500 ng/μL)稀释10倍作为模板,反应体系为20 μL:2×SYBR Premix ExTaqⅡ10 μL,上下游引物(10 μmol/L)各0.8 μL,cDNA模板1 μL,ddH2O 6.4 μL,每个样品进行3次技术重复。PCR反应程序采用两步法:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环(PCR反应过程);95 ℃ 5 s,60 ℃ 1 min(熔解曲线分析过程)。根据荧光定量PCR目的基因NtMYB7和内参基因Actin的Ct值,利用2-ΔΔCt方法[30]对NtMYB7基因在不同发育阶段和不同部位相对表达量进行分析,利用q检验法进行显著性差异分析。
1.2.6NtMYB7基因植物表达载体的构建采用In-Fusion方法构建载体,按照In-Fusion HD Cloing Kit试剂盒说明进行。首先按要求设计新的引物(表1),PCR扩增NtMYB7目的基因,以pSAK277为表达载体,通过EcoRI和HindⅢ双酶切及连接反应,正向接入到表达载体中。将重组载体pSAK277-NtMYB7导入农杆菌GV3101感受态细胞中。完成载体构建后,挑取阳性克隆菌落,采用菌液PCR检测以及双酶切鉴定,最后送生物公司测序,验证载体是否构建成功。
1.2.7烟草瞬时表达及定量分析首先将甘肃农业大学刘玉汇博士赠送的花青素R2R3-MYB激活因子StMYB以及StbHLH的表达载体pSAK277-StMYB、pSAK277-StbHLH[31]以及对照质粒pBI121(含有GUS基因)转入农杆菌GV3101中。分别挑取农杆菌菌落于YEB培养基中,摇菌过夜至OD600为0.6~0.8。将菌液分别置于50 mL离心管中,4 000 r·min-1离心5 min,再用重悬缓冲液(10 mmol/L MES,150 μmol/L AS, 10 mmol/L MgCl2)重悬调至OD600为0.6,静置3 h。按照1∶1比例混合不同质粒后,用注射器分别注射烟草叶片:1)单独注射StMYB;2)StMYB+pBI121;3)单独注射NtMYB7;4)StMYB+NtMYB7;5)StMYB+NtMYB7+StBHLH。每个处理重复3次。
将注射后的烟草放入培养室中,经过4~5 d后观察叶片颜色变化,同时提取烟草注射部位以及未注射正常烟草的叶片RNA,逆转录成cDNA后,通过实时荧光定量PCR检测烟草类黄酮代谢途径中PAL(phenylalanine ammonia lyase)、4CL(4-coumarate:CoA ligase)、CHS(chalcone synthase)、CHI(chalcone isomerase)、F3H(flavonoid 3-hydroxylase)、F3′H(flavonoid 3′-hydroxylase)、FLS(flavonol synthase)、DFR(dihydroflavonol 4-reductase)、LAR(Leucoanthocyanidin reductase)、ANS(anthocyanidin sythase)、ANR(anthocyanidin reductase)、UFGT(UDP-glucose-flavonoid3-o-glucosyltransferase)等结构基因的表达情况,引物见表2。
表1 引物及其序列
注:下划线表示同源片段
Note: The horizontal lines indicate the homologous fragment

表2 烟草荧光定量PCR所用引物
2 结果与分析
2.1 NtMYB7基因的克隆和序列分析
特异性引物RT-PCR扩增NtMYB7 cDNA编码全长序列,得到与预期基因片段大小一致的条带(图1)。测序结果显示,开放阅读框(ORF)全长为753 bp,编码250个氨基酸,GenBank登录号MF522208。
2.2 NtMYB7基因编码蛋白的生物信息学分析
DNAMAN分析比对结果(图2)发现,该基因编码蛋白存在明显的R2和R3保守结构域,属于R2R3-MYB蛋白。 经Blast比对发现,该序列与NCBI上已登录的多种植物R2R3-MYB基因编码蛋白相似性较高,其中与芦笋Myb4-like、油棕Myb4-like、海枣Myb4-like和香蕉亚种Myb4相似性分别为57%、57%、54%和53%。通过MEGA7.0软件,将NtMYB7蛋白与其他物种MYB基因编码蛋白构建系统进化树分析发现,NtMYB7与AtMYB3等MYB4-like花青素合成抑制因子聚在一起(图3)。进化树中花青素合成激活因子单独聚为一类;花青素合成抑制因子分成3类,其中R2R3-MYB有MYB4-like和FaMYB1-like两个亚类,R3-MYB抑制因子与其他MYB基因编码蛋白亲缘关系较远。
2.3 NtMYB7在中国水仙花不同发育阶段和不同部位的表达

M. DL2000;1. NtMYB7扩增产物图1 NtMYB7基因的克隆M. DL2000;1. PCR products of NtMYB7 geneFig.1 Cloning of NtMYB7 from Chinese narcissus
荧光定量PCR结果显示,NtMYB7的表达水平在不同的部位不同,鳞茎盘中表达量最高,表达量是花苞期花瓣表达量的近20倍。在花瓣中,NtMYB7基因的相对表达量随着水仙花的开放逐渐升高,盛花期达到最高;在副冠中,始花期表达量最高,花苞期和盛花期表达量较低(图4)。
2.4 烟草瞬时表达结果
将NtMYB7构建植物表达载体,对重组质粒进行菌落PCR鉴定、双酶切琼脂糖凝胶电泳及测序分析均显示载体构建成功(图5)。
NtMYB7注射烟草叶片进行瞬时表达研究。如图6,单独注射花青素激活因子StMYB的烟草叶片明显呈现深红色;对照带有GUS基因的pBI121与StMYB混合注射叶片也呈现深红色,与单独注射StMYB差别不大;单独注射NtMYB7部位烟草叶片无反应,呈现浅绿色;将NtMYB7与StMYB混合注射叶片呈现淡红色;注射StMYB+NtMYB7+StbHLH三个基因混合物的叶片也呈现淡红色,但比NtMYB7与StMYB混合注射颜色略深。

NtMYB7. 水仙;AtMYB4. 拟南芥;AtMYB32. 拟南芥;AmMYB308. 金鱼草;PhMYB4. 矮牵牛;VvMYB4A. 葡萄;BrMYB4. 甘蓝型油菜;GhMYB4. 棉花;FaMYB1. 草莓图2 NtMYB7与R2R3-MYB氨基酸序列的多重序列比对NtMYB7. Narcissus tazetta var.chinensis;AtMYB4. Arabidopsis thaliana;AtMYB32. Arabidopsis thaliana;AmMYB308. Antirrhinum;PhMYB4. Petunia hybrida;VvMYB4A. Vitis vinifera;BrMYB4. Brassica rapa subsp. rapa;GhMYB4. Gossypium hirsutum;FaMYB1. Fragaria ananassa;Fig.2 Multiple alignment of the NtMYB7 with other R2R3-MYB proteins
2.5 烟草叶片中结构基因表达的瞬时检测
烟草叶片中结构基因瞬时表达的定量PCR结果(图7)显示,单独注射NtMYB7的叶片中,PAL、4CL的表达显著上调;FLS的表达量显著下调,对照未注射的烟草叶片中FLS的表达量是注射NtMYB7叶片的近14倍;NtMYB7还抑制CHS、CHI、F3H、F3′H、ANR和UFGT的表达;由于烟草中DFR、LAR、ANS的表达量太低,不能判断出NtMYB7是否抑制这几个基因的表达(图7)。
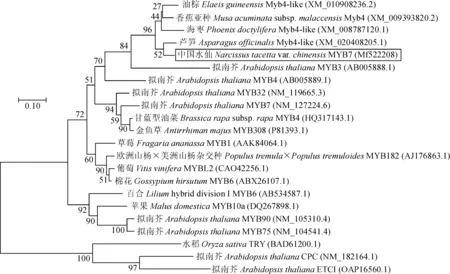
图3 NtMYB7与类黄酮相关MYB因子的系统进化树分析Fig.3 Phylogenetic tree of NtMYB7 and other flavonoid related MYBs

1P. 花苞期花瓣;2P. 始花期花瓣;3P. 盛花期花瓣;1C. 花苞期副冠:2C. 始花期副冠;3C. 盛花期副冠;L. 叶片;B. 鳞茎盘;不同小写字母表示组织间差异显著(P<0.05)图4 NtMYB7基因在水仙中不同发育阶段和不同组织的表达1P. Petals of budding stage;2P. Petals of early flowering stage;3P. Petals of full-bloom stage;1C. Coronas of budding stage;2C. Coronas of early flowering stage;3C. Coronas of full-bloom stage;L. Leaf;B. Basal plate;The different normal letters indicate significant differences among organs (P<0.05)Fig.4 Relative expression of NtMYB7 gene at different development stages and organs in Chinese narcissus
除FLS和ANR外,烟草中类黄酮生物合成途径中的结构基因PAL、4CL、CHS、CHI、F3H、F3′H、DFR、LAR、ANS、ANR和UFGT的表达都被StMYB诱导显著上调(图8);在StMYB和NtMYB7混合注射的叶片中,除PAL和4CL外,被StMYB诱导上调表达的结构基因的表达量都显著下调,说明NtMYB7抑制这些基因的表达;StMYB、NtMYB7和StBHLH三者混合注射叶片中,与StMYB和NtMYB7混合注射叶片中一样,烟草CHS、CHI、F3H、F3′H、DFR、LAR、ANS和UFGT的表达量都下降(图8)。
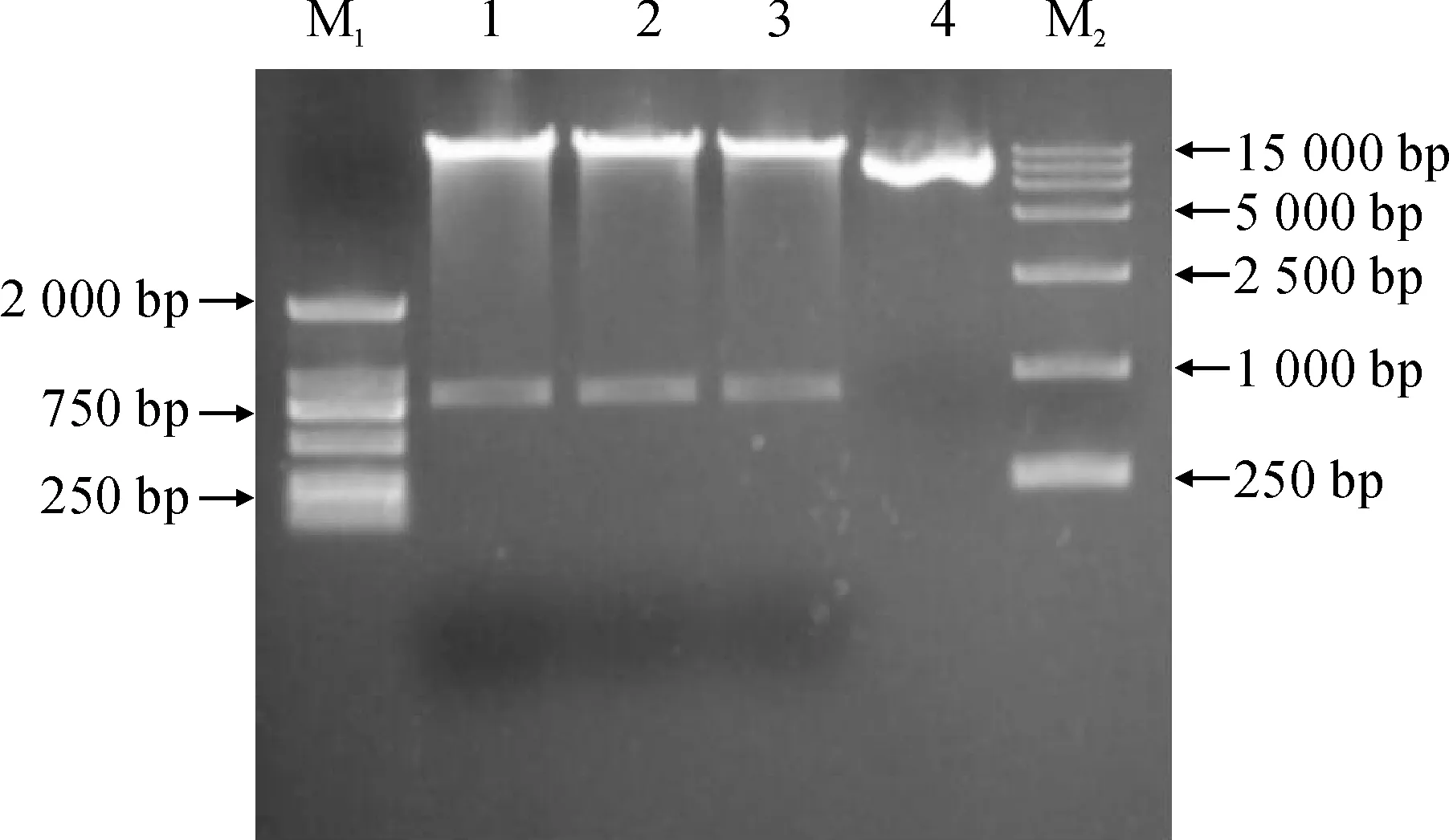
M1. DL2000;1~3. 重组质粒酶切产物;4. 重组质粒;M2. DL15000图5 重组质粒pSAK277-NtMYB7双酶切鉴定M1. DL2000;1-3. Enzyme digestion products of recombinant plasmid;4. Recombinant plasmid;M2. DL15000Fig.5 Enzyme digestion identification of recombinant plasmid pSAK277-NtMYB7
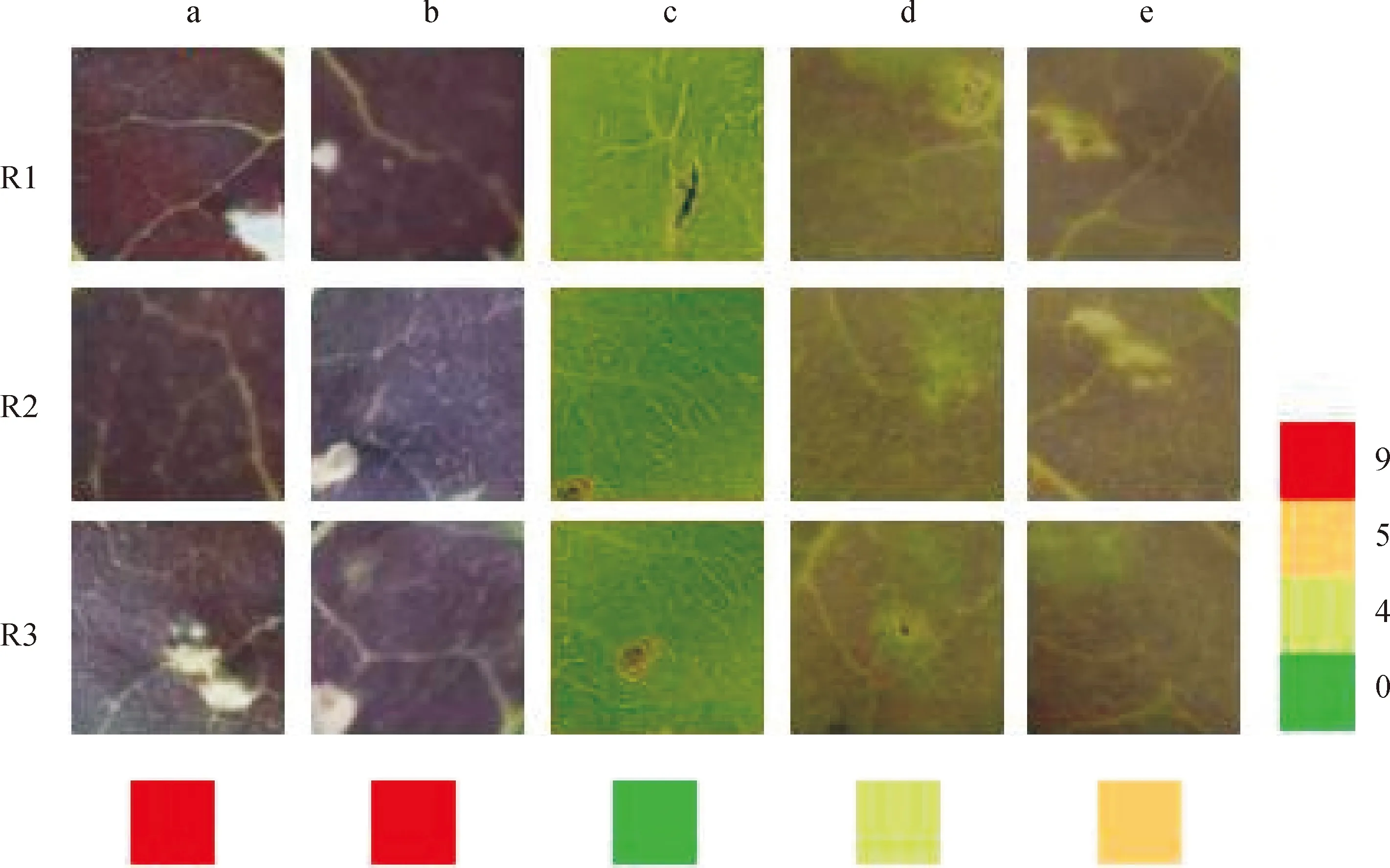
R1~R3. 3个重复;a.StMYB;b.StMYB+pBI121;c.NtMYB7;d.StMYB+NtMYB7;e.StMYB+NtMYB7+StBHLH;0~9.不同色块表示注射不同基因后的颜色差异图6 NtMYB7烟草瞬时表达R1-R3. 3 repetitions;a.StMYB;b.StMYB+pBI121;c.NtMYB7;d.StMYB+NtMYB7;e.StMYB+NtMYB7+StBHLH;0-9. Different color-blocks indicate the color difference after different gene injectionFig.6 Transient expression analysis of NtMYB7 in tobacco

WT. 野生型(未注射的烟草叶片);NtMYB7. 单独注射NtMYB7的烟草叶片;PAL.苯丙氨酸解氨酶;4CL.辅酶a连接酶;CHS.查耳酮合酶;CHI.查耳酮异构酶;F3H.类黄酮3;F3′H.类黄酮3′;FLS.黄酮醇合酶;DFR.二氢黄酮醇4-还原酶;LAR.无色花色素还原酶;ANS.花青素合成酶;ANR.花青素还原酶;UFGT.类黄酮糖基转移酶。下同图7 瞬时表达烟草叶片中结构基因的表达WT. Wild type(Non-injected tobacco leaf);NtMYB7. Separate injection NtMYB7;PAL.Phenylalanine ammonia lyase;4CL.4-coumarate CoA ligase;CHS.Chalcone synthase;CHI.Chalcone isomerase;F3H.Flavonoid 3-hydroxylase;F3′H.Flavonoid 3′-hydroxylase;FLS.Flavonol synthase;DFR.Dihydroflavonol 4-reductase;LAR.Leucoanthocyanidin reductase;ANS.Anthocyanidin sythase;ANR.anthocyanidin reductase, UFGT.UDP-glucose-flavonoid3-o-glucosyltransferase. The same as below.Fig.7 Expression analysis of structural genes in transient expression leaves of tobacco
3 讨 论
拟南芥中R2R3-MYB基因根据保守元件的不同被分为22个不同的亚族,其中拟南芥S4亚家族、S5亚家族、S6亚家族、S7亚家族基因参与花青素和类黄酮类化合物生物合成途径中相关结构基因的转录调控[32-35]。通过系统进化树比对分析发现,NtMYB7同拟南芥S4家族中的AtMYB3、AtMYB4有较高的相似性[36],属于R2R3-MYB抑制基因中MYB4-like类,表明NtMYB7的基因功能可能与MYB4-like类抑制因子相似,发挥转录抑制作用,使类黄酮生物合成途径的某些结构基因的表达受阻。
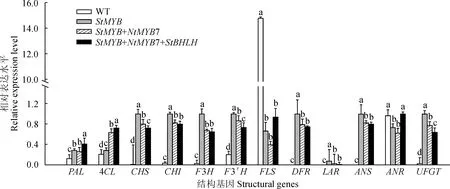
WT.野生型(未注射的烟草叶片);StMYB. 单独注射StMYB的烟草叶片;StMYB+NtMYB7. 注射StMYB+NtMYB7的烟草叶片; StMYB+NtMYB7+StBHLH. 注射StMYB+NtMYB7+StBHLH的烟草叶片;不同小写字母表示处理间差异显著(P<0.05)图8 瞬时表达烟草叶片中结构基因的表达WT. Wild type(Non-injected tobacco leaf);StMYB. Separate injection StMYB;StMYB+NtMYB7. Injection StMYB+NtMYB7;StMYB+NtMYB7+StBHLH. Injection StMYB+NtMYB7+StBHLH;The normal letters indicate significant differences among treatments (P<0.05)Fig.8 Expression analysis of structural genes in transient expression leaves of tobacco
瞬时表达实验中,花青素激活因子StMYB诱导烟草叶片生成花青素的作用被NtMYB7抑制,证明了NtMYB7是花青素合成的抑制因子,但是抑制效果较弱;单独注射NtMYB7叶片中FLS的表达被显著抑制,说明NtMYB7可能抑制黄酮醇代谢分支途径;在StMYB和NtMYB7混合注射的叶片中,原花青素代谢途径的关键基因LAR和ANR的表达量也下降,说明NtMYB7也会抑制原花青素代谢途径。因此,NtMYB7可能同时抑制类黄酮代谢途径不同分支的代谢,是类黄酮合成途径的抑制因子。研究发现,从白色智利草莓(Fragariachiloensis)中分离出的FaMYB1的同源蛋白FcMYB1可能通过下调表达ANS,上调表达原花青素合成关键基因ANR和LAR来决定该草莓果实的无色表型[37]。银杏(Ginkgobiloba)中发现的MYB4-like类转录抑制因子GbMYBF2在拟南芥中的过表达能显著抑制花青素及黄酮类物质的生成,并且类黄酮合成途径中的CHS、F3H、FLS、ANS等结构基因表达均受到抑制[38]。单子叶植物花青素合成抑制因子的报道较少,瞬时表达结果显示NtMYB7可以抑制类黄酮合成途径的大部分基因。
FaMYB1、GbMYBF2等R2R3-MYB蛋白均含有保守的抑制基序pdLNLD/ELxiG/S,相关研究表明拥有保守抑制基序的蛋白,其作用机制主要为主动抑制[39]。还有一些特殊的R2R3-MYB因子,不含EAR抑制基序,但在某些特定条件下也能抑制花青素的积累。如拟南芥AtMYB60,在莴苣(Lactucasativa)中过表达该基因时,转化植株由野生型红叶表型变为绿叶表型,相应的DFR表达也下调[40]。苹果MdMYB6也没有保守抑制域,在高浓度蔗糖处理条件下MdMYB6能使大部分结构基因的表达下调,抑制花青素的积累[41]。序列分析表明NtMYB7不含pdLNLD/ELxiG/S保守抑制基序,这可能与其抑制效果较弱有关,有待进一步研究。在瞬时表达中,向NtMYB7+StMYB混合液中加入StBHLH进行注射,颜色有所加深。NtMYB7的抑制作用是通过直接抑制结构基因的表达或者与激活因子竞争bHLH有待进一步研究。
荧光定量实验结果中,NtMYB7基因在水仙不同器官中的表达量分析表明,NtMYB7在鳞茎盘中表达量最高。中国水仙鳞茎盘中的黄酮类物质主要是原花青素,花中的黄酮类物质主要是黄酮醇[6],NtMYB7有可能在鳞茎盘中主要抑制黄酮醇和花青素的合成,而在花瓣和副冠中主要抑制花青素和原花青素的合成,但这个推测有待进一步的验证。
