河南民权地区赤霞珠葡萄表皮酵母菌的多样性研究
2018-10-16张俊杰尚益民程大伟宋玉婷陈锦永刘崇怀
张俊杰,尚益民,程大伟,宋玉婷,杨 旭,陈锦永,刘崇怀
(1.中国农业科学院郑州果树研究所,河南郑州450009;2.郑州轻工业学院食品与生物工程学院,河南郑州450002)
民权县位于河南省东部,地处黄河中下游,以黄河故堤为界,南北形成两个不同的地形地貌,堤北高滩地,堤南以青沙、沙碱为主。年平均气温14.1℃,年平均降水量674 mm,无霜期213 d。赤霞珠葡萄适合种植在排水能力强的沙砾质土壤中,因此民权具备种植赤霞珠酿酒葡萄的风土条件。并且民权种植葡萄有1000多年的历史,素有葡萄之乡的美称。所以民权的葡萄园会形成一个独特、稳定的微生物群落环境,因此对于后期葡萄酒的酿造来说,研究民权葡萄园中葡萄果实表面的酵母菌的多样性就显得尤为重要。
在葡萄酒生产中,酵母对产量、质量和发酵生产管理影响很大。葡萄表面的野生酵母是最丰富的,成熟葡萄裂果流汁,促使酵母繁殖,果皮蜡质有助于这些酵母菌的附着,出现自然发酵现象[1]。在多年种植葡萄的园区,天然酵母时常在葡萄酒生产中,随同原料进入发酵罐,参与酒的酿造过程[2]。虽然有商业葡萄酒酵母可供使用,但一些葡萄酒生产商更倾向于选育葡萄产区酵母来生产具有产区特色的葡萄酒[3-4],产区酵母已经适应了本地的微环境,易于在葡萄酒发酵中占主导地位,形成产区的典型特色[5]。
传统的酿酒酵母的分类鉴定主要根据细胞繁殖类型、产孢子状况、菌落的颜色、大小和形态等,以及生理生化试验,再参照《酵母菌的特征和鉴定手册》和《微生物分类学》,进行相关菌种的鉴定,传统鉴定不仅工作量大、周期长、操作复杂且鉴定结果的重复性差[6-8]。现代分子鉴定法主要以核酸作为研究对象,研究的是基因型,而非表现型,因此能反映其遗传本质[9-11]。现代分子鉴定法具有稳定性好、易确定同源关系、便于计算机分析等优点,不仅提高了鉴定的准确度,而且缩短了鉴定时间[12]。
河南省境内目前已知葡萄属(Vitis L.)植物有14个种、1个亚种及1个变种[13]。本研究以民权地区葡萄园中酿酒葡萄赤霞珠成熟果实新鲜表皮为原料对酵母菌[14]进行分离和多样性研究,并确定了民权赤霞珠葡萄表皮所蕴含酵母菌种群的组成以及数量上的差异。对于后期葡萄酒的酿造以及提高葡萄酒的质量具有一定的指导意义,同时也会对提高民权地区葡萄酒的销量有一定的帮助。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
赤霞珠葡萄原料采自民权地区某葡萄园,标记为MQ。随机采集3棵葡萄植株的葡萄果实样品,标记为1、2、3,每棵采集3串健康的葡萄,采集日期为2017年9月21日,并在当天置于冷冻盒中运回实验室,在无菌条件下按地点收集葡萄的全部葡萄皮,备用。
1.1.2 主要培养基及试剂
培养基:YEPD和WL培养基、Ezup柱式基因组DNA抽提试剂盒(酵母)、26S rDNA D1/D2区扩增引物NL-1和NL-4,见张俊杰等人的研究[15]。
1.2 仪器与设备
SW-CJ-2D超净工作台,苏州净化安泰公司;DH-600生化培养箱,北京中兴伟业仪器有限公司;HH-S恒温水浴锅,江苏省金坛市医疗器械有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;C1000PCR扩增仪,伯乐;JY023紫外分析仪,北京君意东方电泳设备有限公司;FD-4new真空干燥机,郑州沃邦仪器设备有限公司。
1.3 实验方法
1.3.1 葡萄皮酵母菌富集、分离及纯化
实验方法参见张俊杰研究论文[15]。操作步骤为:在无菌条件下向灭过菌的YEPD(含氯霉素)液体培养基中加入葡萄浆果表皮,振荡培养48 h。梯度稀释富集液,并选择10-3、10-4、10-5共3个梯度稀释液进行YEPD固体平板涂布和培养,随机挑去单菌落进行纯化和保藏。
1.3.2 WL培养基表型鉴定及代表菌株的显微形态观察
挑取YEPD斜面上的酵母菌,在WL培养基上3次划线并倒置于恒温培养箱中28℃条件下培养5 d,对所有菌的菌落形态进行观察、描述,并拍照记录[13],然后根据菌落表型的差异,对供试菌株进行初步分类并挑选代表菌。然后对代表菌株进行显微形态的观察。显微形态观察在光学显微镜下进行,采集代表菌株的显微形态照片,并做好记录。
1.3.3 酵母菌的分子生物学鉴定
(1)酵母菌26S rDNA D1/D2区和5.8S-ITS区序列的PCR扩增及检测
酵母菌的DNA提取按照试剂盒说明书进行提取,按照过去的方法扩增26S rDNA Dl/D2区段[15]。使用正向引物ITS1和反向引物ITS4进行5.8S-ITS区基因扩增[15]。PCR反应体系及反应程序参照刘爱国等人的研究[16],结果检测参照论文[15]。
(2)PCR产物测序及系统发育分析
测序结果采用MEGA 6软件进行序列比较,具体方法同张俊杰研究论文中的方法[17]。
1.3.4 酵母菌不同种群数量分布
上述方法已经确定了各个代表菌所属种群,用Excel表格统计各个种群中各个代表菌所代表的菌株数量。
2 结果与分析
2.1 酵母菌的形态学观察及初步聚类分析
2.1.1 葡萄表皮酵母菌的分离、纯化与保藏
通过YEPD液体培养基的富集及固体培养基平板的分离和纯化,从民权地区葡萄园的赤霞珠葡萄表皮分离纯化和保藏酵母菌69株。
2.1.2 酵母菌在WL培养基上的形态、显微观察及初步聚类分析
根据69株酵母菌在WL培养基上的表型特征,一共得到11种表型,然后,通过对每个表型代表菌株的细胞显微形态观察,共得到3种显微形态,如图1。详细的描述见表1。经过菌落形态和显微形态分析,供试菌被初步分为10个类型。

图1 各类型代表菌株在WL培养基上的表型特征(左)和显微细胞特征(右)
2.2 酵母菌的26S rDNA D1/D2及5.8S-ITS区段的PCR鉴定
2.2.1 代表菌株26S rDNA D1/D2区段的PCR扩增分析
分别从以上11类菌株中挑选代表菌株MQ1-1、MQ1-14、MQ1-22、MQ1-23、MQ2-6、MQ2-15、MQ3-8、MQ3-11、MQ3-18、MQ3-21、MQ3-23 进行DNA的提取和26S rDNA D1/D2区段的PCR扩增。
2.2.2 26S rDNA D1/D2区段PCR扩增产物的测序与分析
得到的PCR产物送测序公司进行序列测定,得到的序列结果首先在NCBI主页,利用BLAST功能与Genbank数据库里的已知序列进行同源比对。选择同源性最高的菌株,一般为99%~100%,然后,选用Mega 6软件进行序列的系统发育分析,建立NJ系统发育树,如图2所示。
其中,MQ3-23与Saturnispora diversa聚为一个分支,序列相似性为100%,所以MQ3-23可以被鉴定为已知种群Saturnispora diversa。MQ3-18与Pichia terricola处在同一个分支,序列相似性为100%,因而MQ3-18可以被鉴定为Pichia terricola。代表菌株MQ1-23与Issatchenkia terricola聚在一起,序列相似性为100%,因而被鉴定为Issatchenkia terricola。代表菌 株 MQ2-15、MQ3-8 和MQ3-21与Hanseniaspora vineae处于同一分支,序列相似性为100%,故鉴定为Hanseniaspora vine-ae。而代表菌株 MQ1-1、MQ1-14、MQ1-22 和MQ2-6与已知酵母菌种群Hanseniaspora opuntiae和Hanseniaspora guilliermondii聚为一个分支,且相似性均为100%,无法对这几株菌进行种群确定,所以又对其进行5.8S-ITS区扩增,经BLAST分析及5.8S-ITS区序列相似性计算,结果见表2。据此,这几个代表菌株仅有MQ3-11归为H.guillier-mondii,而其余均归为H.opuntiae。
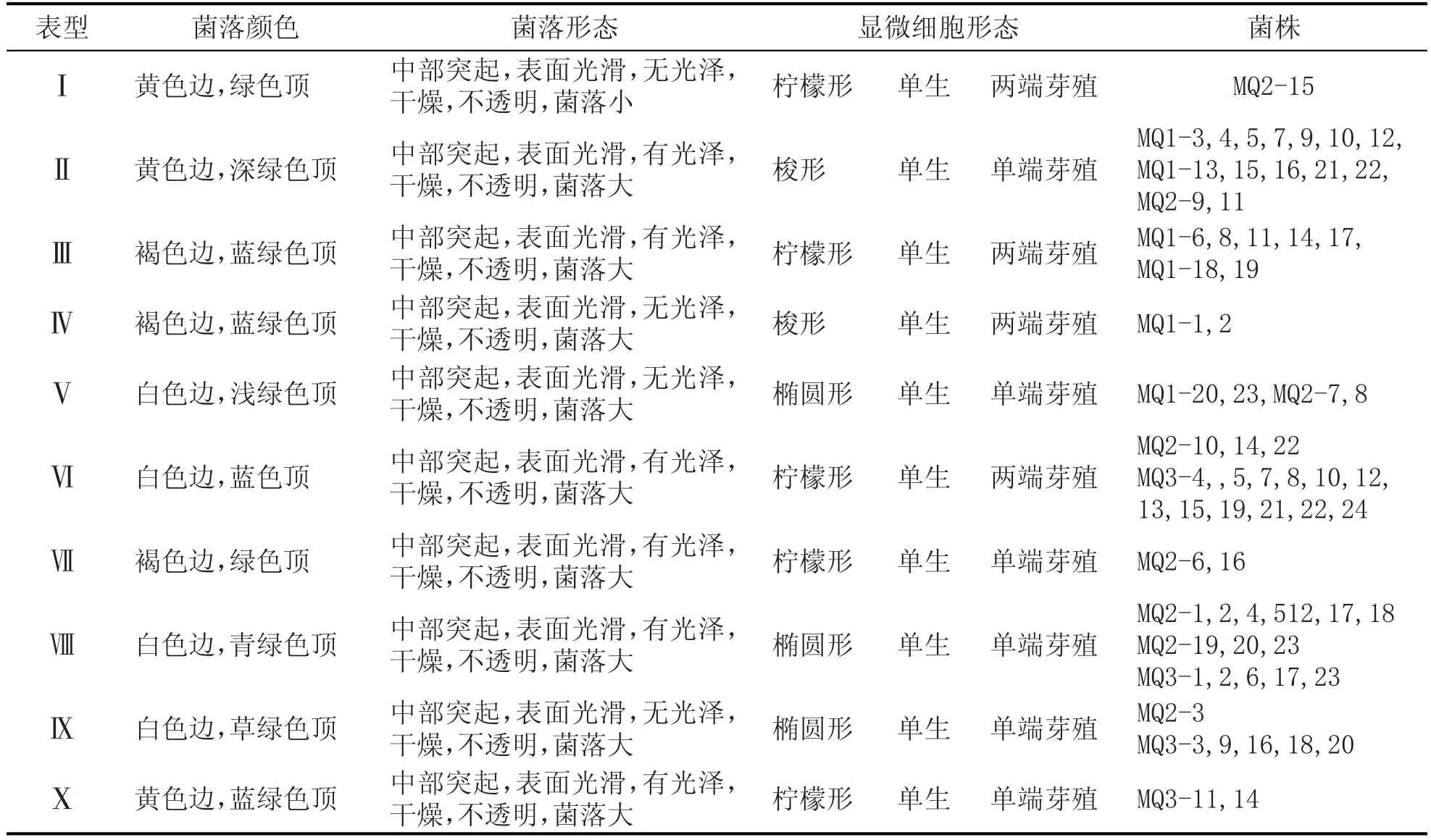
表1 酵母菌基于WL培养基的表型聚类结果
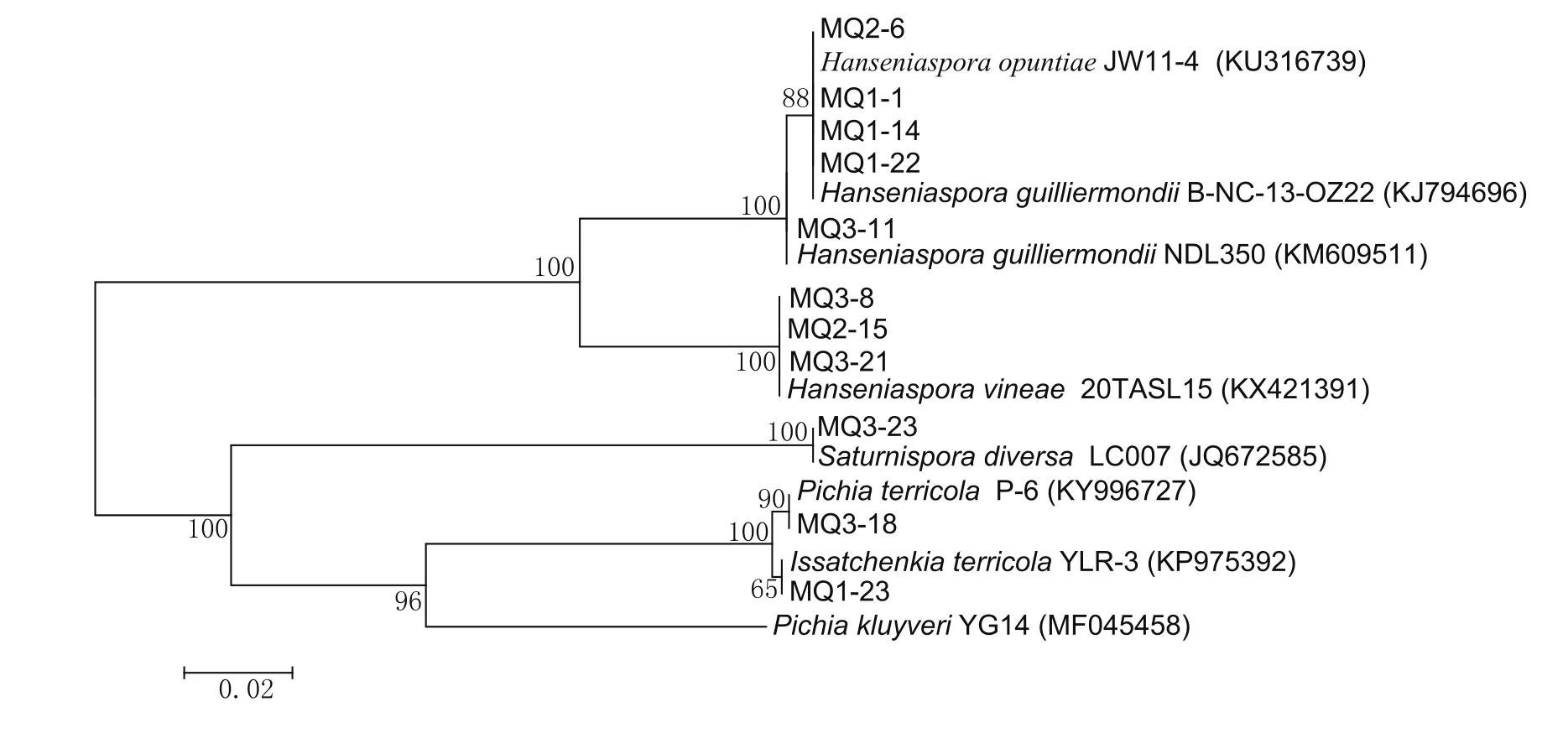
图2 代表菌株26S rDNA D1/D2区段的NJ系统发育树(邻接法)
2.3 不同种群中菌株数量分析
依据上述对代表菌分类鉴定结果,本研究中所分离的68个菌株共分为4个属的6个种群,其中Saturnispora diversa有15株菌,所占比列为22.1%;Hanseniaspora vineae有16株菌,所占比例为23.5%;Hanseniaspora opuntiae有25株菌,所占比例为36.8%;Hanseniaspora guilliermondii、Pichia terricola和Issatchenkia terricola则分别有2株菌、6株菌和4株菌,共占比例为17.6%。由此可见,种群Hanseniaspora vineae、Hanseniaspora opuntiae和Saturnispora diversa占主导地位,并且种群Hanseniaspora guilliermondii含量最少,种群Hanseniaspora opuntiae占比例最高,各个种群分布呈现明显的差异。

表2 供试菌株与相关菌株的5.8-ITS序列相似性
3 讨论
本研究选取民权地区的赤霞珠葡萄果皮,通过富集和分离共得到68个菌株,最终供试菌被鉴定为4个已知酵母菌属的6个不同种群Hanseniaspora opuntiae、Hansenias pora guilliermondii、Hanseniaspora vineae、Saturnispora diversa、Pichia terricola和Issatchenkia terricola。其中Hanseniaspora opuntiae,Hanseniaspora vineae和Saturnispora diversa占主导。结合早期张俊杰等[17]关于郑州果树研究所葡萄种质资源圃的赤霞珠葡萄表皮酵母多样性研究发现,郑州果树所葡萄皮表面酵母共分为4个种群,包括Cryptococcus magnus、Cryptococcus uzbekistanensis、Rhodosporidiobolusruineniae和Hanseniaspora uvarum。通过比较发现,不同的种植环境下的酵母菌组成有明显差异,甚至不存在共同的种群。所以研究民权地区葡萄表皮酵母菌组成就显得很有必要。通过本次研究,初步获取了民权地区赤霞珠葡萄表皮的酵母菌组成特点,并且积累了酵母菌资源。
另外根据张俊杰等[18]的研究,我们对比发现不同地区的葡萄表皮酵母菌菌落组成也是有明显差异的,而且太行山区野生葡萄果表酵母菌组成与民权地区赤霞珠的葡萄果表酵母没有共同种群,但与郑州果树所赤霞珠葡萄果表酵母组成有相同种群。结合杨莹等[19]的研究,Hanseniaspora opuntiae、Hanseniaspora guilliermondii和Saturnispora diversa在葡萄酒发酵过程中均被大量检测到,这一研究说明这3个种群适宜于葡萄酒的发酵环境,而Hanseniaspora opuntiae和Saturnispora diversa在民权地区的葡萄表皮酵母组成中占主导地位。另外,本研究中分离得到的Saturnispora diversa在国内鲜有报道,该菌种主要分布在热带地区,曾在印度尼西亚,巴西的热带雨林被分离到,在国内,目前仅在广西有所发现。
另外,本研究中还发现属于同一个种群的菌株其形态特征也具有显著的差异,例如:不同WL表型Ⅱ、Ⅲ、Ⅳ和Ⅶ,尽管其形态特征不一样,但是经过分子生物学方法发现都属于Hanseniaspora opuntiae。酵母菌种类和表型分析结果不完全一致,这与张俊杰等[20]之前的研究结果相一致,所以只有把传统的鉴定方法与现代分子生物学鉴定方法相结合[21],才可以更加有效而准确的对未知酵母菌菌株进行分类鉴定。
该研究丰富了我们对民权赤霞珠葡萄果皮酵母菌组成的认识,另外还分离出来在国内很少见的Saturnispora diversa。本研究确定了民权葡萄表皮酵母菌的菌落组成,对该地区种植葡萄以及葡萄酒的酿造具有一定的指导意义,同时也为打造更具地区特色的葡萄酒打下坚实的理论基础。
