一种Ni(Ⅱ)配合物/g-C3N4复合材料的制备及其光催化产氢性能研究
2018-10-15刘佳兴徐雨昂朱明昌高恩军
刘佳兴, 熊 孟, 徐雨昂, 张 茜, 朱明昌, 高恩军
(沈阳化工大学 辽宁省无机分子基化学重点实验室, 辽宁 沈阳 110142)
氢气是一种具有高质能比、清洁无污染和可再生等优点的绿色能源[1].利用太阳能分解水制备氢气已成为当今研究的热点问题[2],在过去的几十年里,大量的半导体光催化剂被开发出来.然而,仍有许多问题需要被解决,如有限的光响应范围,快速的光诱导的载流子的复合,高成本的材料,或耗时且复杂的制备过程,稳定性差等,其中,对催化剂的实际应用构成障碍.寻找合适的能解决上述问题的光催化剂,成为研究人员的崇高使命之一[2].
近些年来,一种新型的光催化剂石墨碳氮化(g-C3N4)已经引起广泛关注,聚合物g-C3N4的禁带宽度为2.7 eV,其独特的化学性质和热稳定性成为研究的热点[3].但是,纯g-C3N4存在着光生电子-空穴对复合效率高,对可见光利用率差等缺点.因此,科研人员使用一系列手段改变其性质,提高其光催化性能.例如纳米结构工程[4],将光催化剂与金属或非金属元素掺杂,异质结构工程等.Lee等采用硬模板法制备铜掺杂介孔g-C3N4,其光催化降解活性是纯g-C3N4的2倍[5].此外,ZnO/g-C3N4介孔纳米复合材料也通过类似的方法合成,发现在可见光照射条件下[6],ZnO/g-C3N4和ZnO的光催化活性比纯g-C3N4和ZnO强很多.虽然在提高g-C3N4的光催化活性方面已经取得了具体的进展,但这些努力大部分仍需要贵金属作为协同催化剂,由于其成本高昂,实际应用性较差,因此,开发一种新型的不含贵金属的g-C3N4复合光催化剂对解决能源危机和环境污染具有积极的意义.
本文通过加热回流法合成了一种新型的Ni(Ⅱ)配合物,具有一定的光催化产氢性能,而且具有合适的禁带宽度和较强的可见光吸收能力,与g-C3N4复合后,形成了以Z-电子轨道模型为基础的异质结构,促进了光生电子和空穴的有效分离,使g-C3N4的可见光吸收能力得到提高,光照条件下析氢能力更强.通过XRD、TEM对该光催化剂进行了表征,测试Ni(Ⅱ)配合物/g-C3N4复合材料在模拟太阳光下的光催化制氢性能,进一步测定了该复合材料的重复产氢能力.
1 实验方法
1.1 Ni-L粉末的制备
所用试剂均为A.R级.Ni-L粉末的合成步骤为:采用加热回流法,准确称量0.6 g的NiCl2·6H2O(国药,分析纯)加入到三口烧瓶中,同时加入0.3 g的二咪唑(L)和150 mL的 N,N-二甲基甲酰胺(DMF),在磁力搅拌下加热回流,此时溶液颜色变为深蓝色,加热回流2 h后停止加热,冷却到室温后将溶液加入0.3 L冰水中,静置24 h后,经抽滤得到一种淡蓝色粉末Ni(Ⅱ)配合物(Ni-L),在50 ℃下烘干备用[7].
1.2 g-C3N4粉末的制备
聚合物g-C3N4由高温热解尿素和三聚氰胺的方法制备.准确称量6.000 g尿素和4.000 g三聚氰胺置于刚玉坩埚中,将其放入马弗炉内以5 ℃·min-1的速率升温至520 ℃,保温4 h后缓慢降温至室温,形成团块状g-C3N4[8].
1.3 Ni-L/g-C3N4复合材料
采用浸渍法制备Ni-L/g-C3N4复合材料,按质量比1∶10称取Ni-L粉末和g-C3N4粉末共0.1 g置于100 mL烧杯中,再加入50 mL甲醇,将烧杯置于超声波清洗仪中超声振荡4 h后,静置,将盛装样品的烧杯放置在烘箱中,干燥后得Ni-L/g-C3N4复合材料备用.
1.4 样品的表征
采用X射线衍射仪(XRD,Bruker D8)检测样品的晶体构造,用透射电子显微镜(TEM)观察样品的形状,同时使用Perkin-Elmer LS55荧光分光光度计验证配合物抑制g-C3N4光生载流子的复合几率.
1.5 光催化制氢测试
通过CEL-SPH2N光催化活性评价系统测试样品的产氢性能.光催化评价系统光源为氙灯光源,高纯氮气作为载气,采用气相色谱仪(GC-7920)分析产生氢气的含量.称量50 mg样品置于50 mL水与三乙醇胺(TEOA)的混合液中,接入光催化集气装置开始实验,每经过1 h测定一次产生氢气的量.
2 结果与讨论
2.1 样品表征分析
从图1可看出:纯g-C3N4样品中能够清晰地观察到两个截然不同的衍射峰,分别为12.86°和27.46°的衍射峰,这是由于石墨相氮化碳独特的基本结构单元均三嗪环周期性排列产生的,其具有较弱的衍射强度.而27.46°的衍射峰对应于具有层状结构特征的g-C3N4晶面衍射,是由环状芳香物的层间堆积形成,故其衍射强度较强[9].而Ni-L样品展示的衍射峰窄而尖,说明其具有较好的结晶性,图中显示的复合材料的衍射峰与g-C3N4、Ni-L两种物质的衍射峰相对应,证明g-C3N4和Ni-L成功组成了该复合材料.
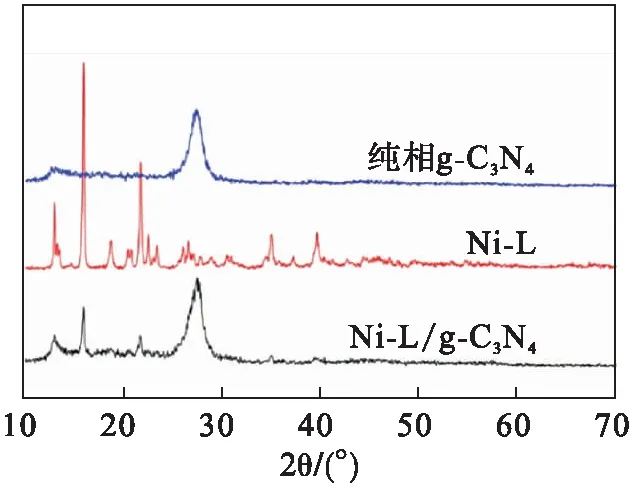
图1 Ni-L、g-C3N4和Ni-L/g-C3N4复合光催化剂的XRD
为了对制备的 Ni-L/g-C3N4复合材料的形貌结构进行表征,采用TEM对g-C3N4和Ni-L/g-C3N4复合材料进行观察分析,结果如图2所示.从图2可清楚地看到:未经过负载的g-C3N4表面较光滑,经过Ni-L负载后,在g-C3N4表面均匀分布着椭圆形小颗粒,粒径约为1 μm,由此可知制得的Ni-L/g-C3N4复合材料与未负载的纯相g-C3N4具有非常良好的形貌结构.
纯相g-C3N4和Ni-L/g-C3N4的光致发光光谱图如图3所示.根据文献[10],g-C3N4的激发波长为375 nm.当随着Ni-L的负载量不断增加(质量分数分别为0,0.5 %和1 %)时,光致发光光谱的峰值也不断降低,表明Ni-L负载后,显著抑制了光生电子和空穴的复合.这些结果证实了Ni-L作为催化剂的联合作用.有效促进了催化剂界面的电子空穴分离、迁移和转移,从而最终提高了光催化产氢的光催化效率.

图2 不同放大倍率的g-C3N4和Ni-L/g-C3N4的TEM照片
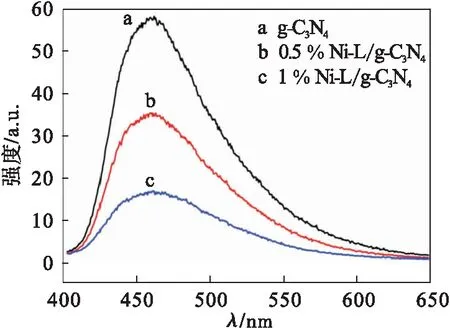
图3 不同Ni-L负载量的Ni-L/g-C3N4复合材料在375 nm处光致发光光谱
2.2 光催化制氢性能
Ni-L,g-C3N4,Ni-L/g-C3N4复合材料光解纯水制氢性能如图4所示.从图4可以看出:50 mg的Ni-L/g-C3N4复合纳米颗粒在模拟可见光下经过6 h可以产生约27.27 μmol的氢气,产生氢气的速率约为84.22 μmol/(g·h).50 mg的g-C3N4经过6h光照产生氢气的速率约为17 μmol/(g·h),而Ni-L产生的氢气约为4.01 μmol,速率约为14 μmol/(g·h),可以证明复合光催化剂的催化性能显著提高.
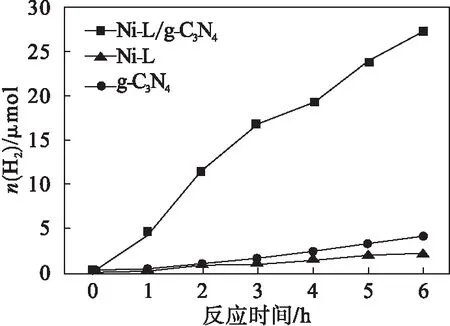
图4 Ni-L、g-C3N4 和Ni-L/g-C3N4复合材料的光催化制氢性能
图5为Ni-L/g-C3N4复合材料的光催化制氢重复性测试结果.经过6轮每轮6 h测试,产生氢气的量依次为27.57、26.36、26.12、25.87、26.43和25.90 μmol.结果表明:复合光催化剂的产氢效率没有明显恶化,证实了Ni-L/g-C3N4复合材料的稳定性,可以看出氢气的产率下降很小,可能是由于回收过程中造成了复合光催化剂少许的损失,可证明Ni-L/g-C3N4复合材料能够重复用来产生氢气.
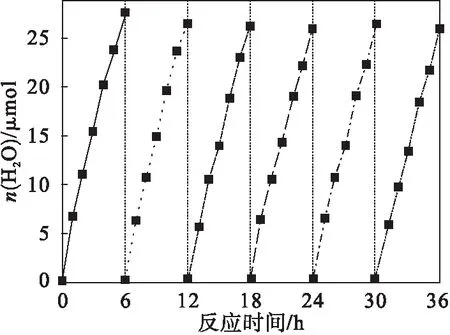
图5 Ni-L/g-C3N4复合材料的光催化制氢循环测试结果
3 结 论
基于Z型电子传输模型合成了Ni(Ⅱ)配合物负载g-C3N4复合光催化剂,制备的光催化剂Ni(Ⅱ)配合物/g-C3N4复合材料的XRD、TEM表征结果证明其具有良好的晶型结构.在模拟太阳光光照条件下,光催化制氢实验结果可以证明在没有贵金属参与反应的条件下表现出极高的光催化活性,该复合材料催化分解水制氢的速率约为84.22 μmol/(g·h),与纯相g-C3N4相比活性提高了5倍且重复利用率很高.而且荧光光致发光光谱表明Ni(Ⅱ)可以有效地抑制光生电子的复合,促进反应体系中光生电子和空穴的有效分离,同时该反应体系是一种绿色的环境友好型的光催化剂,为解决环境污染和能源危机提供了一种很好的途径.
