一种钇金属配合物的合成、表征及DNA性质的研究
2018-10-15赵宏伟张潇尹高恩军
赵宏伟, 张潇尹, 高恩军
(1.沈阳化工大学 辽宁省无机分子基化学重点实验室, 辽宁 沈阳 110142;2.波士顿学院, 麻萨诸塞州 波士顿 02467)
癌症严重威胁人类的健康,寻找治疗癌症的药物受到很多国内外医学研究者的关注.随着对癌机理不断地深入研究,已经证明癌症的发生不仅与外界环境有密切的关系,而且与人体内的环境息息相关.目前外界污染物质的致癌机理还不完全清楚,但是一些间接致癌物通过人体的代谢转化成为最终致癌物,并且和DNA相互结合,在人体内持续存在可能是癌变的决定性因素,癌症其特征是细胞不受控制的增殖和细胞凋亡的丧失,从而产生异常的细胞或肿瘤.传统的癌症治疗主要是手术,化疗和放疗.尽管化疗已被广泛用于临床治疗,但在原发性和转移性癌症中存在许多缺点,例如顺铂的一般毒性,非特异性靶向和获得性耐药.为了减少化学治疗药物的不良反应并提高治疗效率,人们越来越关注低毒性金属配合物的研究和改善治疗性能以用作抗肿瘤药物[1].新型药物与生命大分子作用机制是评价药效的重要方法.研究认为药物的主要靶点是DNA.DNA作为细胞受体,在药物切割DNA 和调节细胞凋亡在致癌和癌症治疗中都起着重要作用.稀有金属配合物可以调节对DNA 结合和切割能力,钇配合物已经被提出用作潜在的抗癌和抑癌剂.本文以钇金属离子与2,2′-联吡啶-4,4′-二甲酸为配体,在水热条件下进行反应,合成了金属钇与氧原子结合的新颖的配合物,通过对配合物的荧光光谱技术和电泳技术,研究了聚合物与 DNA 的作用机制和对肿瘤细胞抑制效果,并得出有价值的科学信息.
1 实验部分
1.1 试剂与仪器
2,2′-联吡啶-4,4′-二甲酸(H2bpydc),二甲基甲酰胺(DMF),蒸馏水,鱼精DNA(FS-DNA),溴化乙锭(EtBr),pBR322质粒DNA,Tris-HCl,NaCl,CdCl2,均为分析纯试剂,购置于国药集团化学试剂有限公司.
Bruker Smart 1000 CCD X-射线衍射仪,美国Bruker公司;Perkin-Elmer LS55荧光分光光度计,美国Perkin-Elmer公司;JY-SPAT水平电泳槽进行电泳的测量.
1.2 配合物的合成与结构表征
将每3份质量的金属盐Y(NO3)3·6H2O与1份质量的2,2′-联吡啶-4,4′-二甲酸配体溶解在V(DMF)∶V(H2O)=1∶1的溶剂中,在常温下搅拌至完全溶解,放置于100 ℃反应釜中加热3 d.用溶剂洗涤分离合成的晶体,并至于空气中干燥得到纯净的晶体.产率:42.7 %.元素分析[理论值(实验值),w/%]:C,19.55(19.61); H,4.07(4.11); N,11.41(11.43); Y,18.12(18.12).
选择尺寸为0.22 nm×0.20 nm×0.18 nm的配合物单晶,以石墨单色器Mo Ka为靶源(λ=0.071 073 nm)的Brucker Smart单晶衍射仪上,以ω-2θ的方式检测在2.04°<2θ<24.93°的范围之内的衍射数据,使用SHELXTL-2013软件程序进行晶体数据的解析,配合物的晶体信息列于表1.
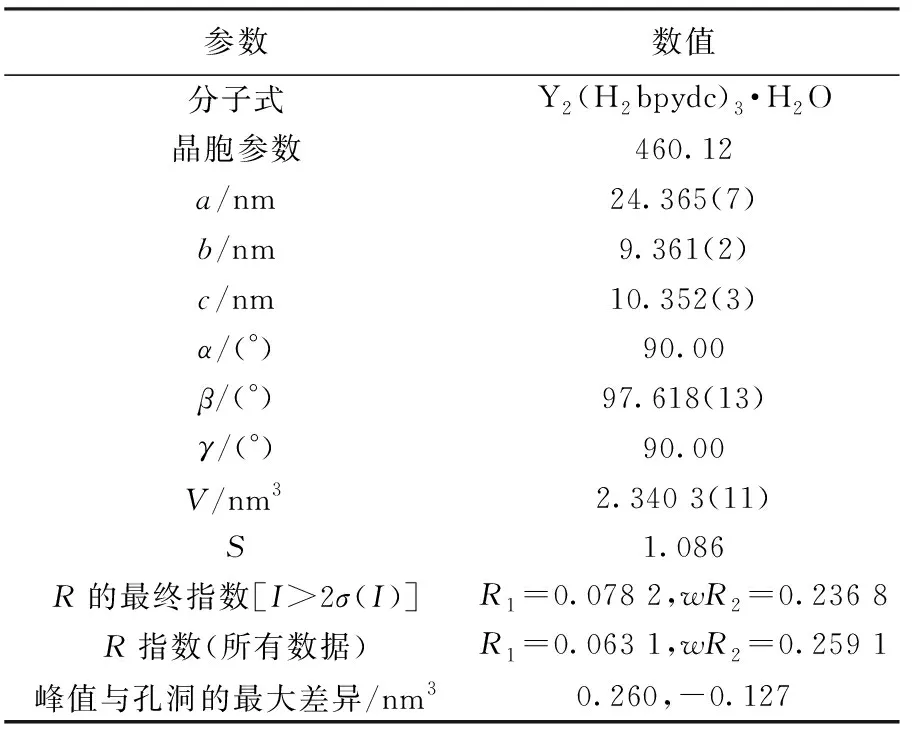
表1 晶体数据
1.3 荧光光谱法
通过荧光光谱法研究配合物与DNA之间的相互作用.通常研究DNA与配合物的方法是荧光猝灭光谱.EtBr(溴化乙锭)在荧光光谱法的研究中是荧光探针和DNA插入剂[2].在水溶液中EtBr分子自身荧光性很弱,然而在DNA作用下恰恰相反.将新颖的配合物加入到EtBr-DNA的体系中,发现配合物与EtBr竞争取代与DNA插入结合的EtBr分子,荧光在竞争作用下部分或者全部猝灭,然而猝灭的程度与金属配合物和EtBr对DNA的竞争能力息息相关[3].因此可以通过荧光光谱法判断配合物与DNA的结合强弱.
1.4 凝胶电泳法
凝胶电泳法是根据分子的特征应用物理特性分离分子的一种实验方法,同时也是测定金属配合物对DNA是否发生了切割或嵌入、解旋的作用方法[4].利用琼脂糖和聚丙烯酰胺不同浓度的配比分离相对质量或相同相对质量不同构型的核酸片段.对于小的核酸分子,通常使用不同浓度配制的不同孔径的聚丙烯酰胺凝胶,而琼脂糖凝胶则用于分离分子量大的核酸.此外,利用低浓度的荧光嵌入溴化乙锭进行染色,可以准确地知道DNA在凝胶中的具体位置[5].使用超螺旋质粒DNA pBR322作为靶点,使用琼脂糖凝胶电泳检测配合物的切割效率.当切割环形质粒DNA时,超螺旋形式(Form I)将观察到有最快的迁移;如果一条链被切割,超螺旋将变得松弛是以产生较慢移动的切口圆形(Form Ⅱ);而如果两条链都被切割,则会产生在其间迁移的线性形式(Form Ⅲ).最后,对超螺旋pBR322 DNA从Ⅰ型转化为Ⅱ型和Ⅲ型的能力进行了评价[6].
2 结果与讨论
2.1 配合物[Y2(H2bpydc)3·H2O]的结构
图1所示是配合物Y2(H2bpydc)3·H2O的单体配位环境结构图.由图1可以看出:中心钇离子是八配位的,其中中心金属钇与2,2′-联吡啶-4,4′-二甲酸6个配体中的氧相连,剩余的2个氧为游离氧原子.而2,2-联吡啶-5,5-二羧酸是一个刚性配体,2个六元环彼此平行,2个氮原子由于分布两侧,配位能力减弱,在此配合物中并未参与配位.合成的新颖钇的化合物结合时形成一个完全对称的结构.
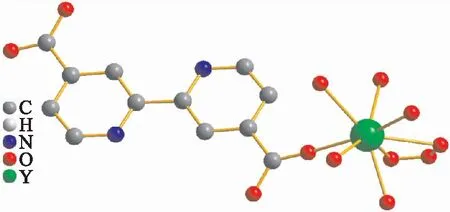
图1 晶体配位环境
2.2 荧光光谱法
溴化乙锭(EtBr)是一种具有平面分子的荧光染色剂,其高度灵敏的共轭芳香环具有较弱的荧光作用,它的共轭扁平分子平行地嵌入DNA双链的配对碱基对之间形成堆积[7-8].没有荧光性质的DNA在插入EtBr后,不仅平行地固定在DNA内部,而且使其内部平行面刚性加强.发生碰撞猝灭减小,荧光特性明显增强[9].金属配合物或化合物也能与 DNA 发生类似的插入作用,它会与DNA 相结合的 EtBr 产生竞争释放出 EtBr,复合体中的EtBr发出的荧光比游离的EtBr本身发出的荧光强度大10倍,从而导致荧光性减弱.在激发波长为526 nm,DNA-EtBr复合体系与配合物作用的发射光谱图(最大发射峰为618 nm)如图2所示.图2中6条谱线分别表示:1为溶液中仅存在DNA-EtBr复合体系的荧光曲线,2~6为DNA-EtBr复合体系分别加入浓度不断增加的配合物(0.5×10-6mol/L,1.0×10-6mol/L,1.5×10-6mol/L,2.0×10-6mol/L,2.5×10-6mol/L)的荧光曲线.在用EtBr预处理的DNA上加入配合物后,观察到荧光强度明显降低,且加入的配合物浓度越高,猝灭现象越明显.还原程度不仅与DNA中除去溴化乙锭的配合物的量度有关,而且还与相邻的DNA碱基对和配合物之间的作用程度有关.这既能说明药物以插入方式与DNA相作用,又能研究药物与DNA结合能力的强弱.根据经典斯特恩-沃尔默(Stern-Volmer)方程[10]:
I0/I=1+Ksq·r
其中:I,I0分别代表配合物/EtBr/DNA复合物中存在和不存在配合物时复合物的荧光强度;Ksq表示斯特恩猝灭常数,定性描述配合物与DNA的作用强弱;r为复合物中配合物与DNA的浓度比.从图3可以看出:Ksq大小可以定量地比较两个化合物在同等条件下与DNA作用的强弱程度,Ksq越大,作用程度越强.经过计算得出化合物的Ksq=0.211 8.
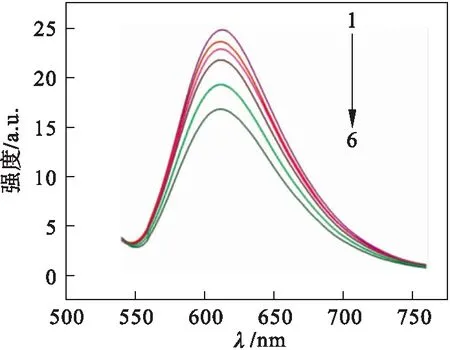
1.c(配合物)=0 mol·L-1
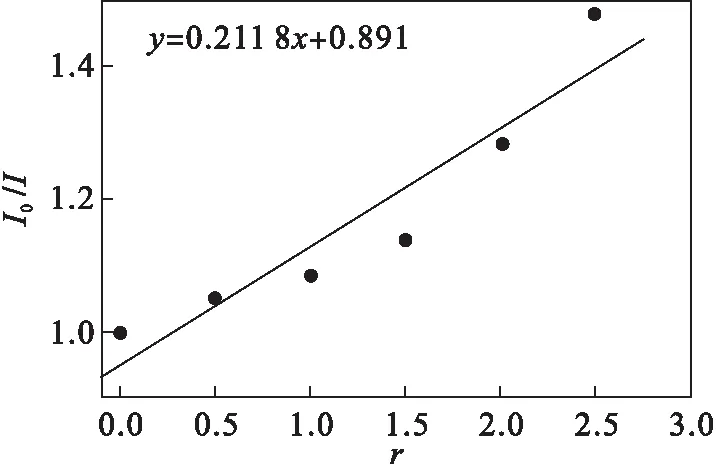
图3 Stern-Volmer猝灭曲线
2.3 凝胶电泳法
配合物对DNA进行了有效的切割,形成了多条条带,其中通过使用配合物的3种不同浓度研究了切割超螺旋pBR322质粒DNA.由图4可以看出:DNA可以被水溶性钇配合物切割.随着钇配合物浓度的降低,切割活性依次减弱,这里可以看出配合物可诱导所有浓度的质粒DNA进行明显切割,但是配合物浓度不同的情况下,其对质粒DNA显示出不同的切割效率.对于不存在金属配合物的对照,观察到少量DNA裂解[11].
凝胶电泳法是将一定浓度的pBR322质粒DNA和新颖的配合物溶液放置于质量分数0.8 %的琼脂糖凝胶上(并且使用EtBr进行着色),由此测定新颖的配合物切割DNA能力的强弱,在200 V、80 mA条件下,将配合物放在TAE缓冲溶液的电泳池中,反应一段时间后标注相应浓度下的图谱,如图4所示.Lane 1~4显示的是配合物浓度依次为 14.0、 7.0、3.5、0 μmol/L在有氧条件下,反应2 h的新颖配合物对DNA进行切割结果图像.从电泳图中可以看出:随着配合物浓度的减小,FormⅠ在增加而FormⅡ在减小(除参照Lane 4外).由此可以得出配合物对DNA具有一定的切割能力.

图4 配合物对pBR322 DNA的切割电泳图谱
3 结 论
(1) 用2,2′-联吡啶-4,4′-二甲酸配体与六水硝酸钇通过水热反应制得新颖的钇配合物Y2(H2bpydc)3·H2O,配体2,2′-联吡啶-4,4′-二甲酸中的羧酸与一个钇金属相结合,形成多配位的金属配合物.
(2) 通过荧光光谱法表明2,2′-联吡啶-4,4′-二甲酸-钇配合物与DNA的作用方式为嵌插作用,Stern-Volmer线性猝灭常数Ksq为0.211 8.使用琼脂糖凝胶电泳研究了配合物切割超螺旋质粒DNA pBR322的能力,实验结果表明配合物表现出有效的DNA切割能力.实验结果充分表明配合物与DNA有较强的相互作用.通过本文的研究希望能够为靶向性药物的设计和体外药物的筛选提供理论依据与技术支持.
