海水驯化对虹鳟鳃、肌肉和肝脏磷脂脂肪酸组成的影响❋
2018-10-15刘骋跃周演根曹逸铭孙大江高勤峰董双林
刘骋跃, 周演根,2❋❋, 董 亢, 曹逸铭, 孙大江,2, 高勤峰,2, 董双林,2
(1.海水养殖教育部重点实验(中国海洋大学),山东 青岛 266100;2.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266235)
不论是昆虫[1]、鱼类[2]还是哺乳动物[3],磷脂在其细胞结构组成中均扮演着重要角色。磷脂是唯一已知可以通过脂肪酸的补偿重组来适应环境变化的生物膜结构成分,并且可以改变膜上蛋白质的功能[4-8]。Hazel[9]已经证明环境温度的下降可以明显提高虹鳟(Oncorhynchusmykiss)肝脏膜磷脂的流动性。花鲈(Dicentrarchuslabrax)在盐度升高时其肌肉磷脂中饱和脂肪酸显著上升使生物膜变的更具刚性[10]。
淡水和海水环境相差较大,其中离子浓度相差大约在1 000倍,但是不同鱼类血液中离子差别仅在3倍左右[11]。因此,无论鱼类生活在淡水还是海水环境中,均需要通过机体中各组织器官进行渗透压调节,来维持体内离子平衡[12]。在淡水中,鱼类通过分泌尿液和离子的被动流失来维持细胞内稳态[13];而在海水中,鱼类可通过离子耦合液体的吸收和主动运输离子来维持机体渗透压的稳定[14]。
虹鳟属于鲑科(Salmonidae)鱼类,是重要的水产养殖种类之一。由于鲑鳟鱼类肉质鲜美并且富含多种人体所需的多不饱和脂肪酸,因而人们对其需求量不断增加,尤其是在中国[15]。经海水驯化后的虹鳟在生长速率、抗病能力以及口感上都远优于淡水养殖的虹鳟[16-18]。因此,海水养殖虹鳟逐渐流行并具有良好的前景。
鱼类海水驯化(盐度胁迫)对于磷脂脂肪酸组成和膜的流动性的研究主要集中在淡水鱼以及广盐性鱼类中,而关于洄游性鲑科鱼类的研究不多。本实验通过测定虹鳟海水驯化前后鳃、肌肉和肝脏中磷脂脂肪酸的组成,发现不同组织器官在适应海水过程中引起磷脂变化的关键脂肪酸,以此探究其对海水驯化的适应机制。
1 材料和方法
1.1 实验方法
本实验于2017年7月2日—8月1日在中国海洋大学鱼山校区水产馆实验室进行,实验材料为三倍体虹鳟,取自日照万泽丰渔业有限公司鲑鳟鱼繁育场(日照,山东)。
实验用虹鳟先在实验室条件暂养2周(温度(16±0.5)℃),盐度0)。然后选取规格相似((195.23 ± 15.75) g)、生长状况良好的虹鳟60尾,随机分成3组分别养殖在3个(277 L;高:58 cm;半径:39 cm)圆形玻璃纤维水缸中。实验开始后,采用逐渐添加海水的方式将水缸水的盐度从0升到30,盐度增加速度为2/天,以使虹鳟可以适应新的盐度变化。暂养以及实验过程中每天于08:00和18:00投喂2次,日投喂量为总体重的2%,饵料为商品饲料(七好鲑鳟鱼饲料),其脂肪酸组成如表1所示。投喂2 h后换水,每次换水量为总体积的一半。由温控系统(ZKH-WK 2000,中科海,青岛,中国)控制水温。溶氧含量不低于6 mg/L。光照周期为12 h光照:12 h黑暗。每天监测并记录水温、溶解氧(DO)、酸碱度(pH)和盐度等水质数据,测定仪器为YSI专业水质检测仪(Yellow Spring,Ohio,USA)。
海水驯化过程中水质均保持在良好状态,实验鱼类无死亡、受伤情况。分别在盐度变化前(0)和海水(30)适应一周后取样。采样前一天停止进食,每个水缸随机取3尾鱼。用麻醉剂MS-222(浓度为70 mg/L)将鱼麻醉,然后取鳃丝、背肌和肝脏并迅速放到液氮中,然后将样品转移到-80℃冰箱(New Brunswick Scientific,Edison,New Jersey,USA)中备用。
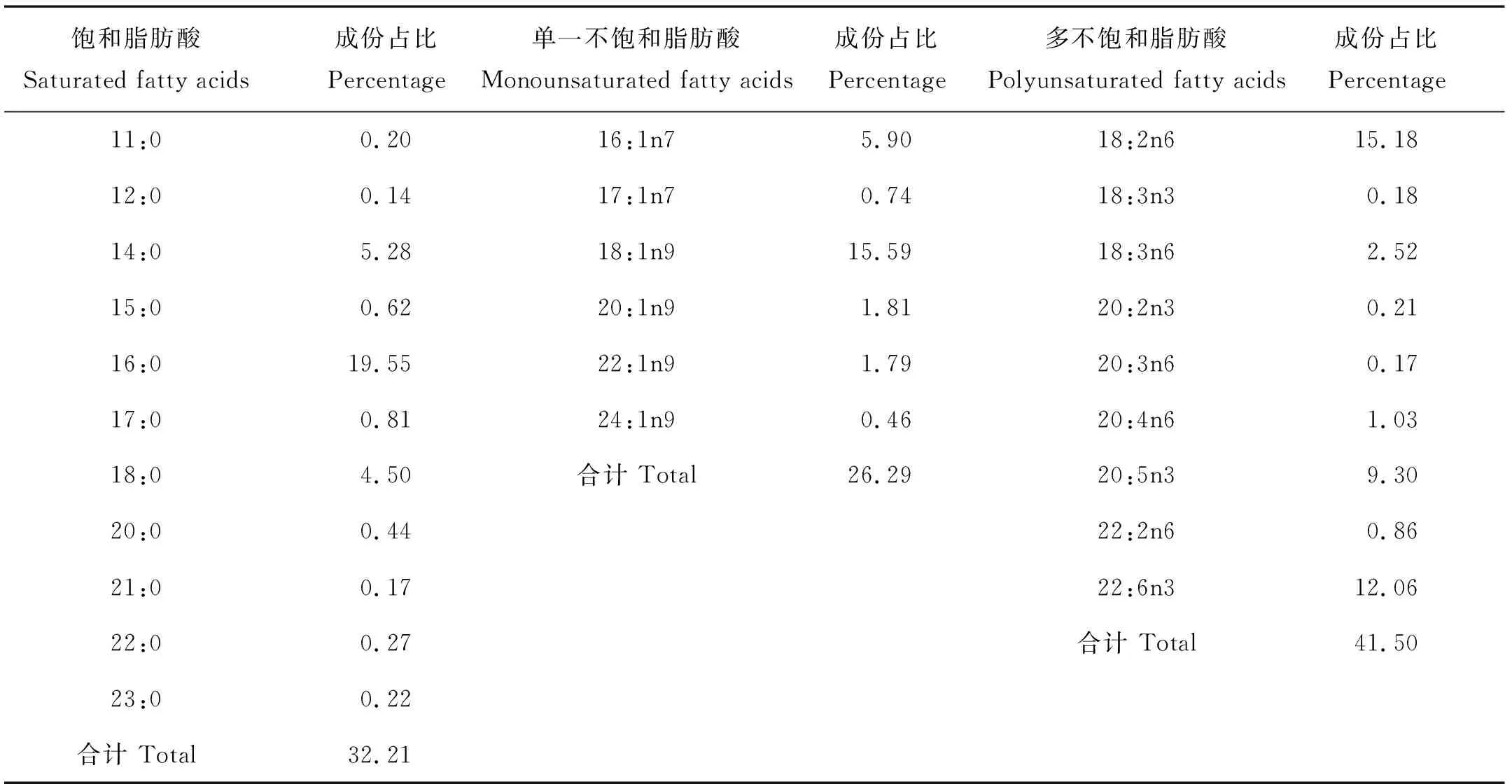
表1 饵料中脂肪酸的组成Table 1 Fatty acid composition of the diet /%
1.2 磷脂脂肪酸的提取和测定
总脂和磷脂的提取参考了Hazel[9]的方法。取0.1 g组织样品,加入3.3 mL甲醇溶液,用匀浆机匀浆1 min,再加入6.6 mL氯仿溶液,倒入10 mL甲酯化试管中,在摇床中震荡30 min(37 °C,130 r/min),过滤后用氯仿/甲醇(2∶1,v/v)混合液定容至10 mL,4 °C下静置过夜。取氯仿层氮气吹干后用石油醚复溶至10 mL,放到-20 °C保存。取2 mL油脂和石油醚混合液到4 mL EP管中,氮气吹干,加入20 μL石油醚,用毛细管吸取后均匀地点在硅胶板(10 cm× 5 cm, Yinlong Company, Yantai, China)上,在中性展开剂(正己烷∶乙醚∶乙酸=85∶14∶1)中展开,用单质碘显色后将极性脂刮下放入甲酯化试管中,加入2 mL 甲酯化试剂(HCl-甲醇溶液),充入氮气后放置到水浴锅中3 h(90℃),加入1 mL色谱级正己烷,振荡均匀后静置,待分层后取含有脂肪酸甲酯的上层正己烷溶液,氮气吹干后用色谱级正己烷复溶至50 μL,放入气相色谱进样瓶中待测。
脂肪酸甲酯的检测使用气相色谱仪(Shimadzu GC-2010 plus,Kyoto,Japan),进样量为1 μL,检测器为火焰电离化检测器(GC-2010,Shimadzu,Kyoto,Japan),气相色谱柱为RTX-WAX石英毛细管柱(长30 m×直径0.25 mm×厚0.25 μm, Phenomenex,Torrance,California,USA)。升温程序为:60℃维持1.0 min,以10℃/min的升温速度升到190℃,然后以2.0℃/min的升温速度升到260℃,维持0.6 min。色谱峰的定性是通过与37种脂肪酸甲酯混合标品(Supelco,Bellefonte,Pennsylvania,USA)的保留时间相比较的方式进行,定量采用的是面积归一法(外标法,5点定标)。
1.3 统计分析
数据以9个重复(3个平行,每个平行取3尾鱼)平均值±标准差(Mean ± SD)表示。采用SAS 9.4(SAS Institute Incorporated,Cary,North Carolina,USA)统计软件对实验数据进行统计分析,将不同组织海水驯化前后磷脂脂肪酸的组成进行t检验分析(t-test),以P<0.05为有显著相关性。
为了对不同组织中磷脂脂肪酸的组成进行更好的表述,我们参照Snyder等[19]和Williams等[20]的方法,使用了不饱和指数(Unsaturation index;UI)、不饱和率(Unsaturated to saturated fatty acids ratio;U/S)和平均脂肪酸长度(Average number of C-atoms of the unsaturated fatty acid;Length)对组织器官中磷脂脂肪酸进行整体评价。计算方法如下:
UI = ∑(% monoenes+2×%dienes+3×% trienes …)/100;
U/S = ∑(% UFA)/∑(% SFA);
LENGTH = ∑(18×% 18 C-UFA +19×% 19 C-UFA + 20×% 20 C-UFA…)。
式中:%表示其所占百分比;monoenes、dienes、trienes…分别表示还有1、2、3…双键的脂肪酸;18C-UFA、19C-UFA、20C-UFA…分别表示碳链长度为18、19、20…的不饱和脂肪酸。
2 实验结果
2.1 实验鱼脂肪酸组成
本研究对虹鳟肌肉、鳃和肝组织中的磷脂脂肪酸进行了测定,共检测出15~20种脂肪酸(见表2~4),包括饱和脂肪酸(SFA)4~7种,单一不饱和脂肪酸(MUFA)4~5种,多不饱和脂肪酸(PUFA)7~8种。在虹鳟盐度驯化前后3种组织器官的磷脂中,饱和脂肪酸所占比例最高的是棕榈酸(Palmitic acid,16:0),单不饱和脂肪酸所占比例最高的是油酸(Oleic acid,18:1n9),多不饱和脂肪酸所占比例最高的是DHA(Docosahexaenoic acid,22:6n3),这3种脂肪酸总量在磷脂中所占比例均超过60%。另外含量较多的脂肪酸还有硬脂酸(Stearic acid,18:0)、亚麻酸(Linoleic,18:2n6)、ARA(Arachidonic acid,20:4n6)和EPA(Eicosapentaenoic acid,20:5n3)。
2.2 海水驯化前后虹鳟不同组织磷脂脂肪酸组成的变化
如表2所示,虽然海水驯化后虹鳟肌肉组织磷脂脂肪酸中 MUFA和n-6 PUFA的比例没有显著变化,但是PUFA中20:4n6,20:5n3以及22:6n3的比例显著降低,同时SFA(尤其是16:0)上升。这些变化使虹鳟肌肉磷脂中n-3 PUFA、UI、U/S和LENGTH均显著下降。
虹鳟适应海水后,鳃中磷脂16:0、20:4n6和22:6n3比例显著上升,而 18:2n6、18:3n3和20:5n3的比例显著下降。总体上看,SFA、PUFA、n-6 PUFA和U/S变化显著,而MUFA、n-3 PUFA、UI和LENGTH不存在显著变化(见表3)。
与淡水虹鳟肝脏磷脂脂肪酸相比,海水使其肝脏磷脂中18:1n9、20:5n3和22:6n3的比例显著上升,16:0、18:0则显著下降。这些变化使SFA显著下降,MUFA、n-3 PUFA、UI、U/S和LENGTH均显著上升,而n-6 PUFA则变化不显著(见表4)。
3 讨论
鱼类对海水的适应是通过一系列生理生化、形态及行为的复杂变化完成,这些变化独立但又相互协调并且需要消耗大量的能量[22-23]。生物膜是细胞内外环境物质交换的介质。生物膜磷脂的变化会直接影响生物膜的物理性质和生物功能,如流动性、膜相行为、膜厚度、膜渗透性和与膜相关酶的活性[21]。因此,在鱼类适应环境因素变化的过程中,组织器官生物膜磷脂脂肪酸组成的改变起到了重要作用。
鱼类肌肉组织对周围环境的变化较为敏感,尤其是盐度和温度[24]。本实验发现,经过海水驯化后虹鳟肌肉磷脂中以16:0为主的SFA显著上升,同时PUFA显著下降。这些变化导致肌肉磷脂的UI、U/S和LENGTH显著下降,表明细胞膜的黏性提高。Cordier等[10]在对法国帕拉瓦莱弗洛海域(Palavas les flots,Herault,France)花鲈肌肉脂肪酸一年的跟踪监测发现了相似的结果,在6~8月海水温度和盐度均上升时肌肉磷脂中22:6n3、20:5n3的比例下降。尼罗罗非鱼在养殖环境盐度从5升高到25后,其肌肉磷脂中饱和脂肪酸16:0和18:0所占比例均显著提高[25]。不论是饱和脂肪酸比例的增加还是多不饱和脂肪酸比例的下降,会造成生物膜磷脂黏性的增加,这可以减缓离子进入细胞内的速度,以此降低鱼类在高渗胁迫环境中产生的不利影响[26]。但是,孔雀鱼(Poeciliareticulate)[27]和鳗鲡(Anguillarostrata)[28]经过高盐胁迫后肌肉磷脂脂肪酸的变化与本实验的结果有所不同,这可能是由于物种、摄食成分或者温度的差异造成的。在虹鳟适应海水过程中,由于海水中离子浓度远高于鱼类血液中的离子浓度,这会导致坏境中大量离子进入肌肉组织细胞内,因此细胞为了维持内外环境离子动态平衡以及正常的生理功能,肌肉膜磷脂会通过增加SFA来提高生物膜的黏性(刚性)。
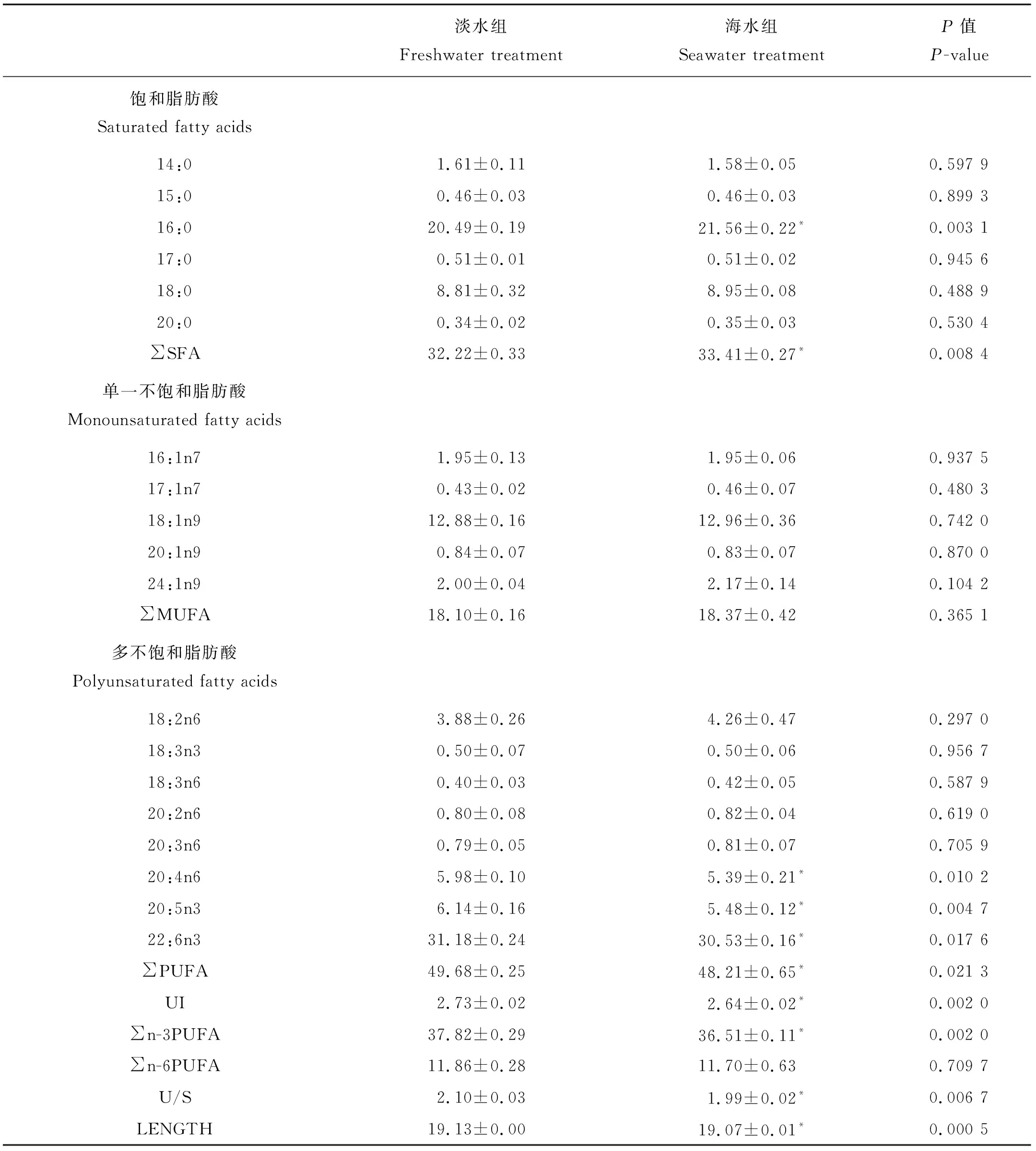
表2 海水驯化前(淡水)后(海水)虹鳟肌肉磷脂脂肪酸的组成Table 2 Fatty acid compositions of phospholipid in the muscle of rainbow trout before (freshwater: FW) and after (seawater: SW) acclimation /%
注:数值以平均值±标准差表示,同行中带有“*”表示具有显著差异(P<0.05)。
FW:淡水处理组;SW:海水处理组;SFA:饱和脂肪酸;MUFA:单一不饱和脂肪酸;PUFA:多不饱和脂肪酸;n-3 PUFA:亚麻酸族不饱和脂肪酸;n-6 PUFA:亚油酸族不饱和脂肪酸;UI:不饱和指数;U/S:不饱和率;LENGTH:平均脂肪酸长度。
Note: Values are mean ± SD, Significant differences (P<0.05) each row are indicated by superscript “*”.
FW: Freshwater treatment, SW: Seawater treatment, SFA: Saturated fatty acid, MUFA: Monounsaturated fatty acids, PUFA: Polyunsaturated fatty acid, n-3 PUFA: Omega-3 series polyunsaturated fatty acid, n-6 PUFA: Omega-6 series polyunsaturated fatty acid, UI: unsaturated index, U/S: the ratio of unsaturated and saturated fatty acid, LENGTH: the average length of fatty acid.
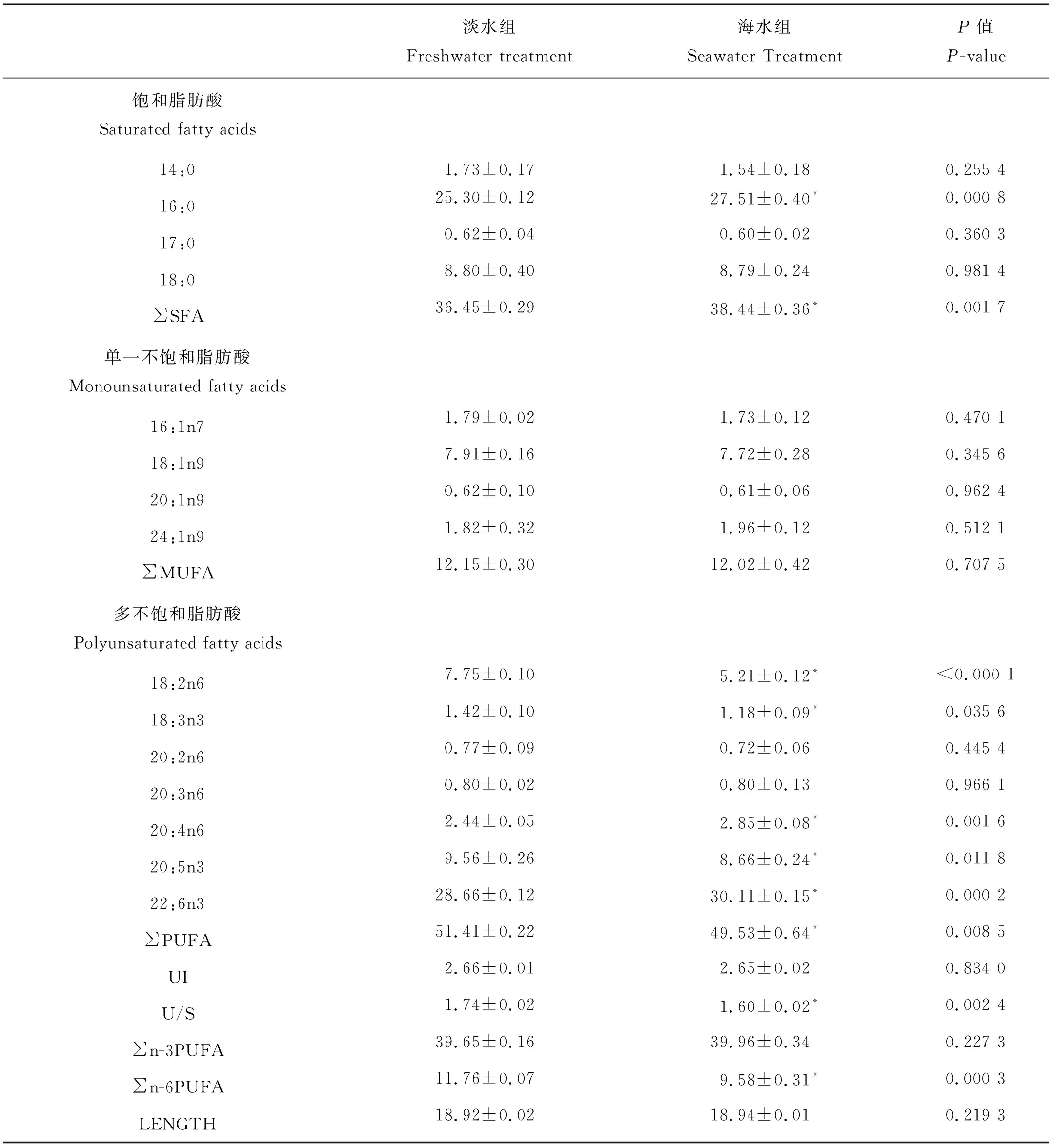
表3 海水驯化前(淡水)后(海水)虹鳟鳃磷脂脂肪酸的组成Table 3 Fatty acid compositions of phospholipid in the gill of rainbow trout before (freshwater: FW) and after (seawater: SW) acclimation /%
注:数值以平均值±标准差表示,同行中带有“*”表示具有显著差异(P<0.05)。
FW:淡水处理组;SW:海水处理组;SFA:饱和脂肪酸;MUFA:单一不饱和脂肪酸;PUFA:多不饱和脂肪酸;n-3 PUFA:亚麻酸族不饱和脂肪酸;n-6 PUFA:亚油酸族不饱和脂肪酸;UI:不饱和指数;U/S:不饱和率;LENGTH:平均脂肪酸长度。
Note: Values are mean ± SD, Significant differences (P<0.05) each row are indicated by superscript “*”.
FW: Freshwater treatment, SW: Seawater treatment, SFA: Saturated fatty acid, MUFA: Monounsaturated fatty acids, PUFA: Polyunsaturated fatty acid, n-3 PUFA: Omega-3 series polyunsaturated fatty acid, n-6 PUFA: Omega-6 series polyunsaturated fatty acid, UI: unsaturated index, U/S: the ratio of unsaturated and saturated fatty acid, LENGTH: the average length of fatty acid.
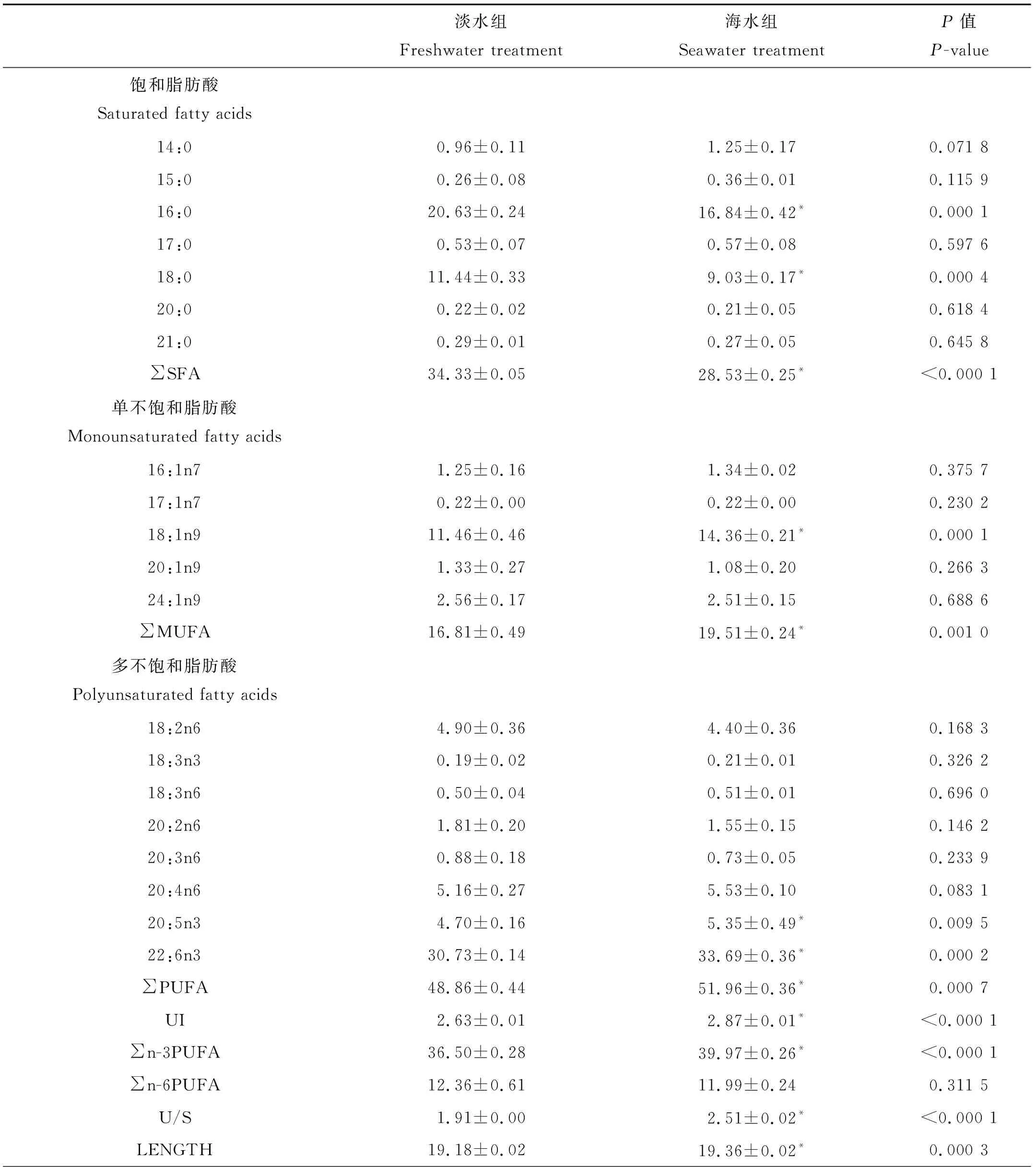
表4 海水驯化前(淡水;FW)后(海水;SW)虹鳟肝脏磷脂脂肪酸的组成Table 4 Fatty acid compositions of phospholipid in the liver of rainbow trout before (freshwater: FW)and after (seawater: SW) acclimation /%
注:数值以平均值±标准差表示,同行中带有“*”表示具有显著差异(P<0.05)。
FW:淡水处理组;SW:海水处理组;SFA:饱和脂肪酸;MUFA:单一不饱和脂肪酸;PUFA:多不饱和脂肪酸;n-3 PUFA:亚麻酸族不饱和脂肪酸;n-6 PUFA:亚油酸族不饱和脂肪酸;UI:不饱和指数;U/S:不饱和率;LENGTH:平均脂肪酸长度。
Note: Values are mean ± SD, Significant differences (P<0.05) each row are indicated by superscript “*”.
FW: Freshwater treatment, SW: Seawater treatment, SFA: Saturated fatty acid, MUFA: Monounsaturated fatty acids, PUFA: Polyunsaturated fatty acid, n-3 PUFA: Omega-3 series polyunsaturated fatty acid, n-6 PUFA: Omega-6 series polyunsaturated fatty acid, UI: unsaturated index, U/S: the ratio of unsaturated and saturated fatty acid, LENGTH: the average length of fatty acid.
对于鱼类来说,鳃是主要的渗透压调节器官并且与环境直接接触。鱼类鳃上皮细胞在淡水和海水中分别具有吸收和排泄离子的功能。本实验发现虹鳟经海水驯化后鳃中磷脂16:0、18:2n6、20:4n6、20:5n3和22:6n3变化显著。虽然这些变化导致了SFA显著升高而PUFA显著下降,但是与膜流动性相关的UI和脂肪酸平均长度变化不显著。Nemova等[30]的研究表明周围环境盐度的改变会使蓝贻贝(Mytilusedulis)鳃磷脂脂肪酸发生重组,盐度的升高(对照组:25,高盐组:45)造成鳃磷脂中以22:6n3和20:5n3为主的PUFA显著上升,而MUFA和SFA显著下降。淡水中养殖的鳗鲡鳃磷脂中20:4n6和22:6n3的比例分别是8%和9%,而在经历海水驯化后,这2种脂肪酸分别上升至12%和19%[28]。众所周知,膜磷脂脂肪酸可以通过脂酰基链中碳原子与蛋白质特异性相互作用以及膜相行为的变化来抑制或者促进酶的活性[31]。鳃上皮细胞对离子的调控主要通过Na+/K+-ATPase酶来实现,相关研究表明Na+/K+-ATPase酶的活性受鳃膜磷脂中脂肪酸的影响较为显著[28,32-33]。Bystriansky等[34]发现在红点鲑(Salvelinusalpinus)鳃中Na+/K+-ATP酶的活性与某些PUFA呈正相关关系,尤其是ARA(20:4n6)和DHA(22:6n3)。此外,Grant等[35]在奇努克鲑(Oncorhynchustshawytscha)饲料中添加鱼油后(富含n-3 PUFA)发现鳃中Na+/K+-ATPase α1b mRMA的表达量显著提升。此外,DHA(22:6n3)和EPA(20:5n3)作为鱼类必须脂肪酸,其不仅会影响酶的活性并且还是一些激素的前体,如前列腺素[28]。前列腺素除了具有生殖作用外还具有渗透压调节作用[29]。本实验发现,在海水驯化后,虹鳟鳃中磷脂脂肪酸也会像肌肉一样通过增加SFA的比例来增加生物膜的刚性,但是为了排泄进入体内的多余离子,鳃中磷脂需要富集更多的PUFA,特别是与Na+/K+-ATP酶活性相关的ARA和DHA,因此鳃中磷脂脂肪酸组成的变化并没有使生物膜流动性发生变化。
与鳃和肌肉不同,在经过海水驯化后虹鳟肝脏磷脂中SFA(16:0)显著下降,同时MUFA(18:1n9)和n-3 PUFA(22:6n3和20:5n3)显著上升,而n-6 PUFA则变化不大,这些变化使得UI、U/S以及脂肪酸平均长度均显著增加,导致肝脏膜磷脂流动性显著提高。Borlongan等[36]的研究发现遮目鱼(Chanoschanos)在适应海水的过程中肝脏、肠磷脂的不饱和度均显著提高,从而使生物膜的流动性增加。Snyder等[37]发现低温也会使淡水鲱鱼(Alosapseudoharengus)肝脏磷脂中n-3 PUFA和n-6 PUFA显著上升,尤其是DHA和18:2n6。不论是对低温还是海水的适应鱼类均需要消耗大量能量,这使生物体内贮存物质的代谢增加[38]。肝脏作为鱼类主要的能量代谢器官,在环境变化的适应过程中负责物质代谢以及能量供应,与此同时,大量的酶和激素会参与到肝脏对脂质和糖类的代谢中[38-41]。生物膜流动性的增加可以促进膜内外的物质交换以及膜上酶和受体的活性,因此肝脏膜磷脂流动性的增加能够促进物质的代谢。
4 结语
虹鳟磷脂脂肪酸在盐度驯化前后产生显著的组织特异性变化。经海水驯化后,为维持内外环境离子动态平衡以及正常的生理功能,虹鳟肌肉膜磷脂中SFA的比例上升使生物膜的黏稠性(刚性)增加,减缓了离子进入细胞内的速度;虹鳟鳃中磷脂脂肪酸也会像肌肉一样通过增加SFA的比例来增加生物膜的刚性,但是为了排泄进入体内的多余离子,鳃中磷脂需要富集更多的PUFA,特别是与Na+/K+-ATP酶活性相关的ARA和DHA;与淡水中虹鳟相比,适应海水后虹鳟肝脏膜磷脂中PUFA和MUFA均显著增加而SFA则显著下降,使得膜流动性提高,这可能与肝脏中脂质和糖类代谢相关酶的活性有关。
