海洋二甲基硫生态模型研究综述❋
2018-10-15沈家葳
赵 亮, 沈家葳, 蒋 昊
(天津科技大学海洋与环境学院,天津 300457)
在全球硫收支中,化石燃料的燃烧和海洋生物活动向大气排放了大量硫化物,而火山、陆地生物的排放对大气硫的贡献则相对较小[1-3]。因此,为了研究全球硫收支,海洋硫循环的研究不可或缺。
在海洋硫循环中,DMS、羰基硫(Carbonyl Sulfide, COS)、硫化氢(Hydrogen Sulfide, H2S)、甲硫醇(Methanethiol, MeSH)、二硫化碳(Carbon Disulfide, CS2)等生源硫化物是海洋-硫循环的重要产物[2]。其中,COS是溶解有机物光化学氧化的产物,而微生物、浮游植物对COS的生产基本没有影响,且只有在某些近岸和陆架的高生产力水域才会有显著的COS的海-气通量[4];H2S会在厌氧、好氧交界处被氧化,或者,成为铁的硫化物而沉积,一般,河口和盐沼等近岸浅水区会向大气排放少量H2S[2];MeSH的产率很高(3~90 nmol·L-1·d-1),但相比DMS,其周转时间很短,会快速降解[5-6];而CS2与H2S类似,海洋是大气CS2的小源,且一般在近岸沉积物孔隙水中,会有显著的CS2通量[2]。

作为海洋硫循环研究的热点,多年以来,DMS引起了国内外广泛的关注。许多学者已经完成了大量的现场观测工作[14-18],但现场观测获取的DMS的相关数据在时间、空间上存在不连续性,研究人员很难从物理、生物、化学的角度,全面解读DMS时空分布差异的影响机制。为了认识和解析DMS的时空分布、量化DMS对全球大气温室效应的贡献,一些学者开始归纳DMS的生消过程,建立DMS循环的生态模型,用以模拟DMS产量,估算DMS的海-气交换通量,并分析其时空变化机制[19-21]。
1 DMS生化过程及其参数化的综述
二甲基硫来源于二甲巯基丙酸内盐(DMSP, Dimethylsulfoniopropionate)[14],其生消过程较为复杂,与浮游植物、浮游动物、细菌等生物因素以及光照、营养盐等环境因素有关。浮游植物可以通过同化硫酸盐(还原作用)获得硫元素,再通过一些特殊的生化反应生产颗粒态的DMSP(DMSPp)[22]。最近发现,海洋中的团聚拉布伦茨氏菌(Labrenzia aggregata)也可以合成DMSP[23]。
1.1 前体物质-DMSP的生物生产及其参数化
DMSPp的产量会受到生物因素(如浮游植物种类、生长阶段等)和环境变量(如温度、营养盐、辐射量等)的影响[24-25]。棕囊藻从71 mmol·L-1(对数期)增加到161 mmol·L-1(稳定期)时,胞内DMSPp浓度增加[26]。当出现营养盐限制时,浮游植物胞内蛋白质减少,DMSP含量增加[27]。在缺氮,尤其是高盐、低氮的条件下,浮游植物会加速生产DMSP以代替glycine betain作为渗透压调节剂[28]。骨条藻胞内DMSPp、C摩尔比为0.002 0,而在N限制时,这个比值增加了70%[29]。
影响DMSPp产量的因子众多,但完美再现DMSPp的生产是DMS循环参数化的关键,前人已经做了许多尝试。在参数化浮游植物的DMSPp产量时,通常利用浮游植物含碳或氮量、生物体内的硫碳或者硫氮比,用两者的乘积来计算浮游植物胞内DMSPp的含量。早期,使用了基于实验的浮游植物硫碳、硫氮比常数[19-31];后来Gabric和Vallina考虑了辐射对硫碳、硫氮比的影响[32-33];而Vogt和Belviso则关注了更多的影响因子,包括藻种、光照、铁和磷酸根[34-35]。
1.2 DMSP的释放及其参数化
在浮游植物生长过程中,其细胞会分泌DMSPp,而在DMSPp分泌过程中,若在破裂的浮游植物细胞附近或其细胞本身有高亲和酶系统,DMSPp会快速转化为DMS;若不存在亲合酶系统或者在低亲和酶系统的情况下,则浮游植物分泌的DMSPp只会形成溶解态的DMSP(DMSPd)[25]。所以,浮游植物胞内DMSPp会以DMSPd或者DMS的形式释放,其释放途径主要有以下四种:
(1)浮游植物细胞主动分泌(Active exudation)
浮游植物胞内DMSPp的分泌可能与浮游植物(如:棕囊藻)的生长阶段有关[36],但一般使用独立于浮游植物生长阶段的DMSPp常数分泌率来参数化细胞的主动分泌[19-20,30-33,37],即使用浮游植物胞内DMSPp含量和DMSPp分泌率的乘积来计算浮游植物细胞的主动分泌。然而,在强的紫外辐射、营养盐限制和高盐度的环境压力下,浮游植物胞内的部分DMSPp会降解为DMS[29,38],即浮游植物会同时分泌DMSPd和DMS。因此,Gabric使用独立于浮游植物生长阶段的DMS分泌率计算浮游植物DMS的分泌[19-20,30,32]。Vallina认为不能忽略光照、浮游植物生长率对浮游植物主动分泌的影响,建立了关于光照、浮游植物生长率、最大分泌率的DMS分泌率函数[33]。由于浮游植物主动分泌量很小,可以忽略不计[5],Steiner和Denman在建立DMS概念模型时,忽略了浮游植物的主动分泌[39]。Vogt则“跳过”了浮游植物的DMSPp主动分泌的过程,直接建立了DMS分泌率与光照、藻种的关系[34]。
(2)捕食作用(Grazing)
在黄、东海部分海域,当叶绿素浓度在普通水平,而桡足类生物量较高时,海水中DMS和DMSP的浓度很高[40]。因此,不能忽略浮游动物捕食作用对DMSPp释放的影响。Wakeham发现,饥饿的浮游动物的肠道内的DMSP的含量很低,即DMSP并没有在浮游动物体内明显富集[41]。几个可能的原因:DMSP主要富集在小于10 μm的颗粒有机物中,而这部分DMSP可能难以被浮游动物直接利用,它会以粪粒的形式从浮游动物体内排出[42];摄食活动可以增强浮游植物的酶活性,提高浮游植物对DMSPp的降解效率[43];位于浮游动物肠道和粪粒中微生物可以降解DMSP[41]。一般来说,使用被捕食浮游植物DMSPp的溶解比例、浮游植物被捕食率以及浮游植物DMSPp含量乘积来计算捕食活动下DMSPp的释放[31,33-34,37,44]。Gabric利用浮游动物的DMSP的分泌率来模拟捕食活动下的释放[19-20,32],而Archer和Vogt还考虑了捕食活动下DMS本身的释放[31,34]。
(3)浮游植物衰老、死亡释放(Autolysis)
当浮游植物细胞步入衰老期时,会大量释放DMSPd和DMS,且衰老期浮游植物释放的DMS是生长期时的7~26倍[45]。通常,忽略浮游植物本身对DMSPp的降解作用,以浮游植物死亡释放DMSP的比例、浮游植物死亡率及浮游植物胞内DMSPp含量的乘积,计算了浮游植物死亡所致的浮游植物DMSPp的释放[33,37,44]。Archer和Vogt则同时参数化了浮游植物死亡所致DMSP、DMS的释放[31,34]。
(4)病毒入侵(Viral attacking)
Bratbak认为随着近岸水华的衰退,大型病毒颗粒明显增加,且病毒活动会终结水华[46]。因此,病毒可能与浮游植物细胞的衰老有关,会加速浮游植物对DMSPp的释放。但是,对病毒入侵所致的DMSPp释放贡献的定量研究还很困难,几乎所有参数化模型都不考虑病毒入侵的影响。
从广义上讲,细胞溶解(浮游植物形态和生化上的变化所致的浮游植物细胞的溶解)源于浮游动物捕食、病毒入侵等环境压力和自身凋亡。在不同环境压力下,不同途径对DMSPp释放的贡献不同,但遗憾的是,我们很难明确区分这些途径对释放DMSPd、DMS的贡献。
有趣的是,浮游植物生产的DMSPp可能未完全转化为DMSPd或DMS,DMSPp,会通过沉降、埋藏过程从水体中清除。一些研究显示:在近岸,DMSPp的沉降率为(0.1~16.6) %·d-1,而在远海,DMSPp沉降率相对较小,为(0.03~0.74) %·d-1[25,47-48];Zhuang等人则发现随着水深的增加,沉积物中的DMSP减少,即近岸有显著的DMSP的埋藏[49]。
1.3 DMSP的消耗、DMS的生产及参数化
如上文所言,浮游植物胞内的DMSPp和水中的DMSPd会被降解。浮游植物细胞含有DMSP裂解酶,能降解DMSPp(Algal DMSP lyases cleavage)。细菌则可以降解DMSPd(Bacterial DMSPd uptake),且降解途径有两条:裂解(Cleavage),细菌也含有DMSP裂解酶,它能裂解DMSPd,产物为DMS和丙烯酸(Acrylate);去甲基化(Demethylation),DMSPd经过一系列去甲基化和降解反应,生成甲硫醇和丙烯酸。当海水中DMSPd的浓度较高时,未被同化的DMSPd会被DMSP裂解酶裂解,且裂解过程占主导地位;在低浓度时,反甲基化过程占主导地位[50];Kiene认为这两个途径的占比取决于细菌对硫的需求和海水中DMSPd的可利用性[6];Stefels则认为裂解过程的占比取决于DMSP生产者的生物量和细菌的生长阶段或状态[25]。反甲基化过程对生物更有利,通常,反甲基化消耗的DMSPd高于裂解过程的消耗量[6]。一些浮游植物还可以摄取DMSPd,这也是水体中DMSPd的一种去除途径[51]。
大多DMS的循环模型使用细菌对DMSPd的分解率和水体中DMSPd浓度的乘积来参数化细菌对DMSPd的分解。Six和Maier认为,DMSPd的分解率与温度有关[44];也有学者建立了细菌消耗与细菌生物量等相关参数的函数[31,33-34]。而细菌裂解生产DMS(裂解DMSPd)的部分(Bacterial DMSP lyases cleavage),通常以DMSPd浓度、细菌对DMSPd的降解率、细菌消耗中裂解的比例的积计算,Belviso则认为细菌对DMS的生产率与磷酸根、铁、溶解有机碳有关[35]。除了微生物(主要是细菌)能够降解DMSPd,海水中的自由DMSP裂解酶也能消耗一部分DMSPd(Free DMSP lyases cleavage)。自由DMSP裂解酶裂解的参数化方案与细菌裂解的类似,以DMSPd的浓度、自由DMSP裂解酶活性的积来计算自由DMSP裂解酶的裂解对DMS产量的贡献[19-20,30-34]。
除了海洋微生物以及浮游植物等通过DMSP裂解酶裂解生产DMS,其他一些途径也能生产DMS,但不是DMS的主要来源[52]。在厌氧环境下,DMS的氧化产物二甲亚砜(dimethyl sulfoxide, DMSO)也会在一些厌氧细菌的作用下,还原为DMS[53]。某些微生物也能利用无机硫化物(一氧化碳、二氧化碳)和甲基化组分合成DMS[54],而无机硫化物(硫化氢)和甲硫醇等的甲基化也能生成DMS[55]。目前模型未考虑这些过程。
1.4 DMS的去除及其参数化
DMSP的降解产物DMS会继续活跃在海洋地球生物化学过程中,它的去除途径主要有三条:
(1)微生物降解(Bacterial DMS degradation)
细菌是微生物降解的主力军,无论有氧(以甲基化合物为营养的生丝微菌属和自养的硫杆菌属)、无氧(硫酸根还原菌属以及甲烷菌属),细菌都能把DMS分解为硫酸盐和含碳化合物[56]。通常,以细菌消耗率和DMS浓度的乘积来模拟细菌对DMS的降解过程。下面列举了不同海域细菌对DMS的消耗率,巴伦支海的细菌消耗率为0.18~0.52 d-1[20];亚热带北大西洋为0.4 d-1[57];马尾藻海为0.01 d-1[37];北冰洋为0.11 d-1[32]。一般而言,光照的增强会抑制细菌的消耗作用[58],Kloster建立了细菌消耗率与温度、DMS浓度的函数[59],也有学者考虑了细菌生物量等相关参数对细菌消耗的影响[33-35,60]。
(2)光化学氧化(Photochemical oxidation)
DMS会在光和化学氧化剂的作用下分解。DMS的光解反应主要发生在紫外B(UVB,280~315 nm)和光合有效辐射(PAR,380~460 nm)波段[53],近岸海水含有充足的天然光敏剂,在它们的作用下,DMS也可在可见光下光解[61]。当DMS浓度小于50 nmol·L-1时,DMS光降解是光强的一级动力学反应;浓度大于50 nmol·L-1时,DMS光降解是光强的零级动力学反应[53]。DMS的光解作用会受到DMS浓度、水色(叶绿素、无机悬浮物和黄色物质)、到达海面的光照强度等的影响[62]。还有研究表明,光解水平还与硝酸盐浓度有关[63]。一般,用光化学氧化率和DMS浓度乘积来参数化DMS的光解。Kieber等人建立了关于PAR(380~460 nm)的光化学氧化率的经验公式(1)[53];也有人建立了关于UVA和UVB的经验公式(4)[64];Gabric等人还考虑了黄色物质(CDOM)对光解的影响[65];Toole等人实现了此参数化方案,如公式(7)[66]。如下所示:
φz=φ·PAR(z),
(1)
PAR(z)=PAR0·e-Kz,
(2)
K=aw+ap(P1+P2+0.4Z1)+adD。
研究区位于桐城市西部龙眠街道龙眠村、黄燕村、风形村、双溪村及黄甲镇杨头村,地理中心点坐标为:东经116°54′20″、北纬31°06′30″。本区地处大别山东麓,属龙眠山脉,区内地势由西北向东南逐渐降低,海拔高度在60~900 m,其中“桐城小花”茶多种植在300~800 m的低山缓坡地带,茶园样式以斜坡茶园为主,局部山体坡度较大区域为梯级茶园,研究区为桐城市“桐城小花”茶的核心主产区。
(3)
其中:φ为单位辐射下的光解率[(W·m-2)-1·h-1];K为衰减系数(m-1);z是深度(m)[31,62]。公式(3)分别考虑了水体本身、浮游动植物、碎屑的影响[39]。
φz=cA·UVA(z)+cB·UVB(z),
(4)
KUVA=1.5·K,
(5)
KUVB=4·K。
(6)
其中:cA和cB分别为对应波段单位辐射下的光解率[(W·m-2)-1·h-1];UVA(z)和UVB(z)随深度变化,如公式(5~6)[39]。
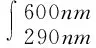
(7)
其中:aCDOM(λ)为CDOM吸收系数(m-1);φ(λ)为CDOM吸收1摩尔光子所分解DMS的摩尔数,标准化为DMS浓度(m3·E-1);E0(λ,t,z)为辐照度(E·m-2·s·nm-1)。
下面,列举了不同海域的光氧化的消耗系数,太平洋海域为0.04 h-1[53];北海北部0.03~0.07 h-1[67];亚得里亚海为0.12 h-1[68];大西洋西部为0.026~0.086 h-1,其中,近岸和陆架为0.033~0.086 h-1,开阔大洋为0.026~0.029 h-1[69];南极为0.16~0.23 h-1[63]。
(3)DMS的海-气交换(Air-sea exchange)
DMS分子会以扩散或气泡等形式进入大气。目前,有两种“获取”其通量的手段:一为直接测量技术,包括梯度通量法(半经验)和微气象学法(直接)。遗憾的是,虽然直接测量技术能通过相关仪器方便地获取DMS的海-气通量,但是,这类仪器花费不菲,还未得到广泛地应用。在实际科研工作中,多采用模型法计算海-气交换通量,一些学者给出了风速、温度依赖的交换系数的估算公式,包括(LM86、W92、W99、N2000)[70-73],但Bell认为海-气交换系数不仅仅与风速、温度有关,还与湍流、波浪、气泡、表面活性剂和相应气体的化学活性等有关[74]。一些学者基于区分白帽(Whitecap)的技术,给出了考虑水温、风速和热稳定度的海-气交换系数的求解(E93、AW98)[75-76],Esters等人认为海-气交换系数与海表湍动能耗散有关,并建立了相关公式(EL16)[77]。
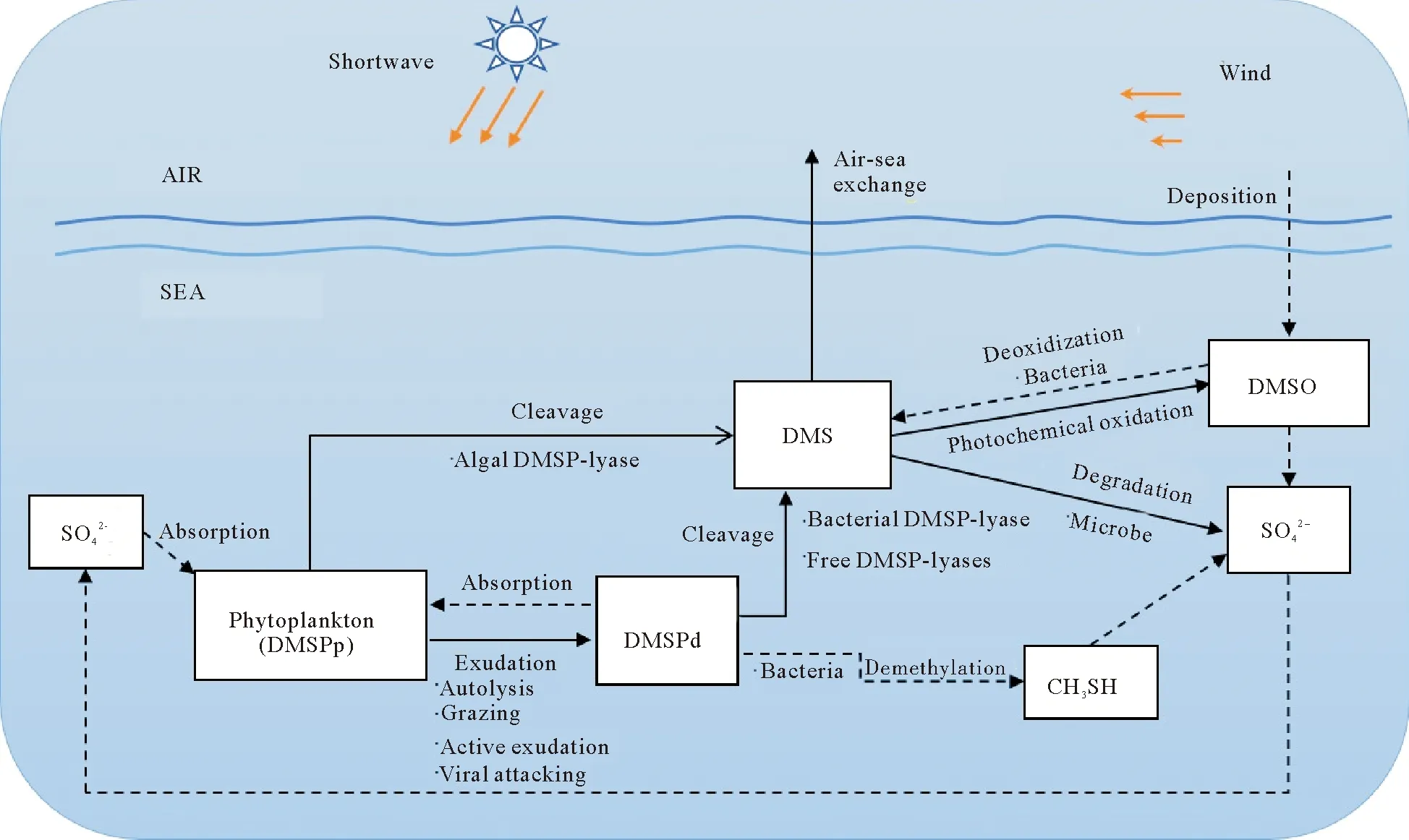
图1 海洋DMS循环示意图Fig.1 Diagram of the DMS cycle in the ocean
图1简要地描绘了海洋DMS循环,实线表示常规生态模型包含的DMS的循环过程;虚线表示常规模型未参数化的过程。浮游植物能合成DMSPp,且胞内一部分DMSPp会被DMSP裂解酶裂解,并以DMS的形式释放,而胞内未裂解的DMSPp则通过上述一些途径,以DMSPd的形式进入水体。进入水体的DMSPd会被自由DMSP裂解酶和细菌分解,生成DMS,而DMS则通过细菌降解、光化学氧化、海-气交换去除。
1.5 DMS统计模型的研究
除了考虑复杂生物过程的方法,还可以通过直接测量DMS浓度和相关环境变量,并利用统计方法建立DMS和相关环境变量的统计模型,以此计算浓度分布,估算海-气通量。
Anderson等人建立了DMS浓度关于叶绿素浓度(C, mg·m-3)、日均短波辐射(J, W·m-2)、营养盐限制因子(Q=N/(KN,N),无量纲)的全球统计模型(AN01)[78];Simó和Dachs考虑了叶绿素浓度(Chl, mg·m-3)、混合层深度(MLD, m)对DMS浓度的影响(SD02)[79];Vallina和Simó则考虑了太阳辐射量(Solar Radiation Dose, SRD)对DMS浓度的影响(VS07)[80];而Miles等人建立了关于紫外辐射量(UVRD)的统计模型(MI09)[81]。相比生态模型,统计模型跳过了DMSP、DMS生消过程,通过简单的经验关系,粗略地估计DMS浓度。
1.6 DMS气候效应的研究
基于第一点疑问:Gabric等人探究了南大洋对温室效应的响应,相比于一倍二氧化碳,在两倍二氧化碳排放下,DMS年通量增加了2%~8%[85];Gabric等人又模拟了三倍二氧化碳下,全球的响应,相比于一倍二氧化碳,DMS年通量增加了14%,且波动存在巨大的纬度差异,高纬波动大,赤道变化则很小,在50°S~60°S海域,DMS通量波动最大,增加106%[21];Bopp等人也模拟了两倍二氧化碳,相比于一倍二氧化碳,DMS通量增加了3%,热带地区减少了15%,南半球中纬度地区则增加了30%[86]。Kloster等人则认为海洋对全球变暖的反馈包括海表温度(SST)升高、海冰消退、海洋普遍的酸化,模型结果表明:相比于1861—1890年,2061—2090年DMS的海-气通量减少了10%[87];Six等人认为相比于工业化前,2100年全球DMS排放减少了(18±3)%,且酸化海水中DMS的浓度很低[88]。
对于第二点疑问:若南大洋DMS海-气通量增加5%(2%~8%),CCN浓度会增加2%~4%,大气辐射波动为-0.29(0.08~0.56)W·m-2,这项衰减相比于二氧化碳对全球温室效应的贡献很小[85];若DMS海-气通量增加3%,辐射衰减了0.05 W·m-2,在DMS通量较高的40°S~50°S,辐射衰减约为-1.5W·m-2,但其对温室效应的缓解作用还会被人为二氧化碳排放对辐射的贡献(2.5~3 W·m-2)所平衡[86];若全球DMS海-气通量增加4.6%,南半球海表的平均温度会减少0.8 K,而北半球则会减少0.4 K,对辐射的贡献为-0.48 W·m-2[89];若DMS海-气总通量增加,北极SST(易受全球变暖影响,变化幅度大),补偿最明显[90]。
不难看出,DMS对温室效应的响应以及其对气候的反馈存在显著的空间差异,且这种响应和反馈包含了复杂的海洋生物地球化学过程,但不可否认的是,DMS与气候确实存在交互过程。
1.7 东中国海研究进展
Xu等人模拟了全球DMS海-气通量,发现在40°S~60°S、赤道太平洋和近岸海域,存在显著的DMS的海-气通量,其中,在东中国海高生产海域,海水中DMS浓度较高,也有显著的DMS通量[13],中国东部陆架海对全球硫收支有重要贡献。

根据前人积累的认识和经验,已经具备了建立中国近海DMS循环模型的条件。
2 展望
针对DMS循环,国内外许多研究团队已经获取了丰硕的成果,探究了DMS循环的各个过程,获取了DMS时空分布的基本认识,同时,也开展了一系列DMS时空分布的机制分析。针对中国近海DMS循环,也完成了大量现场观测和围隔实验,但DMS循环模型的建立还处于起步阶段,且尚未发现中国近岸的DMS循环模型相关文章。
由于DMS循环模型的建立还处于起步阶段,目前的模型还存在一些问题,例如,模型无法完全区分不同藻种对DMSP产量的影响,没能明确区分不同释放途径对水体中DMSPd、DMS含量的贡献。与此同时,DMS三种去除过程的参数化方案不一:如上文中提到的,不同波段对DMS的光氧化率不同,因此,选择合适的公式对于区域硫循环的模拟来说,至关重要;模拟细菌对DMS的消耗需要解决细菌生物量这个难题,当然,也可以直接引入一个细菌消耗率常数,简化这个过程;而海-气交换通量的参数化公式较多(包括LM86、W92、E93、W99、AW98、N2000、EL16),这些公式存在很大的不确定性,因此,不同方法估算的海-气交换通量差异较大。
就中国近海开展的区域硫循环研究来说,影响中国东部陆架海域DMS时空分布的影响因子是如何控制DMS的源、汇及输运的?DMS浓度分布是否存在年际变化?DMS的海-气交换通量具有怎样的时空特征,受到哪些环境因子的影响?以上种种问题还有待进一步深入。针对区域DMS循环,还需开展更深入的研究,需要重建与环境参量有关的DMS的统计模型,亟须发展适合中国近海的一个中国东部陆架海域物理-生物地球化学耦合三维生态动力学模式。
总的来说,在现场观测、受控实验、实验室模拟、遥感、历史资料、同位素技术的支持下,已经初步具备了建立中国近海DMS循环模型的条件,根据前人积累的认识和经验,作者期望:通过归纳涉及DMS生物生产、生化消耗等过程的经验关系,提出适合东中国海DMS循环的相应参数化方案,发展一个中国东部陆架海域物理-生物地球化学耦合三维生态动力学模式;再通过数值模拟,获取中国近海DMS浓度、海-气通量的时空分布,着手探究DMS浓度时空分布差异的形成机制和影响因素,如不同物理、化学、生物过程等影响因子在哪些海区、什么季节起主控作用,如何控制等,为开展情景预测提供知识、数据储备;基于优化后的中国东部陆架海域物理-生物地球化学耦合三维生态动力学模式,模拟中国东部陆架海域DMS浓度的时空分布、DMS的海-气交换通量,定量评估中国东部陆架海域对全球大气温室效应的贡献,并在此基础之上,结合碳循环的模型,开展对中国近海气候变化的情景预测,讨论气候效应。
