微藻脂肪酸生物合成的研究进展❋
2018-10-15米铁柱
米铁柱, 张 梅, 甄 毓❋❋
(1. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100; 2.中国海洋大学环境科学与工程学院,山东 青岛 266100; 3.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071)
微藻是十分重要的生物资源,在生态系统的物质循环和能量流动中发挥着关键作用,具有很高的生态价值。同时,微藻种质资源丰富,且具有分布广泛、种类众多、数量庞大、繁殖迅速等特点,因而,其可观的经济利用价值和巨大的开发潜力受到了科学界的广泛关注。目前对微藻的开发利用主要包括生物活性物质、生物柴油、功能性饲料、抗肿瘤药物以及藻类处理污水等几个方面[1-5]。其中,生物柴油以及生物活性物质中的多不饱和脂肪酸的开发利用都与微藻的脂肪酸生物合成密切相关。
脂肪酸生物合成是生物的基本生理过程之一,在生命过程中起着至关重要的作用。作为细胞的重要组分之一,生物体中的脂肪酸大部分以结合态存在,少量游离在细胞中。脂肪酸不仅可以作为重要的储能物质存在于细胞中,而且对植物的组织结构和功能十分重要。研究表明脂肪酸在防止机械损伤、植物抗寒性、细胞识别、特异性和组织免疫等方面也起到了积极的作用[6]。综上所述,研究微藻的脂肪酸生物合成途径不仅具有生态学和经济学意义,而且有助于我们更加深入地了解微藻的生理学特征。本文主要就国内外微藻脂肪酸生物合成的研究进展展开讨论,以期为后续研究提供一定参考。
1 微藻脂肪酸生物合成途径解析
2007年,莱茵衣藻(Chlamydomonasreinhardtii)基因组的成功测序首次向人们展示了微藻的基因蓝图,这一发现有助于对藻类代谢工程进行更深入的研究[7]。基因组测序不仅能揭示物种的遗传机制,找到功能相关的特异基因,也是分子生物学研究的前提。目前,已完成基因组测序的真核微藻至少有20种[8-11],如表1所示。另外,随着高通量测序技术的快速发展,转录组学技术已在微藻的生理生化研究中广泛应用。通过对微藻的转录组进行高通量测序,利用多种数据库对微藻的测序结果进行注释,能在没有微藻基因组信息的情况下对其基因组进行转录水平的解析,得到参与不同代谢途径的编码基因,在此基础上,可以对微藻的多种代谢途径进行解析,其中,包括微藻脂肪酸的生物合成途径。
基于基因组学和转录组学的研究结果,我们发现微藻脂肪酸的生物合成途径包括3个方面:脂肪酸的从头合成、碳链的延伸以及不饱和脂肪酸的生成。脂肪酸的从头合成发生在叶绿体中,其起始于乙酰-CoA羧化酶(acetyl-CoA carboxylase, ACCase)催化乙酰-CoA生成丙二酰-CoA,这一步被认为是微藻脂肪酸生物合成的限速步骤[12]。正因为如此,ACCase 已成为致力于提高微藻脂肪酸产量的关键酶。接下来,丙二酰-CoA在丙二酰-CoA:ACP转酰酶(malonyl-CoA:ACP transacylase, MCAT)的作用下被加载到酰基载体蛋白(acyl carrier protein, ACP)上。随后,β-酮酰-ACP合酶III(beta-ketoacyl-ACP synthase III, KASIII)催化丙二酰-ACP与乙酰-CoA 发生缩合反应生成乙酰乙酰-ACP。之后,其在β-酮酰-ACP还原酶(beta-ketoacyl-ACP reductase, KAR)、β-酮酰-ACP脱水酶(beta-hydroxyacyl-ACP dehydratase, HAD)以及烯酰-ACP还原酶(enoyl-ACP reductase, EAR)的作用下被充分还原成丁酰-ACP。在之后的反应中,丁酰-ACP和另1分子的丙二酰-ACP作为新的底物,进行新一轮的缩合、还原反应,如此循环6次或7次,最终生成C16:0-ACP或 C18:0-ACP。其中,与第一轮反应不同的是,KASI催化C6至C16产物的生成,KASII催化C18产物的生成。

表1 已完成基因组测序的微藻
基于基因组学和转录组学的研究结果,我们发现微藻脂肪酸的生物合成途径包括3个方面:脂肪酸的从头合成、碳链的延伸以及不饱和脂肪酸的生成。脂肪酸的从头合成发生在叶绿体中,其起始于乙酰-CoA羧化酶(acetyl-CoA carboxylase, ACCase)催化乙酰-CoA生成丙二酰-CoA,这一步被认为是微藻脂肪酸生物合成的限速步骤[12]。正因为如此,ACCase 已成为致力于提高微藻脂肪酸产量的关键酶。接下来,丙二酰-CoA在丙二酰-CoA:ACP转酰酶(malonyl-CoA:ACP transacylase, MCAT)的作用下被加载到酰基载体蛋白(acyl carrier protein, ACP)上。随后,β-酮酰-ACP合酶III(beta-ketoacyl-ACP synthase III, KASIII)催化丙二酰-ACP与乙酰-CoA 发生缩合反应生成乙酰乙酰-ACP。之后,其在β-酮酰-ACP还原酶(beta-ketoacyl-ACP reductase, KAR)、β-酮酰-ACP脱水酶(beta-hydroxyacyl-ACP dehydratase, HAD)以及烯酰-ACP还原酶(enoyl-ACP reductase, EAR)的作用下被充分还原成丁酰-ACP。在之后的反应中,丁酰-ACP和另1分子的丙二酰-ACP作为新的底物,进行新一轮的缩合、还原反应,如此循环6次或7次,最终生成C16:0-ACP或 C18:0-ACP。其中,与第一轮反应不同的是,KASI催化C6至C16产物的生成,KASII催化C18产物的生成。
当一个成熟的脂肪酸到达自己特定的长度时,它可以通过原核途径保留在质体中,质体中的脂酰-ACP与甘油-3-磷酸在酰基转移酶的作用下生成磷脂酸及其相应的衍生物。脂肪酸也可以通过真核途径输送到细胞溶质中,脂酰-ACP在硫脂酶(thioesterase, TEs)的水解作用下释放出游离的脂肪酸。随后,游离脂肪酸会扩散到质体内膜上并在脂酰-CoA合成酶(acyl-CoA synthetase, ACS)的作用下转换成脂酰-CoA,接着脂酰-CoA从质体内膜上释放到细胞质中。在细胞质中,内质网上的脂酰-CoA延长酶(acyl-CoA elongase, ACE)可以催化脂酰-CoA产生更长碳链的脂肪酸,其延长机制与脂肪酸的从头合成相似,但碳链延伸的供体为丙二酰-CoA。与叶绿体相对应的是,内质网上存在另外一种酰基转移酶,该酶以脂酰-CoA为原料,通过真核途径合成磷脂酸以及相应的衍生物。脂肪酸与甘油-3-磷酸结合形成甘油酯后,脂肪酸仍可进一步进行加工,叶绿体膜和内质网膜上存在一系列的脂肪酸去饱和酶,每个去饱和酶在脂肪酸的特定部位产生双键,在这些酶的作用下,最终产生不饱和脂肪酸(见图1)。
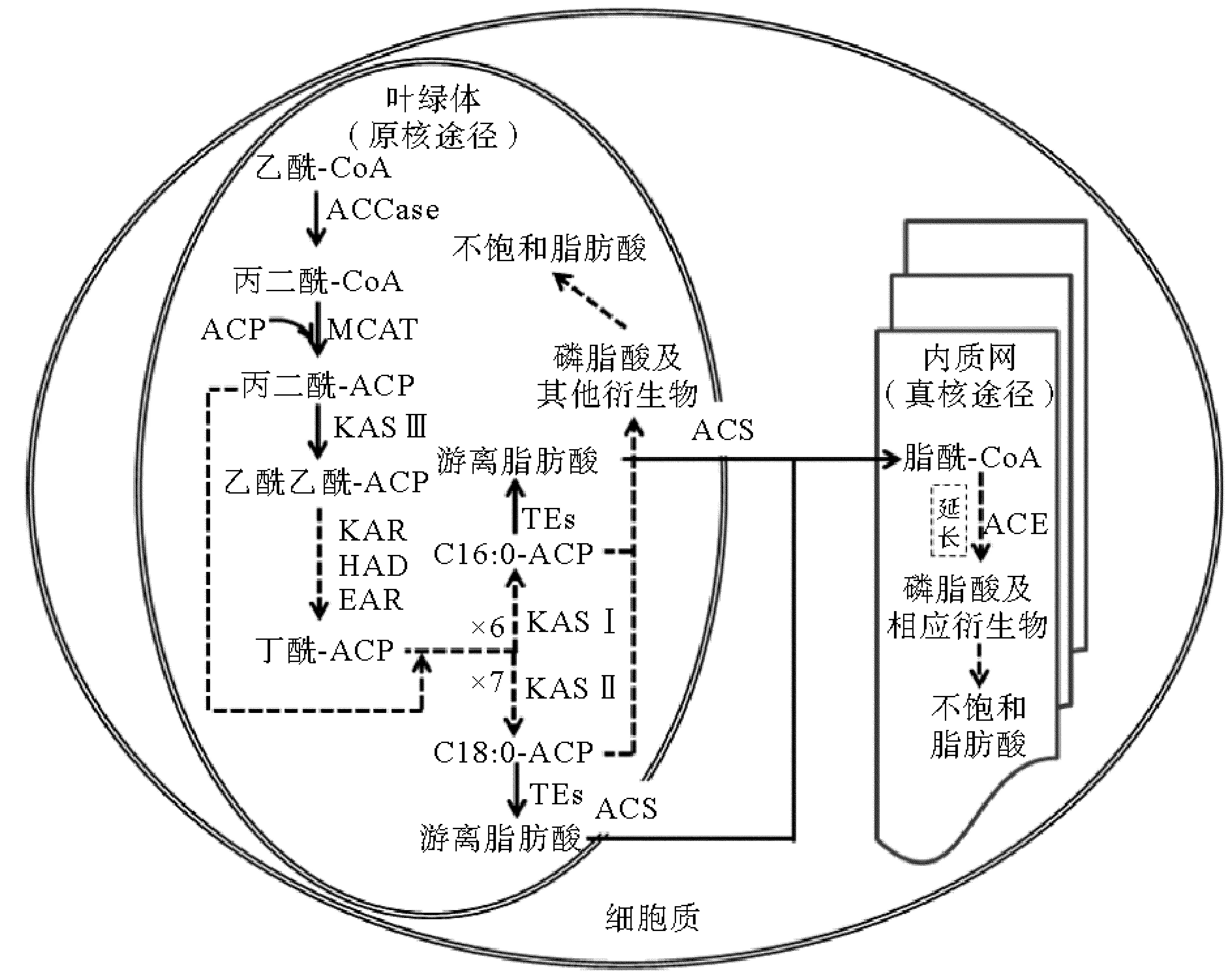
(该图为本文作者绘制,实线箭头表示单次反应,虚线箭头表示多次反应,图中×6和×7表示反应循环次数。The Figure is drawn by the author, Solid arrows indicate a single reaction, and dotted arrows indicate many reactions. In the Figure, ×6 and ×7 are the cycle times.)
图1 微藻脂肪酸合成示意图
Fig.1 The sketch map of fatty acid biosynthesis in microalgae
2 影响微藻脂肪酸生物合成的因素
研究发现,微藻脂肪酸的含量和组成因物种以及环境因子的不同而不同(见表2)。影响脂肪酸含量和成分的环境因子主要有化学因素和物理因素两种。化学因素主要指的是微藻生长时的营养条件,目前相关的研究主要集中在碳、氮、磷、硅以及铁5种元素上。物理因素则主要包括光照强度、温度、pH以及盐度等。
2.1 化学因素对微藻脂肪酸合成的影响
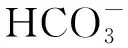

表2 部分微藻的产油情况以及优化的培养方式
微藻具有多种不同的营养方式,大多数是以光合自养的方式生长,也有部分微藻具有利用外加有机物进行异养生长的能力。能被微藻利用的有机物种类较多,目前研究最多的主要包括有机酸、氨基酸、糖类以及醇类等。刘平怀等[17]利用4种不同有机碳源对单针藻(Monoraphidiumsp.)进行混合营养培养后发现,葡萄糖和蔗糖对Monoraphidiumsp.总脂的积累具有明显的促进作用,而甘氨酸和乙酸钠则表现为抑制作用。这说明碳源种类不同,微藻所作出的生理响应也会相应不同,从而导致藻细胞总脂积累的差异。
2.1.2 氮元素 氮元素是微藻进行正常的生命活动所必需的化学元素,不同种类的氮源以及氮源浓度都会影响微藻的生长情况、脂肪酸的含量和组成。Ruangsomboon[18]利用相同浓度的4种氮源(KNO3、NaNO3、CH4N2O以及NH4HCO3)对布朗葡萄藻(Botryococcusbraunii)进行培养后发现,以KNO3为氮源的培养体系的生物量以及脂肪酸含量明显高于其它3种,并且4种不同氮源条件下脂肪酸的组成也显示出较大差异。对于4种小球藻Chlorellazofingiensis、C.vulgaris、Chlorellasorokiniana、Chlorellaprotothecoides以及微拟球藻(Nannochloropsissp. F&M-M24)在内的一些微藻而言,如果处于氮限制培养条件时,微藻会表现出脂肪酸过量积累的现象[19-23],但是对四鞭片藻(TetraselmissuecicaF&M-M33)等一些微藻来说,氮限制只会小幅度提高脂肪酸生产量,甚至造成脂肪酸含量的显著降低[20]。氮限制可以促进脂肪酸积累,但会影响微藻细胞正常的生长、发育和繁殖。因此,仅靠氮限制来获取足够的脂肪酸生产这个方法并不可行。研究者试图用两步培养法来获取足够的脂肪酸生产。首先将微藻在最适的生长条件下培养至指数后期,之后将微藻置于氮限制或无氮源的体系中培养。通过分析发现,上述培养方式可以促进脂肪酸生产量的增加[18,24-25]。
现有理论认为,当氮源充足时,微藻细胞生长旺盛,能够正常合成蛋白、核酸以及脂肪酸等有机质。而在氮限制培养的初期,微藻尚能进行正常的光合作用,细胞内的碳源比较充足,但由于氮元素的缺乏导致细胞无法合成相关的蛋白质和核酸,脂肪酸的合成过程不受氮元素的限制,促使主要的碳代谢流转向脂肪酸的生物合成[26]。
2.1.3 磷元素 磷元素在微藻生长过程起着重要的作用,对维持细胞膜的完整性、发挥细胞机能具有重要意义。同时,磷元素还参与细胞体内DNA、RNA、ATP、NADP及磷脂等物质的生成[27-28]。Li等[29]利用不同浓度梯度的正磷酸盐对月形藻(Scenedesmussp.)培养后发现,当磷的浓度在0.2~2 mg/L的范围时,油脂含量占微藻干重的25%左右。但当磷的浓度处于限制(0.1 mg/L)时,微藻细胞的油脂积累能力大幅度提高,油脂含量高达细胞干重的53%。Feng等[30]利用两种培养基对小球藻(C.zofingiensis)进行培养后发现,缺磷培养基中微藻的油脂积累能力明显高于富磷培养基。研究者利用富氮(缺氮)—富磷(磷限制或缺磷)6种不同营养结构的培养基对斜生栅藻(Scenedesmusobliquus)进行培养后发现,当培养基中的营养结构为缺氮—富磷时,S.obliquus的油脂积累能力达到最大[31]。Pistocchi等[32]发现曲壳藻(Achnanthesbrevipes)、细柱藻(Cylindrothecafusiformis)、拟菱形藻(Pseudonitzschiasp.)以及中肋骨条藻(Skeletonemacostatum)在磷限制条件下,多不饱和脂肪酸占总脂肪酸的比例下降,而单不饱和脂肪酸和饱和脂肪酸所占比例则有所提高。尹逊栋等[33]对4种海洋微藻的研究表明,氮限制和磷限制均会促进微藻总脂含量的增加,但磷限制比氮限制的影响更为显著。因为微藻种类、实验条件以及操作方法的不同,不同研究之间微藻脂肪酸的生产率存在很大的变化。在之前的报道中,主要将精力集中在氮元素对微藻脂肪酸积累的研究上,而忽略了对磷元素的研究。因此,后续应该加强磷元素对微藻脂肪酸积累的研究。
2.1.4 铁元素 对光合生物而言,铁元素是叶绿体电子传递系统一个重要的辅助因子[34],它会影响光合器官碳固定、电子传递以及光利用的能力[35-37]。铁元素的缺乏会导致植物光合活性、耗氧量以及生长速率的降低[38-40]。Liu等[41]利用不同浓度梯度的FeCl3对C.vulgaris进行培养后发现,其在在高铁培养基中的油脂积累能力明显高于低铁培养基。研究发现C.sorokiniana[42]、Monoraphidiumsp. FXY-10[43]、S.obliquus[44]等微藻在高铁培养基中的油脂积累能力也明显高于低铁培养基。与上述结果相反的是,铁浓度增加会提高C.reinhardtii的细胞密度和生长速率,但却抑制了其油脂的积累,这表明铁元素对不同种类微藻碳源流向的调控存在一定差异[45]。通过不同浓度的FeSO4对三角褐指藻(Phacodactylumtricornutum)培养后发现,不同铁浓度对其脂肪酸的含量影响显著,随着铁浓度的升高,P.tricornutum的脂肪酸含量呈先上升后下降的趋势[46]。这说明铁浓度过高并不能继续促进微藻油脂的积累,反而会抑制脂肪酸的合成。
2.1.5 硅元素 硅元素是硅藻生长所必需的营养元素,其不但参与硅藻细胞壁的构成,还参与蛋白质、DNA、光合色素等的生物合成以及细胞分裂等多种代谢途径和生长过程[47]。研究发现,硅缺乏会引起脂肪酸生物合成过程中起关键作用的乙酰-CoA羧化酶活性的增强,促使主要的碳代谢流转向细胞内脂肪酸的生物合成,同时,细胞内之前合成的非脂化合物也可以逐渐转化为脂类,在上述过程的双重作用下,促使微藻细胞内脂肪酸含量的增加[48-49]。程军等人[50]通过研究纤细角毛藻(Chaetocerosgracilis)和新月细柱藻(Cylindrothecaclosterium)两种硅藻发现,在缺氮缺硅条件下适当延长收获时间能够显著提高两种微藻的油脂含量,造成上述现象的原因可能是硅藻光合作用生成的有机物更多的转向了脂肪酸合成,而在缺氮情况下生成的蛋白质的量相对的减少。
2.2 物理因素对微藻脂肪酸合成的影响
2.2.1 光照强度 光照是微藻生长、发育以及繁殖的能量来源,当光照强度适宜时,能促进微藻进行光合作用,从而使更多的碳代谢流转向蛋白质以及脂肪酸等物质的生物合成。Ra等[51]利用红、蓝、紫、绿4种不同颜色的发光二极管(LEDs)以及日光灯作为光源对绿藻Picochlorumatomus进行培养后发现,当光源为LEDs时,微藻的生物量以及脂肪酸含量明显高于日光灯。其中,当光源为红色LEDs时,微藻的生物量最大,而当光源为绿色LEDs时,微藻的脂肪酸积累能力最强。因此,研究者决定通过两步光照培养法来提高P.atomus脂肪酸的收获量,首先使用红色LEDs作为光源来获得微藻的最大生物量,其次利用绿色LEDs作为光源来促进微藻的脂肪酸积累。另有研究发现,当蓝色LEDs作为光源时,Chlorellasp.的脂肪酸积累能力最强[52]。这说明微藻种类不同,促进微藻脂肪酸进行最大积累的光源种类也可能有区别。Goold等[53]发现C.reinhardtii在持续光照条件下三酰甘油的生产率明显高于氮限制培养条件,这表明持续光照有可能是促进微藻脂肪酸大规模生产的关键要素。
大量研究表明,在一定的光照强度范围内,微藻脂肪酸的积累能力随着光照强度的升高而增强;而当光照强度过饱和时,细胞内参与光合作用的细胞器受到光氧化损伤,继而影响对光的吸收能力和利用效率,造成微藻脂肪酸合成率的降低。Ra等[54]利用绿色发光二极管作为光源培养3种微拟球藻NannochloropsisOculata、NannochloropsisOceanica以及Nannochloropsissalina后发现,这3种微拟球藻脂肪酸的积累能力都随着光照强度的升高呈现出先升后降的趋势。同时,该研究还发现,上述3种微藻进行油脂最大积累的最适光照强度为100 μmol·m-2·s-1。但对于月形藻(Scenedesmussp. 11-1)而言,利于其脂肪酸积累的最适光强大约为250 μmol·m-2·s-1[55]。这说明微藻种类不同,促进微藻脂肪酸进行最大积累的光照强度也可能会有区别。
2.2.2 温度 温度是影响酶活的重要因素之一,酶活性的变化会对微藻生物质产量、脂肪酸积累等生理过程产生一定的影响。温度胁迫能够强烈影响微藻对营养元素的利用以及对CO2的固定作用,进而导致藻细胞生长速率、脂肪酸含量和组成发生变化[56]。研究表明,在一定的温度范围内,微藻的脂肪酸积累能力随着温度的升高而加强,当超过最适温度时,脂肪酸的积累能力随之减弱。然而,温度对微藻脂肪酸积累的影响因种而异,四尾栅藻(Scenedesmusquadricauda)和C.vulgaris的脂肪酸积累最适温度为30℃,小型黄丝藻(Tribonemaminus)在25和35 ℃下的油脂积累能力相当,而月形藻(Scenedesmussp. LX1)在20℃下的脂肪酸积累能力最强[57-59]。温度是影响微藻脂肪酸组成的重要因素之一,Vince等[60]发现不同的温度条件下3种小球藻的脂肪酸组成和含量都有所差别。通常情况下,温度降低可以促进微藻不饱和脂肪酸的生成,而温度升高则有助于提高饱和脂肪酸的含量,但研究者发现改变温度对小球藻Chlorellasp. MACC-728的脂质产量和脂肪酸甲酯的组成并没有显著的影响[60-62]。研究发现,一些微藻生长和脂肪酸积累的最适温度并不一致,为了解决上述矛盾,可以利用微藻在最适生长温度下积累生物量而在最适脂肪酸积累温度下积累脂肪酸的特点,采用两步温度培养法促使微藻的脂肪酸积累达到最大,即微藻先在最适生长温度条件下积累生物量,培养一定时期后再转移至最适脂肪酸积累温度条件下积累脂肪酸。
2.2.3 盐度 能生存于较大盐度范围的生物称为广盐性生物,反之为狭盐性生物。盐度较大幅度变化时,因为渗透作用的关系,细胞可能萎缩或涨破。生活在不同水体环境中的微藻都能产生一些代谢产物(多糖、油脂、小分子蛋白等)来维持与外界环境的渗透压平衡[59]。因此,培养体系中盐度的改变可能会造成微藻细胞内脂肪酸的含量和组成发生变化。小球藻C.sorokinianaHS1能够在高盐度的环境中生存,当培养液中NaCl浓度从0 g/L上升到60 g/L(盐度为60)时,微藻细胞内油脂的含量随NaCl浓度的升高呈现出先升后降的趋势,其中,当NaCl的浓度为30 g/L时,微藻油脂的积累能力最强[63]。对双眉藻(Amphorasubtropica)和杜氏藻(Dunaliellasp.)的研究表明,当培养液中NaCl的浓度从0.5 mol/L上升至2 mol/L时,2种微藻饱和脂肪酸和单不饱和脂肪酸的含量均有所增加,而多不饱和脂肪酸所占比例则相应减小[64]。研究表明,部分微藻在较低盐度下生长较好,而在较高盐度则有利于微藻脂肪酸的积累。因此,通过调节培养基中的盐度可以促进微藻脂肪酸积累。
2.3 其他因素
除上诉因素外,维生素、植物生长激素、微量元素、接种密度、溶解氧、通气速率以及生物反应器的类型等也是微藻培养过程中要考虑的关键因素,其对微藻生物质生产和脂肪酸积累具有重要的影响[68]。
3 微藻脂肪酸生物合成基因工程研究进展
微藻通常在生长繁殖速率受限的条件下才能促进脂肪酸的最大积累,所以,很难实现微藻生长繁殖和脂肪酸大量积累的同步提高。因此,微藻脂肪酸的产业开发仍需寻找新的途径去解决。随着测序技术的逐渐发展,基因组学、转录组学、蛋白组学以及代谢组学等组学技术的相继出现使得我们对微藻脂肪酸生物合成的机理有了一定的认识,在此基础上,可以对已经进行基因测序的微藻进行基因操纵,从而改变微藻细胞内脂肪酸的含量和组成(表3为微藻脂肪酸生物合成基因工程的部分实例)。
3.1 蓝藻脂肪酸合成的基因工程
蓝藻是可以进行光合作用的原核生物,又叫蓝绿藻或蓝细菌。在藻类生物中,蓝藻是结构最简单、最原始的单细胞生物。因为其结构简单,蓝藻比真核藻类更容易进行基因操作,并可以操控游离脂肪酸分泌到培养基中,这个培养体系可以减少微藻脂肪酸收获、脱水以及提取的经济成本。正因为如此,蓝藻脂肪酸合成工程以及游离脂肪酸分泌的研究逐渐成为科学界研究的热点[69]。2009年,研究者首次利用基因插入技术将植物的脂肪酸合成酶成功转入五代突变藻株集胞藻(Synechocystissp. PCC 6803)中,通过研究发现,当藻细胞密度为1.5×108cells/mL时,其能以每天(133±12) mg/L的产量分泌脂肪酸[70]。Liu等[71]在五代突变菌株Synechocystissp. PCC 6803的基础上对其进行第六代改良后发现,在细胞密度增加到1.0×109cells/mL的情况下,其脂肪酸的分泌速率增加到(197±14) mg/L。然而,研究发现蓝藻的脂肪酸含量较低,从经济可行性出发,如若进行大规模的脂肪酸生产以及使用,目前还存在一定的困难。

表3 微藻脂肪酸生物合成基因工程的部分实例
3.2 真核微藻脂肪酸合成的基因工程
与蓝藻相比,真核微藻的油脂含量较高,一般情况下,富油微藻的油脂含量可达其干重的30%~50%,美国水生物种项目(Aquatic Species Program, ASP)筛选的富油藻种中,多为硅藻和绿藻。为了有效促进微藻的脂肪酸生物合成,我们必须对微藻的脂肪酸合成途径进行详细的生化研究并阐明其固有的调控模式。目前,国内外研究的内容主要包括ACCase基因和TEs基因两个方面。在植物的脂肪酸合成步骤中,ACCase被认为是第一个关键限速酶。研究发现从小环藻(Cyclotellacryptica)和球等鞭金藻(Isochrysisgalbana)中纯化得到的ACCase的动力学特征与其他植物的ACCase相似[72-73];研究者利用基因枪技术将C.cryptica的ACCase基因在C.cryptica和舟形藻(Naviculasaprophila)中过量表达后发现,ACCase基因的过量表达没有造成两种微藻脂肪酸生产量的增加[74]。上述现象的产生可能与脂肪酸生物合成途径的反馈抑制有关,ACCase活性虽然增强但是被其他代谢途径所抵消,导致脂肪酸的含量没有明显提高。研究已经证实甘蓝型油菜中的ACCase对聚山梨酸酯的生成具有抑制作用[75]。另有研究发现,在不同的生长周期和营养条件下,Chromeravelia和Isochrysisaff.galbana两种微藻细胞中ACCase表达量的变化并不一定会引起脂肪酸积累的变化[76],这说明ACCase酶并不是影响微藻脂肪酸生物合成的唯一调控因素。
利用转基因技术将TEs转入到微藻细胞是一个可以改变脂肪酸成分的有效方法,因为TEs的作用是使脂肪酸碳链的延伸得以终止,它从功能上决定了脂肪酸生物合成的最终产物。高等植物的TEs具有高度的特异性和底物选择性,例如,FatA TEs作用于C18:1-ACP,而FatB TEs则作用于一系列饱和的酰基-ACP(C8-C14)[77]。与植物TEs相比,微藻TEs没有显示出高度的特异性和底物选择性。例如,C.reinhardtii的基因组测序显示CrTE是其基因组中发现的唯一的脂肪酸TEs,而研究却发现C.reinhardtii生产的脂肪酸则是由多种不同长度以及不同饱和度的脂肪酸组成,这证明CrTE可以作用于一系列的脂酰基-ACP碳链[78]。在绿藻C.reinhardtii叶绿体中过量表达内源性CrTE基因后发现脂肪酸的碳链变短,同时肉豆蔻酸(C14:0)的生产量也有所增加,研究者认为肉豆蔻酸生产量增加的原因可能是叶绿体中CrTE和脂酰基-ACP之间化学计量的平衡被打破,从而使脂酰基-ACP过早的发生了水解[79]。与之相反的是,在P.tricornutum中过量表达内源性PtTE基因并没有改变脂肪酸的组成[80]。最近的一些研究也尝试将高等植物的TEs利用转基因技术转入到真核藻类中去改变微藻的脂肪酸组成。通过基因工程的方法将加州月桂的FatB TEs(C12:0)基因和香樟的FatB TEs(C14:0)基因转入到P.tricornutum中发现,脂肪酸的合成向理想的短链表型方向转变,其中,C12:0的含量增加了6.2%,而C14:0增加了15%[81],而将加州月桂和萼距花的TEs转入到C.reinhardtii的叶绿体中并没有观察到脂肪酸组成的改变[79,82]。上述研究表明改变微藻的脂肪酸组成并不简单,我们有必要进一步发掘微藻脂肪酸生物合成的内在调控机制,从而有效改变微藻细胞脂肪酸的组成。
4 总结与展望
通过上述研究发现,提高微藻的脂肪酸含量可以通过环境因素调控和基因工程两种方式来进行。环境因素调控虽然会促进微藻脂肪酸的积累,但大多是以牺牲细胞生长和增殖为代价的,因此需要对培养条件进行优化以保证微藻可以正常生长繁殖。目前,科学界已经对微藻的脂肪酸合成机制有了一定的认识,在此基础上,我们可以对微藻进行基因工程操作。但脂肪酸的合成机制非常复杂,简单的操纵一个基因或者几个基因很难达到理想的效果,因而需要全面了解微藻脂肪酸的内在合成机制。
转录组学和蛋白组学的快速发展,为全面了解微藻脂肪酸的内在合成机制提供了可能。前期研究中,笔者对玛氏骨条藻Skeletonemamarinoi不同生长时期的转录组数据进行分析,构建了S.marinoi的脂肪酸生物合成途径,其与微藻脂肪酸合成示意图(见图1)基本一致;同时发现了一些与脂肪酸生物合成相关的编码基因,如乙酰-CoA羧化酶基因、丙二酰-CoA:ACP转酰酶基因以及硫脂酶基因等。通过分析S.marinoi不同生长时期脂肪酸合成途径中的基因表达后推测,S.marinoi在稳定期和衰亡期的脂肪酸合成能力高于指数期。造成上述结果的可能原因是微藻生长进入稳定期后,培养基中N和P等营养元素逐渐被耗尽,使微藻的生长处于营养限制条件下,从而导致S.marinoi脂肪酸的积累能力加强。后续研究可以从两个方面对S.marinoi脂肪酸合成的分子机制进行探索。首先可通过测定S.marinoi不同生长时期脂肪酸含量和组成来对前期研究结果进行验证,其次可利用相对定量的方法对不同实验条件下S.marinoi脂肪酸生物合成途径中关键基因的表达进行分析,研究其在转录水平的调控途径,进而对不同实验条件下的S.marinoi进行蛋白组分析,以期从多个层次来解释S.marinoi脂肪酸合成的内在分子机制。
现代生物技术的发展使了解和改造微藻的脂肪酸合成途径成为可能,但要实现微藻脂肪酸的工业化生产,目前还存在很多困难。值得关注的是,高等植物的脂肪酸生物合成相关研究已经取得了重要进展,为微藻的脂肪酸合成研究提供了很好的借鉴,相信未来微藻脂肪酸生物合成研究一定会取得更大进步。
