siRNA 沉默STAT3后降低Aβ寡聚体诱导的小胶质细胞氧化应激的水平
2018-10-12郭秀美官志忠
郭秀美, 官志忠
阿尔茨海默氏病(Alzheimer’s disease,AD) 是一种中枢神经系统退行性疾病,目前病因未明,被认为是老年期发生痴呆的主要病因。随着人口老龄化进程的加速,AD日益成为一个突出的医学与社会问题,不仅使人类健康面临严重威胁,而且将会给家庭和社会带来沉重的经济负担[1,2]。因此,我们应该重视对AD的认识,深入研究和探索AD的发病机制以及可能预防和治疗AD的新方法。
在对AD 发病机制的研究中发现Aβ异常沉积形成老年斑的过程对神经细胞具有明显的毒性作用但其具体的作用机制尚不清楚。在AD患者大脑中发现大量沉积的Aβ可引起神经元凋亡、神经胶质细胞的增生、Tau蛋白异常磷酸化等病理改变[3]。又有学者研究发现,大脑内聚集沉积的Aβ与小胶质细胞膜上的相关受体结合后可使小胶质细胞活化,释放神经毒性因子引起强烈的细胞氧化应激而导致神经细胞的损伤[4]。
目前,对于Aβ诱导小胶质细胞产生神经毒性反应与细胞内信号因子转导通路之间的关系的研究尚不明确。其中,Janus激酶-信号转导子和转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT) 通路自Darnell等[5]发现以来,已被证实参与细胞多种重要的生物学反应过程,是机体将细胞外信号向细胞内传递的重要途径。信号转导子与转录激活子3(signal transducer and activator of transcription 3,STAT3)参与了该信号转导的过程。已有研究结果表明用上游JAK的选择性抑制剂阻断STAT3的活化后,小胶质细胞所释放的NO水平明显降低[6]。因此,基于以往其他学者的研究,本实验应用RNA干扰技术探讨Aβ对小胶质细胞的神经毒性作用与STAT3之间的关系,进一步阐明Aβ在AD发病过程中可能的作用机制。
1 材料和方法
1.1 主要材料 BV-2小鼠小胶质细胞购自中国科学院昆明细胞库。实验中的主要试剂和仪器有活性氧(ROS)检测试剂盒(Invitrogen公司,美国);一氧化氮(NO)检测试剂盒(南京建成生物工程研究所,中国);CO2培养箱(日本Sanyo 公司);ELX800UV 酶标仪(美国Bio-Teck 公司);正置荧光显微镜(日本 Nikon 公司)。
1.2 方法
1.2.1 ROS 检测 将细胞种于12孔板内进行细胞爬片,待细胞长好后弃去各处理组细胞培养液,用无血清培养液清洗细胞;将DCFH-DA用无血清培养液按照1:500的比例进行稀释,使其终浓度达到10 μmol/L。向12孔板内的各孔均加入已稀释好的DCFH-DA 500 μl,然后将板置于细胞培养箱内,孵育30 min。取出12孔板用高压的PBS洗涤细胞3次,以充分洗涤培养基内的DCFH-DA。最后取出细胞爬片并滴上防淬灭剂后,反扣于一干净的载玻片上(注意避光),立即在正置荧光显微镜下观察并记录荧光情况,计算机采集图像荧光值作统计分析。
1.2.2 NO含量测定 (1)首先将各处理组细胞培养基收集起来备用,各组分别取100 μl细胞培养基并倒入200 μl试剂一,充分混匀后均加入试剂二100 μl,漩涡振荡混匀后,静置10 min,再以4000 r/ min离心15 min,最后每组各取160 μl上清液按表1进行操作。(2)操作表。

表1 NO含量测定加样表
加好样后使其充分混匀后,室温静置15 min,最后在酶标仪上于570 nm处测定各孔的吸光度OD值。
(3)各孔测得的结果按下列公式进行计算:

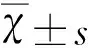
2 结 果
2.1 siRNA沉默STAT3后BV2细胞中ROS水平 BV2细胞中ROS检测结果显示:与对照组相比,Aβ处理组细胞内ROS水平显著增高;而与单纯Aβ处理组相比,siRNA 沉默细胞内STAT3的表达后再用Aβ处理组(即siSTAT3+Aβ组)细胞内ROS水平明显降低(P<0.01)(见图1)。
2.2 siRNA沉默STAT3后BV2细胞中NO含量 用1.0 μmol/L Aβ分别处理BV2细胞1 h、4 h和24 h,结果显示,与对照组相比,各时间段Aβ处理组NO含量均明显增高;而siRNA沉默STAT3后再用Aβ处理组(即siSTAT3+Aβ组)与单纯Aβ处理组相比,各时间段NO含量均显著降低(P<0.01)(见表2)。

表2 BV2细胞中NO含量
**表示与对照组比较P<0.01,##表示与Aβ组比较P<0.01

**表示与对照组比较P<0.01,##表示与Aβ组比较P<0.01
3 讨 论
目前,AD的病因及发病的病理过程尚不清楚,但Aβ聚集和沉积形成的老年斑已被认为是AD的主要病理特征之一,也是AD的致病核心机制[7]。由老年斑激活并聚集在其附近的小胶质细胞会释放许多毒性因子,这些因子可引起脑内APP代谢的异常,导致Aβ产生增加而进一步加重AD的发展。由此可见,激活的小胶质细胞释放的神经毒性因子在Aβ毒性机制中扮演着重要的作用[8~11]。
研究表明ROS损伤也是AD患者脑组织损伤的重要病理机制之一[12]。ROS主要是经 NADPH 氧化酶催化产生的,在AD患者的大脑中Aβ沉积可引起小胶质细胞内的NADPH 酶活化,Wilkinson 等[13]研究表明小胶质细胞被Aβ激活后,使NADPH氧化酶的活性增强而使ROS产生增多是AD发病的病因之一。脑内ROS产生和释放增加会损害膜蛋白功能而影响离子稳态平衡,造成膜去极化和钙内流增多,从而促使有效氧自由基产生增多,导致细胞蛋白质、脂质的过氧化和DNA损伤,最终导致神经细胞的死亡。
在AD患者的脑组织内还发现活化的小胶质细胞能诱导iNOS产生和释放NO增多而导致神经元的损伤和调亡。NO 是重要的内源性介质,在中枢神经系统中,可作为特殊的神经递质参与突触的可塑性、神经元的发育及学习记忆等生理过程,但过量的 NO可直接影响机体内能量代谢、蛋白质和DNA的功能,导致神经元的变性坏死,参与AD的发病过程[14,15]。内源性 NO是由iNOS产生的,在AD中小胶质细胞内的iNOS 能够持续不断地催化 NO 的产生,而过多的NO 具有潜在的神经毒性作用,并协同其他细胞因子损伤神经细胞导致AD的发生发展[16]。
在本实验中,我们用Aβ处理BV2小鼠小胶质细胞构建AD细胞模型,结果发现Aβ可诱导BV2细胞产生明显的细胞毒性作用,产生强烈的氧化应激反应,包括细胞内活性氧ROS产生增加,NO释放增多。这些结果与以往其他学者的研究结果一致。但Aβ对小胶质细胞的毒性作用机制的研究尚不清楚。有研究发现,Aβ可通过NF-κB、JNK及MAPK等通路激活小胶质细胞而产生细胞毒性作用[17]。JAK/STAT细胞信号转导通路也被认为与多种细胞因子的表达有非常密切的关系,其中,STAT3是该通路中重要的下游核转录因子[18~20]。Dominguez 等[21]研究表明在外周神经损伤后出现脊髓小胶质细胞中 STAT3明显激活。又有研究表明STAT3在AD小鼠的脑组织中的表达增高,抑制STAT3的表达或是激活都能明显改善由Aβ导致的神经元的凋亡。许多研究表明,STAT3参与Aβ引起小胶质细胞激活的过程及转录调节多种细胞因子的表达[22]。在前期实验中我们用Aβ刺激BV2小胶质细胞发现磷酸化的STAT3的表达水平明显增高,为了更进一步明确Aβ诱导的小胶质细胞产生的毒性作用与STAT3之间的关系,本实验采用siRNA干扰技术沉默BV2 细胞中STAT3的表达,STAT3沉默后的细胞再用Aβ处理,结果发现与单纯Aβ处理组相比,BV2小胶质细胞产生的氧化应激水平明显减弱包括细胞内活性氧ROS产生减少,NO释放减少。因此,我们认为Aβ作用于小胶质细胞后,首先与小胶质细胞的表面受体结合后激活细胞内信号转导通路,刺激STAT3的活化并向细胞核内转导,从而介导神经毒性因子表达释放增多而引起小胶质细胞产生强烈的氧化应激反应。STAT3可能参与调控Aβ诱导小胶质细胞的活化及释放毒性因子的过程。由于体外实验的有限性和差异性,还需进一步在体内实验上进行深入研究。
